Elementos y clasificación (tabla periódica)
1. ¿Qué es un elemento?
Un elemento es una sustancia pura que ya no se puede separar más en otras más simples por métodos (reacciones) químicos.
Cada elemento químico está constituido por átomos con las mismas propiedades químicas.
Los elementos químicos se identifican mediante nombres dados en la antigüedad, derivados de alguna propiedad de los mismos.
En la naturaleza existen 92 elementos.
2. Metales y no metales
Los elementos según sus propiedades los podemos clasificar en dos grupos generales:
2.1 Metales:
- Son sólidos a temperatura ambiente (excepto el mercurio).
- Reflejan la luz de una forma característica (brillo metálico).
- Son dúctiles, ya que se pueden estirar en hilos.
- Son maleables, ya que con ellos se pueden hacer planchas o láminas fácilmente.
2.2 No Metales:
- No tienen brillo metálico.
- Pueden ser sólidos, líquidos o gases a temperatura ambiente.
- No conducen la electricidad.
- En general son frágiles.
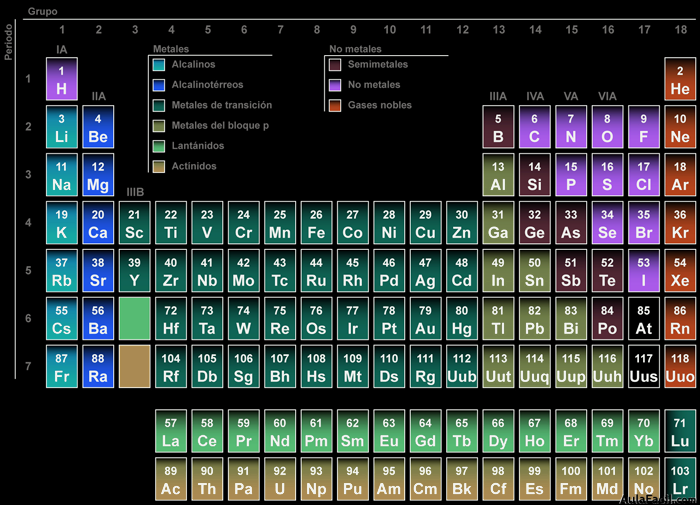
3. Clasificación de los elementos
3.1 La tabla de Mendeleiev
Esta tabla consiste, en síntesis, en disponer los elementos químicos en un cuadro en orden creciente de sus masas atómicas, notándose una analogía en sus propiedades cada cierto número de elementos (por eso se denomina tabla periódica).
Mendeleiev demostró que los elementos con propiedades químicas semejantes aparecían periódicamente, dando lugar a ocho grupos. En algunos lugares faltaba un elemento, pero Mendeleiev no dudó en predecir su existencia y su comportamiento químico, lo que posteriormente se confirmó.
3.2 La tabla periódica actual
Aunque está basada en la propuesta por D. Mendeleiev en 1869, el criterio de ordenación (debido entre otros a los estudios de Henry Moseley) es otro. En ella, los elementos se encuentran ordenados de izquierda a derecha por valores crecientes de sus números atómicos (Z). Además de esto, los elementos aparecen distribuidos en filas y columnas.
Existen 7 filas horizontales que se denominan períodos y 18 columnas verticales que se denominan grupos.
Los elementos también se clasifican en: metales, no metales, semimetales y gases nobles; de acuerdo con sus propiedades para ganar o perder electrones.

http://www.aulafacil.com
1. Antecedentes de la tabla periódica.
2. Ley periódica
Fueron varios los intentos que se hicieron para ordenar los elementos de una forma sistemática.
En 1817 J. W. Doberiner, químico alemán, recomendó la clasificación de los elementos por tríadas, ya que encontró que la
masa atómica del estroncio, se acerca mucho al promedio de las masas atómicas dos metales similares: calcio y bario.
masa atómica del estroncio, se acerca mucho al promedio de las masas atómicas dos metales similares: calcio y bario.
Encontró otras tríadas como litio, sodio y potasio, o cloro, bromo y yodo; pero como no consiguió encontrar suficientes tríadas para que el sistema fuera útil.
La distribución más exitosa de los elementos fue desarrollada por Dimitrii Mendeleev (1834-1907), químico ruso. En la tabla de Mendeleev los elementos estaban dispuestos principalmente en orden de peso atómico creciente, aunque había algunos casos en los que tuvo que colocar en elemento con masa atómica un poco mayor antes de un elemento co una masa ligeramente inferior. Por ejemplo, colocó el telurio (masa atómica 127.8) antes que el yodo (masa atómica 126.9) porque el telurio se parecía al azufre y al selenio en sus propiedades, mientras que el yodo se asemejaba al cloro y al bromo. Mendeleev dejó huecos en su tabla, pero él vio éstos espacios no como un error, sino que éstos serían ocupados por elementos aun no descubiertos, e incluso predijo las propiedades de algunos de ellos.
Después del descubrimiento del protón, Henry G. J. Moseley (1888-19915), físico británico, determinó la carga nuclear de los átomos y concluyó que los elementos debían ordenarse de acuerdo a sus números atómicos crecientes, de está manera los que tienen propiedades químicas similares se encuentran en intervalos periódicos definidos, de aquí se deriva la actual ley periódica:
| "Los elementos están acomodados en orden de sus número atómicos crecientes y los que tienen propiedades químicas similares se encuentran en intervalos definidos." |
3. Periodos, grupos, familias, bloques y clases de elementos en la tabla periódica.
PERIODOS.- Son los renglones o filas horizontales de la tabla periódica. Actualmente se incluyen 7 periodos en la tabla periódica.
GRUPOS.- Son las columnas o filas verticales de la tabla periódica. La tabla periódica consta de 18 grupos. Éstos se designan con el número progresivo, pero está muy difundido el designarlos como grupos A y grupos B númerados con con números romanos. Las dos formas de designarlos se señalan en la tabla periódica mostrada al inicio del tema.
CLASES.- Se distinguen 4 clases en la tabla periódica:
| ELEMENTOS REPRESENTATIVOS: | Están formados por los elementos de los grupos "A". |
| ELEMENTOS DE TRANSICIÓN: | Elementos de los grupos "B", excepto lantánidos y actínidos. |
| ELEMENTOS DE TRANSICIÓN INTERNA: | Lantánidos y actínidos. |
| GASES NOBLES: | Elementos del grupo VIII A (18) |
FAMILIAS.- Están formadas por los elementos representativos (grupos "A") y son:
GRUPO
|
FAMILIA
|
I A
| Metales alcalinos |
II A
| Metales alcalinotérreos |
III A
| Familia del boro |
IV A
| Familia del carbono |
V A
| Familia del nitrógeno |
VI A
| Calcógenos |
VII A
| Halógenos |
VIII A
| Gases nobles |
BLOQUES.- Es un arreglo de los elementos de acuerdo con el último subnivel que se forma.
| BLOQUE "s" | GRUPOS IA Y IIA | |
| BLOQUE "p" | GRUPOS III A al VIII A | |
| BLOQUE "d" | ELEMENTOS DE TRANSICIÓN | |
| BLOQUE "f" | ELEMENTOS DE TRANSICIÓN INTERNA |
EJERCICIO RESUELTO DE TABLA PERIÓDICA.-
Complete la siguiente tabla.
|
Símbolo
|
Ni
|
Li
|
Sb
|
Tb
|
|
Nombre
|
Níquel
|
Litio
|
Antimonio
|
Terbio
|
|
Grupo
|
VIII B
|
I A
|
V A
|
III B
|
|
Periodo
|
4
|
2
|
5
|
6
|
|
Clase
|
Transición
|
Representativo
|
Representativo
|
Transición interna
|
Familia
|
---------------
|
Metal alcalino
|
del nitrógeno
|
--------------
|
Bloque
|
d
|
s
|
p
|
f
|
Carácter metálico
|
Metal
|
Metal
|
Metaloide
|
Metal
|
Ejercicio propuesto.- Complete la siguiente tabla con la información requerida Nombre Yodo Calcio
|
Nombre
| |
Yodo
| |
Calcio
|
|
Símbolo
|
Cm
| |
S
| |
|
Grupo
| | | | |
|
Periodo
| | | | |
|
Clase
| | | | |
|
Familia
| | | | |
|
Bloque
| | | | |
|
Carácter metálico
| | | | |
4. Relación de la tabla periódica con la configuración electrónica.
| Periodo | Representa el nivel de energía más externo | |
| Bloque | Representa el último subnivel que se está llenando. | |
| Número de grupo | Representa los electrones de valencia.(para los representativos) | |
| Elementos de grupos "B" | Tienen 2 electrones de valencia |
Ejercicio resuelto.-
Complete la siguiente tabla.
Complete la siguiente tabla.
Símbolo
|
Número de energía más externo
|
Último subnivel que se forma
|
Electrones de valencia
|
Estructura de Lewis
|
Rb
|
5
|
s
|
1
|
•Rb
|
Cl
|
3
|
p
|
7
|
..
: Br :. |
Cu
|
4
|
d
|
2
|
: Cu
|
Ho
|
6
|
f
|
2
|
: Os
|
Ejercicios propuestos.-
Complete la siguiente tabla con los datos requeridos.
Complete la siguiente tabla con los datos requeridos.
|
Símbolo
|
Último subnivel que se forma
|
Nivel de energía más externo
|
Electrones de valencia
|
Estructura de Lewis
|
|
Fr
| | | | |
|
F
| | | | |
|
Gd
| | | | |
|
Al
| | | | |
|
Pd
| | | | |
5. Identificación de elementos en base a la configuración electrónica.
Conociendo la parte final de la configuración electrónica, podemos con ayuda de la tabla periódica identificar el elemento.
Ejemplos:
Ejemplos:
|
| 45Rh (rodio) | ||||||
| El coeficiente más grande indica el nivel que en éste caso es 5, la última letra indica el bloque "d " y en ese renglón en la parte del bloque "d " se cuenta el superíndice 7, empezando donde inicia el bloque "d ". | ||||||||
|
| 15P (fósforo) | ||||||
| Se busca en el renglón 3, contando 3 desde donde inicia el bloque "p". | ||||||||
|
| 67Ho (holmio) | ||||||
| Buscamos en el periodo 6, contando 11 en el bloque "f". | ||||||||
|
| 28Ni (niquel) | ||||||
| Buscamos en el periodo 4, contando 8 en el bloque "d". | ||||||||
| 37Rb(rubidio) | |||
| Periodo 5, bloque s en el primer grupo (IA) | ||||
EJERCICIO.- Escriba sobre la línea el número atómico y el símbolo del elemento que corresponda.
|
|
|
|
|
|
6.- Propiedades periódicas.
Ciertas propiedades de los elementos pueden predecirse en base a su posición en la tabla periódica, sobre toda en forma comparativa entre los elementos.
ELECTRONEGATIVIDAD.- Es una medida de la tracción que ejerce un átomo de una molécula sobre los electrones del enlace. En la tabla periódica la electronegatividad en los periodos aumenta hacia la derecha y en los grupos aumenta hacia arriba.
AFINIDAD ELECTRÓNICA.- Cantidad de energía desprendida cuando un átomo gana un electrón adicional. Es la tendencia de los átomos a ganar electrones. La afinidad electrónica aumenta en los periodos hacia la derecha, y en los grupos hacia arriba.
ENERGÍA DE IONIZACIÓN.- Cantidad de energía que se requiere para retirar el electrón más débilmente ligado al átomo. La energía de ionización en los periodos aumenta hacia la derecha y en los grupos, aumenta hacia arriba.
RADIO ATÓMICO.- El radio atómico es la distancia media entre los electrones externos y el núcleo. En términos generales, el radio atómico aumenta hacia la izquierda en los periodos, y hacia abajo en los grupos. A continuación se muestran los radios atómicos de los elementos representativos expresados en picómetros.
CARÁCTER METÁLICO.- La división entre metales y no metales es clara en la tabla. El carácter metálico se refiere a que tan marcadas son las propiedades metálicos o no metálicos con respecto a otros elementos. El carácter metálico aumenta en los periodos hacia la izquierda y en los grupos hacia abajo.
Ejemplos:
| 1) | Decreciente de afinidad electrónica Ra, Fe, N, Cu, W: Decreciente significa de mayor a menor, si es afinidad electrónica, los más grandes están arriba a la derecha, entonces ordenamos hacia abajo y hacia la izquierda, usando el símbolo > (mayor que). |
| N>Cu>Fe>W>Ra |
| 2) | Creciente de electronegatividad Zn, Rb, O, Cr, Al Creciente significa de menor a mayor, si es electronegatividad, los menos electronegativos están abajo a la izquierda. Se ordenan de abajo hacia arriba, de izquierda a derecha y utilizando el símbolo < (menor que.) |
| Rb |
| 3) | Decreciente de radio atómico Sr, F, Cs, S, As De mayor a menor, los átomos más grandes están abajo la izquierda, ordenamos entonces hacia arriba y hacia la derecha. |
| Cs> Sr>As>S>F |
| 4) | Creciente de carácter metálico Ag, P, Ir, Ba, Ga De menor a mayor, los menos "metálicos" están a la derecha y arriba, entonces ordenamos hacia la izquierda y hacia a bajo. |
| P |
Ejercicios.-
Ordene las siguientes serie de elementos de la forma indicada.
Ordene las siguientes serie de elementos de la forma indicada.
| 1) | Decreciente de energía de ionización Zr, Co, C, Sr, Nb | ___________________________________________ |
| 2) | Creciente de radio atómico Sc, Si, Mn, Rb, B | ___________________________________________ |
| 3) | Creciente de afinidad electrónica Re, Zn, Fr, O, Ge | ___________________________________________ |
| 4) | Decreciente de electronegatividad K, As, V, S, Rb | ___________________________________________ |
| 5) | Decreciente de carácter metálico Br, Cu, Sr, Cl, Fe |
http://genesis.uag.mx/edmedia/material/qino/T4.cfm
No hay comentarios:
Publicar un comentario