La física molecular estudia problemas relacionados con la estructura atómica de la materiay su interacción con el medio. Por ejemplo, se tratan problemas como dinámica de reacciones, dispersión, interacciones con campos electromagnéticos estáticos y dinámicos, enfriamiento y atrapamiento de átomos, interferometría atómica, interacciones de haces de iones y átomos con superficies y sólidos. Además, tiene múltiples conexiones con la biología, la fisicoquímica, las ciencias de los materiales, la óptica, la física de la atmósfera, la física del plasma y la astrofísica, entre otras. Desempeña un papel fundamental en la solución de preguntas fundamentales sin resolver en el estudio de los átomos y las moléculas.
configuración electrónica indica la manera en la cual los electrones se estructuran o se modifican en un átomo de acuerdo con el modelo de capas electrónicas, en el cuál las funciones de ondas del sistema se expresa como un átomo o atomicamente un producto de orbitales antisimetrizadas.1 2 La configuración electrónica es importante porque determina las propiedades de combinación química de los átomos y por tanto su posición en la tabla periódica.
Introducción
La disposición de los electrones en los átomos está sujeta a las reglas de la mecánica cuántica. En particular la configuración electrónica viene dada por una combinación de estados cuánticos que son solución de la ecuación de Schrödinger para dicho átomo.
Una de las restricciones de la mecánica cuántica no explícitamente contenida en la ecuación de Schrödinger es que cualquier conjunto de electrones en un mismo estado cuántico deben cumplir el principio de exclusión de Pauli por ser fermiones (partículas de espín semientero). Dicho principio implica que la función de onda total que describe dicho conjunto de electrones debe ser antisimétrica.3 Por lo tanto, en el momento en que un estado cuántico es ocupado por un electrón, el siguiente electrón debe ocupar un estado cuántico diferente.
En los estados estacionarios de un átomo, la función de onda de un electrón en una aproximación no-relativista los estados que son función propia de la ecuación de Schrödinger en donde es el hamiltoniano monoelectrónico correspondiente. Para el caso relativista hay que recurrir a la ecuación de Dirac. Las funciones propias obtenidas como solución de cualquiera de estas dos estaciones se denominan orbitales atómicos, por analogía con la imagen clásica de electrones orbitando alrededor del núcleo. Estos orbitales, en su expresión más básica, se pueden enumerar mediante cuatro números cuánticos: n, l, ml y ms. Obviamente, el principio de exclusión de Pauli implica que no puede haber dos electrones en un mismo átomo con los cuatro valores de los números cuánticos iguales (porque entonces ocuparían el mismo orbital y eso está excluido por el principio).
De acuerdo con la mecánica cuántica, los electrones pueden pasar de un orbital atómico a otro ya sea emitiendo o absorbiendo un cuanto de energía, en forma de fotón. Esta transición de un orbital a otro con diferentes energías explican diversos fenómenos de emisión y absorción de radiación electromagnética por parte de los átomos.
Notación
Se utiliza en una notación estándar para describir las configuraciones electrónicas de átomos y moléculas. Para los átomos, la notación contiene la definición de los orbitales atómicos (en la forma n l, por ejemplo 1s, 2p, 3d, 4f) indicando el número de electrones asignado a cada orbital (o al conjunto de orbitales de la misma subcapa) como un superíndice. Por ejemplo, el hidrógeno tiene un electrón en el orbital s de la primera capa, de ahí que su configuración electrónica se escriba 1s1. El litio tiene dos electrones en la subcapa 1s y uno en la subcapa 2s (de mayor energía), de ahí que su configuración electrónica se escriba 1s2 2s1 (pronunciándose "uno-ese-dos, dos-ese-uno"). Para el fósforo (número atómico 15), tenemos: 1s2 2s2 2p6 3s2 3p3.
Para átomos con muchos electrones, esta notación puede ser muy larga por lo que se utiliza una notación abreviada, que tiene en cuenta que las primeras subcapas son iguales a las de algún gas noble. Por ejemplo, el fósforo, difiere del argón y neón (1s2 2s2 2p6) únicamente por la presencia de la tercera capa. Así, la configuración electrónica del fósforo se puede escribir respecto de la del neón como: [Ne] 3s2 3p3. Esta notación es útil si tenemos en cuenta que la mayor parte de las propiedades químicas de los elementos vienen determinadas por las capas más externas.
El orden en el que se escriben los orbitales viene dado por la estabilidad relativa de los orbitales, escribiéndose primero aquellos que tienen menor energía orbital. Esto significa que, aunque sigue unas pautas generales, se pueden producir excepciones. La mayor parte de los átomos siguen el orden dado por la regla de Madelung. Así, de acuerdo con esta regla, la configuración electrónica del hierro se escribe como: [Ar] 4s2 3d6. Otra posible notación agrupa primero los orbitales con el mismo número cuántico n, de tal manera que la configuración del hierro se expresa como [Ar] 3d6 4s2 (agrupando el orbital 3d con los 3s y 3p que están implícitos en la configuración del argón).
El superíndice 1 de los orbitales ocupados por un único electrón no es obligatorio.4 Es bastante común ver las letras de los orbitales escritas en letra itálica o cursiva. Sin embargo, la Unión Internacional de Química Pura y Aplicada (IUPAC) recomienda utilizar letra normal, tal y como se realiza aquí.
Origen histórico
Niels Bohr fue el primero en proponer (1923) que la periodicidad en las propiedades de los elementos se podía explicar mediante la estructura electrónica del átomo.5Su propuesta se basó en el modelo atómico de Bohr para el átomo, en el cual las capas electrónicas eran órbitas electrónicas a distancias fijas al núcleo. Las configuraciones originales de Bohr hoy parecen extrañas para el químico: al azufre se le asignaba una configuración 2.4.4.6 en vez de 1s2 2s2 2p6 3s2 3p4.
Un año después, E. C. Stoner incorpora el tercer número cuántico de la teoría de Sommerfeld en la descripción de las capas electrónicas, y predice correctamente la estructura de capas del azufre como 2.8.6.6 Sin embargo, ni el sistema de Bohr ni el de Stoner podían describir correctamente los cambios del espectro atómico en un campo magnético (efecto Zeeman).
Distribución electrónica
Es la distribución de los electrones en los subniveles y orbitales de un átomo. La configuración electrónica de los elementos se rige según el diagrama de Moeller:
Para comprender el diagrama de Moeller se utiliza la siguiente tabla:
| s | p | d | f | |
|---|---|---|---|---|
Para encontrar la distribución electrónica se escriben las notaciones en forma diagonal desde arriba hacia abajo y de derecha a izquierda (seguir colores):
Este principio de construcción (denominado principio de Aufbau, del alemán Aufbau que significa 'construcción') fue una parte importante del concepto original de Bohr de configuración electrónica. Puede formularse como:7
- sólo se pueden ocupar los orbitales con un máximo de dos electrones, en orden creciente de energía orbital: los orbitales de menor energía se llenan antes que los de mayor energía.
Así, vemos que se puede utilizar el orden de energías de los orbitales para describir la estructura electrónica de los átomos de los elementos. Un subnivel s se puede llenar con 1 o 2 electrones. El subnivel p puede contener de 1 a 6 electrones; el subnivel d de 1 a 10 electrones y el subnivel f de 1 a 14 electrones. Ahora es posible describir la estructura electrónica de los átomos estableciendo el subnivel o distribución orbital de los electrones. Los electrones se colocan primero en los subniveles de menor energía y cuando estos están completamente ocupados, se usa el siguiente subnivel de energía superior. Esto puede representarse por la siguiente tabla:
| s | p | d | f | |
|---|---|---|---|---|
Para encontrar la configuración electrónica se usa el mismo procedimiento anterior incluyendo esta vez el número máximo de electrones para cada orbital.
Finalmente la configuración queda de la siguiente manera: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Para determinar la configuración electrónica de un elemento, basta con calcular cuántos electrones hay que acomodar y entonces distribuirlos en los subniveles empezando por los de menor energía e ir llenando hasta que todos los electrones estén distribuidos. Un elemento con número atómico mayor tiene un electrón más que el elemento que lo precede. El subnivel de energía aumenta de esta manera:
- Subnivel s, p, d o f: Aumenta el nivel de energía.
Sin embargo, existen excepciones, como ocurre en los elementos de transición al ubicarnos en los grupos del cromo y del cobre, en los que se promueve el electrón dando así una configuración fuera de lo común.
Estructura electrónica y tabla periódica
Bloques de la tabla periódica
La forma de la tabla periódica está íntimamente relacionada con la configuración electrónica de los átomos de los elementos. Por ejemplo, todos los elementos del grupo 1 tienen una configuración de [E] ns1 (donde [E] es la configuración del gas inerte correspondiente), y tienen una gran semejanza en sus propiedades químicas. La capa electrónica más externa se denomina "capa de valencia" y (en una primera aproximación) determina las propiedades químicas. Conviene recordar que el hecho de que las propiedades químicas eran similares para los elementos de un grupo fue descubierto hace más de un siglo, antes incluso de aparecer la idea de configuración electrónica.8 No está claro cómo explica la regla de Madelung (que más bien describe) la tabla periódica,9 ya que algunas propiedades (tales como el estado de oxidación +2 en la primera fila de los metales de transición) serían diferentes con un orden de llenado de orbitales distinto.
Regla de exclusión de Pauli
Esta regla nos dice que en un estado cuántico solo puede haber un electrón. De aquí salen los valores del espín o giro de los electrones que es 1/2 y con proyecciones .
También que en una orientación deben caber dos electrones excepto cuando el número de electrones se ha acabado, por lo cual el orden que debe seguir este ordenamiento en cada nivel es primero los de espín positivo (+1/2) y luego los negativos.
El principio de exclusión de Pauli fue un principio cuántico enunciado por Wolfgang Ernst Pauli en 1925. Establece que no puede haber dos fermiones con todos sus números cuánticos idénticos (esto es, en el mismo estado cuántico de partícula individual). Perdió la categoría de principio, pues deriva de supuestos más generales: de hecho, es una consecuencia del teorema de la estadística del spin. El principio de exclusión de Pauli sólo se aplica a fermiones, esto es, partículas que forman estados cuánticos antisimétricos y que tienen espín semientero. Son fermiones, por ejemplo, los protones, los neutrones y los electrones, los tres tipos de partículas subatómicas que constituyen la materia ordinaria. El principio de exclusión de Pauli rige, así pues, muchas de las características distintivas de la materia. En cambio, partículas como el fotón y el (hipotético) gravitón no obedecen a este principio, ya que son bosones, esto es, forman estados cuánticos simétricos y tienen espín entero. Como consecuencia, una multitud de fotones puede estar en un mismo estado cuántico de partícula, como en los láseres. "Dos electrones en la corteza de un átomo no pueden tener al mismo tiempo los mismos números cuánticos". Es sencillo derivar el principio de Pauli, basándonos en el artículo de partículas idénticas. Los fermiones de la misma especie forman sistemas con estados totalmente antisimétricos, lo que para el caso de dos partículas significa que:
mismo estado cuántico |ψ>, el estado del sistema completo es |ψψ>.
Regla del octeto
Para que un átomo sea estable debe tener todos sus orbitales llenos (cada orbital con dos electrones, uno de espín +½ y otro de espín -½) Por ejemplo, el oxígeno, que tiene configuración electrónica 1s², 2s², 2p4, debe llegar a la configuración 1s², 2s², 2p6 con la cual los niveles 1 y 2 estarían llenos. Recordemos que la Regla del octeto, justamente establece que el nivel electrónico se completa con 8 electrones, excepto el hidrógeno, que se completa con 2 electrones. Entonces el oxígeno tendrá la tendencia a ganar los 2 electrones que le faltan, por esto se combina con 2 átomos de hidrógeno (en el caso del agua, por ejemplo), que cada uno necesita 1 electrón (el cual recibe del oxígeno) y otorga a dicho átomo 1 electrón cada uno. De este modo, cada hidrógeno completó el nivel 1 y el oxígeno completó el nivel 2.
En química se denomina orbital a la zona del espacio que rodea a un núcleo atómico donde la probabilidad de encontrar un electrón es máxima, cercana al 91%. Ejemplo de ello: 10Ne: 1s2, 2s2, 2p6 regla del octeto: 11Na:(Ne)10, 1s2, 2s2, 2p6, 3s1
Anomalías de configuración electrónica
Al desarrollar la configuración electrónica, encontramos una serie de excepciones. Por ejemplo, es más estable llenar dos medios orbitales que completar uno y dejar el otro a uno o dos electrones de estar completado a la mitad. Así, los metales del grupo 6 en vez de tener los orbitales externos s completos y el orbital d a un electrón de estar semi-completo, donarán un electrón del orbital s al orbital d, quedando ambos completos a la mitad: s1d5 en vez de s2d4. Igualmente, es más estable rellenar los orbitales d completamente, por lo que los elementos del grupo 11 tenderán a adoptar la configuración s1d10 en vez de s2d9. Ejemplos de estas anomalías son:
Grupo VIB:
24Cr: 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d4 : es incorrecto.
24Cr: 1s2, 2s2, 2p6, 3s2, 3p6, 4s1, 3d5 : es correcto.
Grupo IB:
29Cu: 1s2, 2s2, 2p6, 3s2, 3p6, 4s1, 3d10 : es correcto.
ER: n + l
Donde:
n: nivel l: subnivel
Ejemplo:
4s: 4 + 0 : 4
3p: 3 + 1 : 4
4d: 4 + 2 : 6
5f: 5 + 3 : 8
6g: 6 + 4 : 10
7h: 7 + 5 : 12
Orbital o REEMPE
En química se usa la expresión REEMPE para designar el valor esperado de un operador densidad de estados de dos electrones con . En otras palabras: la región donde existe mayor posibilidad de encontrar como máximo 2 electrones que se mueven en forma paralela y en sentidos contrarios. Su nombre proviene de Región de Espacio Energético de Manifestación Probabilística del Electrón.
electrónica molecular, de igual modo conocida como moletrónica, es la rama de la ciencia encargada del estudio y aplicación de bloques de construcción moleculares para la fabricación de componentes electrónicos.1 Se acentúa el uso de moléculas orgánicas para esta tecnología. Es un área interdisciplinaria en la cual se involucra la física, química, la ciencia de materiales, entre otras. La principal característica que une a estas ciencias es el uso de los bloques moleculares que permiten la elaboración de componentes electrónicos. Debido a la visión forjada en cuanto a la reducción de escalas ofrecida entre las propiedades de la electrónica molecular, la moletrónica ha generado expectativas altas. La electrónica molecular proveerá los medios suficientes para sobrepasar a la Ley de Moore, y extenderla mucho más allá de los límites visibles dentro de los sistemas de circuitos integrados a escala pequeña de silicio.
Historia
Los primeros trabajos registrados acerca de la transferencia de cargas eléctricas entre moléculas fueron realizados por Robert Mulliken y Albert Szent-Gyorgi en 1940, en su discusión del complejo de transferencia de carga “donante-aceptor”. Sin embargo, el primer dispositivo moletrónico no fue desarrollado hasta 1974, año en el que Ari Aviram y Mark Ratner ilustraron un rectificador (diodo) molecular teórico.2 En 1988, Aviram, describió una molécula capaz de actuar como un transistor de efecto campo (FET). Más adelante, conceptos como los propuestos por Forrest Carter del Laboratorio de Investigación Naval de los Estados Unidos, incluían compuertas lógicas unimoleculares. Entre un amplio rango de ideas discutidas en su conferencia “Dispositivos para Electrónica Molecular” de 1988. Estos eran ideas teóricas, no construidas, sobre posibles aplicaciones que se les podían atribuir al campo de la moletrónica.
La electrónica a escala molecular
La electrónica convencional (electrónica del silicio), desde sus orígenes en 1958, se ha caracterizado por trabajar con materiales en estado a granel. Fue entonces, que la periódica miniaturización en la elaboración, la complejidad y desempeño de los circuitos integrados iban creciendo de manera exponencial, que la ley de Moore se propuso. Y a partir de ahí, los componentes embebidos se han ido fabricando acorde a dicha ley. Los recientes avances en nanotecnología, y el descubrimiento de polímeros conductores y semiconductores (merecedor del premio Nobel de Química del año 2000), han permitido avances espectaculares en la materia. Como se van reduciendo en tamaño las dimensiones de las estructuras de trabajo, la sensibilidad en la desviación incrementa, también. Hasta hoy, la gran mayoría de las técnicas empleadas en la fabricación de componentes electrónicos ha sido de Top-down(fotolitografía), mientras que los acercamientos Bottom-Up han ido ganando terreno poco a poco. En la moletrónica, el material a granel es reemplazado por un sistema molecular. Es decir, en lugar de tomar un sustrato y llevarlo a un maquinado de grabado, los átomos son unidos mediante reacciones químicas en un laboratorio. Tomando en cuenta que las moléculas son las estructuras estables más pequeñas imaginables a la actualidad, la miniaturización en procesos es la meta máxima para los circuitos electrónicos. La moletrónica es un área real y en desarrollo, pero de momento, su factibilidad es muy limitada. La moletrónica basa sus principios en materiales de la química orgánica, y éstos, en ocasiones, no son lo suficientemente estables para poder albergar o incorporarse debidamente a un sistema eléctrico complejo.
Base teórica
La electrónica molecular opera dentro del rango cuántico, esto es, en dimensiones menores a los 100 nanómetros. Este tipo de escalamiento hace que los efectos cuánticos sean los que rijan las propiedades del material. Como un ejemplo tenemos al flujo de electrones, en donde componentes de electrónica convencional requieren el paso continuo de éstos para el ensanchamiento y apertura de canales; a diferencia de los sistemas moletrónicos, donde la transferencia de un solo electrón puede provocar una alteración significante en el sistema, ionizando la molécula y haciendo más difícil que otro más se transfiera (bloqueo de Coulomb). La teoría de la electrónica molecular se basa en un sistema cuántico en condiciones de no-equilibrio (conducidas por voltaje). Cuando el régimen de sesgo en el voltaje es demasiado pequeño, el estado de no-equilibrio puede ignorarse; no así, cuando el sesgo de la señal es más alto, el cual requiere de un tratamiento más sofisticado, debido que ya no existe un principio variacional. Más, el conectado de moléculas para circuitos a mayor escala se ha mostrado un gran reto, y es un obstáculo mayúsculo para su comercialización.
Ejemplos
En la moletrónica, los sistemas conjugados (alternaciones entre enlaces sencillos y dobles) son predominantes. La razón es para posibilitar el flujo libre de electrones a lo largo del sistema.
Cables
Como su categoría lo dice, son materiales inactivos, cuyo único propósito es el de conectar distintas partes dentro del circuito. Los cables no están funcionalizados, y son repeticiones del mismo bloque de construcción. Como ejemplo de cables está el nanotubo de carbono, que aunque algo largo al lado de otras sugerencias, muestra propiedades electrónicas más prometedoras.
Transistores
Los transistores de una sola molécula son diferentes, fundamentalmente, a los que están hechos en la electrónica de mayor escala. La compuerta en un FET convencional determina la conductancia entre los electrodos de fuente y de drenado controlando la densidad de carga entre ellos. Por otro lado, la compuerta de un transistor unimolecular controla la posibilidad de que un solo electrón salte dentro y fuera de la molécula modificando la energía del orbital molecular. Este efecto crea que el sistema actúe de manera casi binaria, o está encendido o se encuentra apagado. Es la cuantización de la carga en los electrones la responsable por la diferencia tan marcada en su comportamiento. Debido a que se trata solamente con moléculas, es la transferencia de un solo electrón la que termina determinando si el sistema se inicia o apaga. Para que esto suceda, los orbitales moleculares en los electrodos no pueden estar muy integrados con los orbitales de la molécula-transistor. De no ser así, no se sabría si el electrón está en el electrodo o el transistor, y haría trabajar al transistor como un cable. Un grupo popular de moléculas que pueden funcionar como material de canal para el semiconductor es el de los oligopolifenilenvinilenos (OPVs) y los fulerenos, que trabajan por medio del bloqueo de Coulomb cuando se colocan entre la fuente y el drenado. El tamaño de las moléculas y la baja temperatura en que las medidas son tomadas, hace que los estados mecánicos cuánticos se encuentren bien definidos. Las propiedades mecánicas cuánticas pueden, entonces, ser ocupadas para aplicaciones con mayor propósito al de sólo transistores.
Rectificadores
Los rectificadores moleculares (Aviram y Ratner), son mímicas de sus contrapartes a granel. Y tienen una construcción asimétrica para promover el paso del electrón por un lado, más evitarlo por el otro. Estas moléculas tienen un extremo donador de electrones (D), y un extremo aceptor de electrones (A), y el resultado es una corriente eléctrica que puede ser acarreada a lo largo de la molécula.
Técnicas
Uno de los problemas principales que enfrenta la medición molecular es el de establecer un contacto eléctrico reproducible con una molécula sin crear corto circuitoentre los electrones. De momento no existe una metodología que permita crear espacios lo suficientemente pequeños para contactar ambos lados de las moléculas probadas. Estrategias alternativas son puestas en uso.
Espaciado molecular
Una manera de producir electrodos con un espaciado molecular entre ellos es rompiendo enlaces, donde un electrodo delgado es estirado hasta que se rompe. También está la electromigración, donde la corriente es conducida a través de un cable delgado que se derrite y los átomos emigran para producir la vacante. El alcance de la fotolitografía actual puede mejorarse con el grabado químico o la deposición metálica en el electrodo. La manera más sencilla para efectuar medidas en algunas moléculas, posiblemente, es por medio de Microscopio de efecto túnel (STM), el cual contacta moléculas adheridas al otro extremo del substrato metálico.
Anclaje
Tomando provecho de la alta afinidad del azufre hacia el oro, es posible anclar moléculas a los electrodos. En esta configuración se agrega al extremo de las moléculas átomos de azufre que emularán ser pinzas caimán conectándose a los electrodos de oro. Esta técnica no es específica, pues el anclaje termina adhiriendo las moléculas a cualquier superficie de oro. La resistencia del contacto es altamente dependiente de la geometría atómica alrededor del sitio de anclaje y compromete la reproducibilidad de la conexión. Los fulerenos se han mostrado como una alternativa viable, debido a que su conjugación π puede contactar más átomos que el azufre.
Nanoelectrónica del carbono
La mayoría de la moléculas poliméricas alcanzan son aislantes eléctricos cuando exceden ciertos nanómetros. Aun así, el carbono natural (grafito) es conductor. Viéndolo de un punto de vista teórico, el grafeno es un semi-metal, una categoría que recae entre los metales y los semiconductores. Posee una estructura de capas, donde cada capa es de un átomo de grueso. Entre cada capa, las interacciones son lo suficientemente débiles que permiten escisión manual.3 Los Buckminsterfullereno, descubiertos al cierre del siglo XX, son objetos grafíticos redondos hechos con el “número mágico” 60. Estos clústers de carbono caracterizado por el grupo de Richard Smalley, y después analizada su estructura por Harry Kroto, sugieren que la estructura tiene la exacta simetría de una pelota de fútbol soccer. Estos objetos rápidamente se catapultaron como bloques de construcción para la electrónica molecular.
Obstáculos
Artefactos encontrados
Cuando se trata de medir las características electrónicas de las moléculas, ocurren fenómenos artificiales que pueden ser difíciles de distinguir de un comportamiento molecular. Antes de ser descubiertos, este tipo de artefactos se encontraban caracterizados como propiedades pertinentes a las moléculas en cuestión.
Comercialización
Una de las principales dificultades para la electrónica molecular es la de ser comercialmente explotada, pues no existen de momento técnicas que permitan la fabricación en masa de éste tipo de tecnologías. También, se encuentra el hecho de que las temperaturas empleadas en la mayoría de las propuestas son a casi cero absoluto (273 K), lo que demanda el consumo de mucha energía. Actualmente, se ha presentado una nueva técnica para la introducción de la electrónica molecular en el mercado. Ésta se basa en la hibridación entre los dispositivos electrónicos de silicio, y las propuestas de la moletrónica, de manera que el cliente pueda familiarizarse poco a poco con los principios que ofrece esta área. Las hibridaciones ya se encuentran en marcha, pues existen empresas que empiezan a investigar y realizar éste tipo de pruebas.4
Aplicación y visión
Entre las distintas investigaciones hechas, y factibles aplicaciones para dispositivos creados con la electrónica molecular, podemos observar: Dispositivos como los diodos orgánicos emisores de luz (OLED por sus siglas en inglés), transistores orgánicos de efecto campo (OFET por sus siglas en inglés) o paneles solares orgánicos son ya conocidos en la industria. Interruptores quiral-ópticos dipolares hechos a base de quiropticeno, que almacenan la información de manera óptica.5 Existen empresas que se han fundado con la electrónica molecular, casos como Molecular Electronics Corp (MEC), Nanosys, Inc., Nantero, ZettaCore, Coatue Corp., Molecular Nanosystems, y más. Así también, se encuentran en investigación y adaptación para sistemas híbridos entre la moletrónica y la electrónica convencional compañías transnacionales como HP, IBM, Motorola.
Aunque paulatino, la rama de la moletrónica está en desarrollo. El cofundador de Intel y creador de la Ley de Moore, Gordon Moore, ha dicho que la electrónica convencional se acerca a sus límites físicos. Con respecto a su postulación de la ley con su nombre, dice: “si extrapolamos las todas las curvas juntas… nos quedamos sin gas, haciendo esto, para el año 2017.”6 Quizás, estos límites que afronta ahora la electrónica del silicio se conviertan en una verdadera oportunidad para el crecimiento y desarrollo de la electrónica molecular.
 en donde
en donde  es el
es el 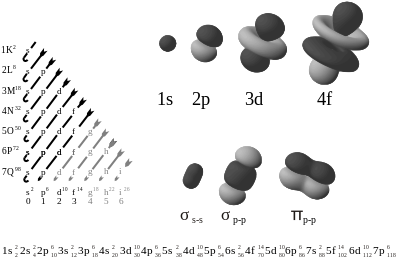
 y con proyecciones
y con proyecciones  .
. . En otras palabras: la región donde existe mayor posibilidad de encontrar como máximo 2 electrones que se mueven en forma paralela y en sentidos contrarios. Su nombre proviene de Región de Espacio Energético de Manifestación Probabilística del Electrón.
. En otras palabras: la región donde existe mayor posibilidad de encontrar como máximo 2 electrones que se mueven en forma paralela y en sentidos contrarios. Su nombre proviene de Región de Espacio Energético de Manifestación Probabilística del Electrón.
No hay comentarios:
Publicar un comentario