Un electrolito o electrólito es cualquier sustancia que contiene en su composición iones libres, que hacen que se comporte como un conductor eléctrico. Debido a que generalmente se encuentran iones en una solución, los electrolitos también son conocidos como soluciones iónicas, pero también son posibles electrolitos fundidos y electrolitos sólidos.
Electrolito líquido en un proceso de recubrimiento por electrólisis.
Principios
Comúnmente, los electrolitos existen como disoluciones de ácidos, bases o sales. Más aún, algunos gases pueden comportarse como electrolitos bajo condiciones de alta temperatura o baja presión. Las soluciones de electrolitos pueden resultar de la disolución de algunos polímeros biológicos (por ejemplo, ADN, polipéptidos) o sintéticos (por ejemplo, poliestirensulfonato, en cuyo caso se denominan polielectrolito) y contienen múltiples centros cargados. Las soluciones de electrolitos se forman normalmente cuando una sal se coloca en un solvente tal como el agua, y los componentes individuales se disocian debido a las interacciones entre las moléculas del solvente y el soluto, en un proceso denominado solvatación. Por ejemplo, cuando la sal común, NaCl se coloca en agua, sucede la siguiente reacción:
- NaCl(s) → Na+ + Cl−
También es posible que las sustancias reaccionen con el agua cuando se les agrega a ella, produciendo iones. Por ejemplo, el dióxido de carbono reacciona con agua para producir una solución que contiene iones hidronio, bicarbonato y carbonato.
En términos simples, el electrolito es un material que se disuelve completa o parcialmente en agua para producir una solución que conduce una corriente eléctrica.
Las sales fundidas también pueden ser electrólitos. Por ejemplo, cuando el cloruro de sodio se funde, el líquido conduce la electricidad.
Si un electrólito en solución posee una alta proporción del soluto se disocia para formar iones libres, se dice que el electrólito es fuerte; si la mayoría del soluto no se disocia, el electrólito es débil. Las propiedades de los electrólitos pueden ser explotadas usando la electrólisis para extraer los elementos químicos constituyentes.
Importancia fisiológica
En fisiología, los iones primarios de los electrólitos son sodio (Na+), potasio (K+), calcio (Ca2+), magnesio (Mg2+), cloruro (Cl−), hidrógeno fosfato (HPO42−) y bicarbonato (HCO3−).
Todas las formas de vida superiores requieren un sutil y complejo balance de electrólitos entre el medio intracelular y el extracelular. En particular, el mantenimiento de un gradiente osmótico preciso de electrólitos es importante. Tales gradientes afectan y regulan la hidratación del cuerpo, pH de la sangre y son críticos para las funciones de los nervios y los músculos, e imprescindibles para llevar a cabo la respiración. Existen varios mecanismos en las especies vivientes para mantener las concentraciones de los diferentes electrólitos bajo un control riguroso.
Tanto el tejido muscular y las neuronas son considerados tejidos eléctricos del cuerpo. Los músculos y las neuronas son activadas por la actividad de electrólitos entre el fluido extracelular o fluido intersticial y el fluido intracelular. Los electrólitos pueden entrar o salir a través de la membrana celular por medio de estructuras proteicasespecializadas, incorporadas en la membrana, denominadas canales iónicos. Por ejemplo, las contracciones musculares dependen de la presencia de calcio (Ca2+), sodio (Na+), y potasio (K+). Sin suficientes niveles de estos electrólitos clave, puede suceder debilidad muscular o severas contracciones musculares.
El balance de electrólitos se mantiene por vía oral o, en emergencias, por administración vía intravenosa (IV) de sustancias conteniendo electrólitos, y se regula mediante hormona, generalmente con los riñones eliminando los niveles excesivos. En humanos, la homeostasis de electrólitos está regulada por hormonas como la hormona antidiurética, aldosterona y la paratohormona. Los desequilibrios electrolíticos serios, como la deshidratación y la sobrehidratación pueden conducir a complicaciones cardíacas y neurológicas y, a menos que sean resueltas rápidamente, pueden resultar en una emergencia médica.
Medición
La medición de los electrólitos es un procedimiento diagnóstico realizado comúnmente, ejecutado vía examen de sangre con electrodos selectivos o urinálisis por tecnólogos médicos. La interpretación de estos valores es algo carente de significado sin la historia clínica y frecuentemente es imposible sin una medición paralela de la función renal. Los electrólitos medidos más frecuentemente son el sodio y el potasio. Los niveles de cloruro se miden rara vez, excepto para la interpretación de gas sanguíneo arterial dado que están vinculados inherentemente a los niveles de sodio. Un test importante llevado a cabo con la orina es el examen de gravedad específicapara determinar la existencia de desbalance electrolítico.
Bebidas deportivas
Los electrólitos suelen encontrarse en bebidas deportivas. En terapia de rehidratación oral, las bebidas con electrólitos contienen sales de sodio y potasio que restablecen el agua del cuerpo y los niveles de electrólitos después de la deshidratación causada por el ejercicio, diaforesis, diarrea, vómito, intoxicación o hambre.
No es necesario reemplazar las pérdidas de sodio, potasio y otros electrólitos durante el ejercicio, dado que no suele suceder una disminución significativa de las reservas corporales de estos minerales durante el entrenamiento normal. Sin embargo, en condiciones de ejercitación extrema por 5 o más horas (por ejemplo: hulk o ultramaratón), se recomienda el consumo de una bebida deportiva compleja con electrólitos.Elizabeth Quinn, (entrenador y profesional de la salud) [1]
Los atletas que no consumen electrólitos bajo estas condiciones corren el riesgo de sobrehidratación (o hiponatremia).
Debido a que las bebidas deportivas típicamente contienen niveles muy altos de azúcar, no son recomendados para su uso regular por niños. El agua es considerado la única bebida esencial para los niños durante el ejercicio. Hay disponibles sobres medicinales de rehidratación y bebidas para reemplazar a los electrólitos claves perdidos durante diarrea y otros problemas gastrointestinales. Los dentistas recomiendan que los consumidores regulares de bebidas deportivas tomen precauciones contra la caries dental. Otra opción disponible es el agua de coco, el cual contiene también electrolitos, sin embargo es bueno verificar que no tenga azúcar añadida.
Las bebidas deportivas y electrólicas pueden ser hechas en casa, usando las proporciones correctas de azúcar, sal y agua.[2]
Electroquímica
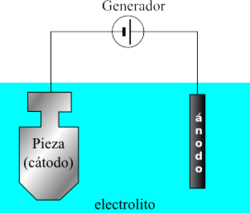
Cuando se coloca un electrodo en un electrólito y se aplica un voltaje, el electrólito conducirá electricidad. Los electrones solos normalmente no pueden pasar a través del electrólito; en vez de ello, una reacción química sucede en el cátodo, consumiendo los electrones del cátodo, y otra reacción ocurre en el ánodo, produciendo electrones para ser capturados por el ánodo. Como resultado, una nube de carga negativa se desarrolla en el electrólito alrededor del cátodo, y una carga positiva se desarrolla alrededor del ánodo. Los iones en el electrólito se mueven para neutralizar estas cargas para que las reacciones puedan continuar y los electrones puedan seguir fluyendo.
Por ejemplo, en una solución de sal ordinaria (cloruro de sodio, NaCl) en agua, la reacción en el cátodo será:
- 2H2O + 2e− → 2OH− + H2 (con lo que burbujeará gas hidrógeno);
la reacción en el ánodo es:
- 2H2O → O2 + 4H+ + 4e− (con lo que se liberará gas oxígeno).
Los iones sodio Na+ positivamente cargados reaccionarán hacia el cátodo, neutralizando la carga negativa del OH− ahí presente, y los iones cloruro Cl− reaccionarán hacia el ánodo neutralizando la carga positiva del H+ de ahí. Sin los iones provenientes del electrólito, las cargas alrededor de los electrodos harían más lento el flujo continuo de electrones; la difusión de H+ y OH− a través del agua hacia el otro electrodo llevaría más tiempo que el movimiento de los iones de sodio más prevalentes.
En otros sistemas, las reacciones de los electrodos pueden involucrar a los metales de los electrodos, así como a los iones del electrólito.
Los conductores electrolíticos pueden ser utilizados en dispositivos electrónicos donde la reacción química en la interfase metal/electrólito produce efectos útiles.
Electrólito seco
Los electrólitos secos son: esencialmente, geles en una estructura molecular cristalina flexible.1
No electrolito
Son sustancias que cuando se disuelven en agua se separan en sus moléculas: las moléculas tienen movilidad por estar en disolución acuosa pero son eléctricamente neutras (no tienen carga). Por ejemplo, la sacarosa se separa en moléculas cuando se disuelve en agua. Estos líquidos y disoluciones tienen partículas con movilidad pero sin carga; por lo tanto, no son conductores de electricidad.
Los electrolitos son minerales necesarios para el correcto desarrollo de determinadas funciones de las células. Los electrolitos se ingieren principalmente con los alimentos y los líquidos de la dieta y se eliminan, en su mayor parte, a través de los riñones, pero también con el sistema digestivo y la piel.
Los electrolitos son sustancias que contienen partículas positivas o negativas con carga (iones) de diferentes elementos químicos. Un ejemplo es la sal común (cloruro sódico) con el ión de sodio cargado positivamente (Na+) y el ión de cloro cargado negativamente (Cl-).
Los minerales se dividen en los llamados macroelementos y oligoelementos, dependiendo de si el cuerpo los necesita en grandes cantidades o sólo en cantidades muy pequeñas. Tres electrolitos, calcio, fosfato y magnesio, forman la mayor parte del contenido total de minerales del cuerpo humano. Pero otros electrolitos en pequeñas cantidades también son esenciales para la vida.
Cada electrolito está distribuido de forma diferente en el cuerpo. Algunos electrolitos predominan en las células (intracelulares), mientras que otros circulan principalmente en el flujo sanguíneo(extracelulares) y están fuera de las células.
Si el cuerpo absorbe o elimina demasiados electrolitos existe un desequilibrio electrolítico (en forma de deficiencia o exceso de electrolitos). Esto significa que el equilibrio electrolítico ha sufrido un trastorno. Las causas comunes del exceso o defecto de electrolitos en el cuerpo incluyen daños renales, diarrea o vómitos. Los problemas de distribución entre los electrolitos del interior y el exterior de la célula, también provocan una concentración alterada de electrolitos con consecuencias patológicas.
Los electrolitos tienen muchas funciones. Juegan un papel importante en el mantenimiento del balance hídrico y están involucrados en la actividad eléctrica de las células musculares y nerviosas. Las alteraciones de los electrolitos tienen diversos efectos consiguientes, que van desde hiperhidratación debida a cambios desordenados de la actividad nerviosa hasta arritmias cardiacasy coma. Como los síntomas no suelen indicar claramente anormalidades de los electrolitos, a menudo sólo mediante un análisis de sangre se puede confirmar la enfermedad. En algunos casos, esta enfermedad también se puede detectar con un electrocardiograma (ECG).
Para la mayoría de los electrolitos no son motivo de preocupación las pequeñas desviaciones respecto al valor normal, que se producen con bastante frecuencia. La situación es diferente si ya hay molestias o si los valores de los electrolitos muestran un aumento claro y no sólo varían ligeramente de los valores normales. Si las anormalidades electrolíticas se mantienen, esto puede conducir a una enfermedad y tener consecuencias graves.
Los rangos de valores normales de electrolitos en la sangre son aproximadamente:
| Electrolito | Rango normal |
|---|---|
| Sodio (Na+) | 135 – 145 mmol/l |
| Cloro (Cl-) | 96 – 110 mmol/l |
| Potasio (K+) | 3,8 – 5,2 mmol/l |
| Calcio (Ca2+) | 2,0 –2, 6 mmol/l |
| Fosfato (PO43-) | 0,84 – 1,45 mmol/l |
| Magnesio (Mg2+) | 0,73 – 1,06 mmol/l |
Los diversos electrolitos están distribuidos desigualmente en el cuerpo. Fuera de las células (en el denominado espacio extracelular) se forma sal (cloruro sódico) del sodio (Na+) y el cloro (Cl-), que es el elemento más importante cuantitativamente. Por lo tanto, es uno de los minerales llamados macroelementos (que son necesarios en el cuerpo en grandes cantidades). El sodio es el ión cargado positivamente (catión) más común numéricamente en el plasma sanguíneo. Llega al cuerpo principalmente con los alimentos en forma de sal. Como el sodio está prácticamente en todos los alimentos, está garantizado un suministro suficiente. El cuerpo elimina el sodio en circunstancias normales principalmente en los riñones y en menor medida también en las heces y el sudor.
El contenido de sodio en la sangre influye en la cantidad de líquido de la circulación sanguínea. Si el cuerpo no puede eliminar adecuadamente el sodio (por ejemplo, debido a una enfermedad renal), hay una acumulación de agua en el cuerpo junto con los electrolitos. Normalmente, un sistema de control sofisticado proporciona un nivel constante de sodio.
Los médicos suelen determinar el sodio con análisis de orina o de sangre como valores rutinarios, a fin de evitar una sospecha particular. Un valor alterado de sodio indica un balance hídrico perturbado, especialmente en casos de vómitos, diarrea, quemaduras, enfermedades del corazón o del riñón.
- Posibles causas de niveles elevados de sodio (hipernatremia) son las siguientes:
- Alta ingesta de sal en la dieta
- Sudoración
- Sed
- Diarrea, vómitos
- Insuficiente aporte de líquido
- Diabetes insípida
- Diabetes mellitus severa
- Quemaduras
- Posibles causas de bajos niveles de sodio (hiponatremia) son las siguientes:
- Ingesta baja de sodio
- Diarrea, vómitos
- Quemaduras
- Insuficiencia cardiaca
- Cirrosis hepática
- Insuficiencia renal con alto aporte de agua
- Insuficiencia suprarrenal (enfermedad de Addison)
- Medicamentos (incluyendo ciertos diuréticos, antidiabéticos, antidepresivos, fármacos citotóxicos)
No hay comentarios:
Publicar un comentario