Relación entre trabajo y calor
Tanto el calor como el trabajo son modos en que los cuerpos y los sistemas transforman su energía. Esto permite establecer un equivalente mecánico del calor. Observa los siguientes ejemplos:
- De trabajo mecánico a calor: Frota dos bloques de hielo, y comprobarás que se derriten, aún cuando estés en una camara frigorífica a una temperatura menor de 0 ºC
- De calor a trabajo mecánico: En una máquina de vapor,la expansión del vapor de agua que se calienta produce el desplazamiento del pistón
Trabajo y calor son métodos de transferencia de energía. Utilizan la misma unidad de medida en el Sistema Internacional, el julio ( J ). Además, es habitual utilizar la caloría ( cal ) para medir el calor. La conversión entre calorías y julios viene dada por:
1 cal = 4.184 J ⇔ 1 J = 0.24 cal
Esta relación entre trabajo y calor, que hoy vemos de manera clara, no lo fue hasta el S. XIX. El estudio del trabajo y del calor eran disciplinas separadas: la mecánica y la termología respectivamente. Así también las unidades en que se medían cada uno, julio y caloría. A mediados del S. XIX el científico inglés James Prescott Joule diseñó un dispositivo capaz de medir el equivalente mecánico del calor, estableciendo, así, la equivalencia señalada.
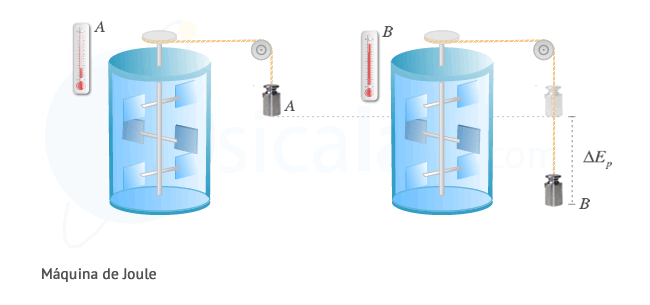
Experimento de Joule
Joule ideó una mágina conformada por una pesa unida a unas aspas por medio de un sistema de poleas, que se encuentran sumergidas en un recipiente de vidrio lleno de agua. Cuando se deja caer la pesa desde la posición A hasta B, tal y como se muestra en la figura, esta pierde su energía potencial invirtiéndose en girar las aspas dentro del líquido. La fricción de las aspas con el agua provoca un aumento de la temperatura del mismo. A partir de los resultados obtenidos con esta máquina se obtuvo la equivalencia establecida anteriormente:
1 cal = 4.184 J ⇔ 1 J = 0.24 cal
¿Qué estudia la termodinámica?
La termodinámica proviene de dos disciplinas separadas hasta el S.XIX, la termología y la mecánica. La primera se encargaba de los fenómenos exclusivamente térmicos y la segunda trataba el movimiento, la fuerza y el trabajo.
La termodinámica es la parte de la física que estudia las transferencias de calor, la conversión de la energía y la capacidad de los sistemas para producir trabajo. Las leyes de la termodinámica explican los comportamientos globales de los sistemas macroscópicos en situaciones de equilibrio.
Tiene las siguientes características:
- Se aplica al estudio de sistemas que contienen muchas partículas y no al estudio de moléculas, átomos o partículas subatómicas
- Estudia el sistema en situaciones de equilibrio, que son aquellas a las que sistema tiende a evolucionar y caracterizadas porque en ellas todas las propiedades del sistema quedan determinadas por factores intrínsecos y no por influencias externas previamente aplicadas
- Sus postulados son indemostrables, están basados en las experiencias y no en razonamientos teóricos
Es importante que te familiarices con los conceptos que vamos a introducir a continuación, pues, aunque en una primera aproximación pueden parecer algo abstractos, te permitirían estudiar el comportamiento de sistemas concretos ( un motor, un inflador de aire, etc ) con bastante precisión.
Componentes de un sistema termodinámico
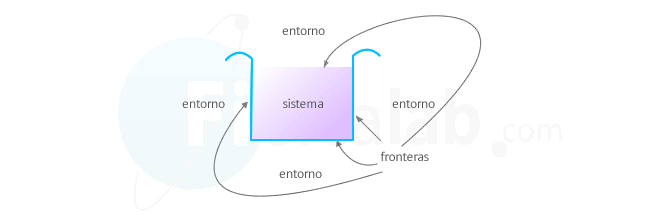
Sistema
El sistema es la parte del universo que vamos a estudiar. Por ejemplo, un gas, nuestro cuerpo o la atmósfera son ejemplos de sistemas que podemos estudiar desde el punto de vista termodinámica.
Entorno o ambiente
Todo aquello que no es sistema y que se sitúa alrededor de él, se denomina ambiente o entorno. Los sistemas interaccionan con el entorno transfiriendo masa, energía o las dos cosas. En función de ello los sistemas se clasifican en:
| Tipo | Intercambia | Ejemplo |
|---|---|---|
| Abierto | Masa y energía (trabajo o calor) | Reacción química en tubo de ensayo abierto |
| Cerrado | Sólo energía | Radiador de calefacción |
| Aislado | Ni materia ni energía | Termo para mantener bebidas a temperatura constante |
| Adiabático | Ni materia ni calor, pero si energía en forma de trabajo | Termo con tapa que permita variar volumen |
Frontera o paredes del sistema
A través de ellas se comunica el sistema con el entorno. Existen los siguientes tipos:
- Fijas: Mantienen el volumen constante
- Móviles: El volumen es variable y depende de la presión en el lado del sistema y de la del entorno
- Conductoras o diatérmanas: Al conducir calor permiten que la temperatura a ambos lados de la misma sea igual
- Adiabáticas: No conducen calor. Son los aislantes térmicos
Variables y ecuación de estado
Las variables de estado son el conjunto de valores que adoptan ciertas variables físicas y químicas y que nos permiten caracterizar el sistema. A las variables de estado también se las llama funciones de estado. No todos los sistemas termodinámicos tienen el mismo conjunto de variables de estado. En el caso de los gases son:
- presión
- volumen
- masa
- temperatura
Las variables de estado de una sustancia se relacionan a través de una ecuación de estado propia de la sustancia de manera que, estableciendo un valor a varias de ellas, quedan determinadas el resto. Por ejemplo, se comprueba experimentalmente que si establecemos el volumen y la temperatura de una determinada cantidad de un gas, su presión no se puede modificar. En este tema nos centraremos a menudo en el estudio de los gases, además de por su relativa simplicidad, por ser de gran interés para el estudio de sistemas termodinámicos como por ejemplo el motor de la máquina de vapor, precursor de los actuales motores.
La ecuación de estado de los gases ideales sigue la expresión:
Donde:
- p : Presión. Su unidad de medida en el Sistema Internacional es el pascal ( Pa ) aunque también se suele usar la atmósfera ( atm ). 1 atm = 101325 Pa
- V : Volumen. Su unidad de medida en el Sistema Internacional es metro cúbico ( m3 ) aunque también se suele usar el litro ( l o L ). 1 L = 1 dm3 = 10-3m3
- n : Número de moles. Se trata de una unidad de masa. Un mol de una sustancia se compone del número de Avogadro, NA = 6.023·1023 de moléculas de esa sustancia, y su peso coincide con la masa molecular de la sustancia expresada en gramos. La unidad de medida en el Sistema Internacional para el número de moles es el mol ( mol )
- R : Constante universal de los gases. Su valor en unidades del Sistema Internacional es R = 8.31 J / mol·K, aunque también se usa R = 0.083 atm·l / mol·K
- T : Temperatura. Su unidad de medida en el Sistema Internacional es el kelvin ( K ) aunque también se suele usar el grado centígrado o celsius ( ºC ). T = tC + 273.15
Recuerda que un gas ideal no es más que un gas teórico en el que sus partículas, con desplazamiento aleatorio, no interactúan entre sí. La mayoría de los gases reales, a temperaturas relativamente altas y presiones pequeñas pueden considerarse gases ideales y por tanto podemos aplicar esta expresión como su ecuación de estado en los ejercicios de este tema.
Finalmente, decimos que un sistema ha alcanzado el estado de equilibrio cuando sus variables de estado permanecen constantes. Todas las propiedades del sistema en equilibrio quedan determinadas por factores intrínsecos y no por influencias externas previamente aplicadas. La termodinámica sólo se ocupa de sistemas en estado de equilibrio.
Variables intensivas y extensivas
- Intensivas: Son aquellas que no dependen del tamaño del sistema. Por ejemplo la presión, la temperatura, la concentración o la densidad
- Extensivas: Son aquellas que dependen del tamaño del sistema. Por ejemplo el volumen, la masa o la energía
Las leyes de la termodinámica
Las leyes de la termodinámica son principios empíricos que no se pueden demostrar por estar basados en la experiencia y no en razonamientos teóricos. Están referidos a sistemas en estado de equilibrio. Son cuatro, aunque los más importantes son el primero y el segundo:
- Principio cero de la termodinámica
- Primer principio de la termodinámica
- Segundo principio de la termodinámica
- Tercer principio de la termodinámica
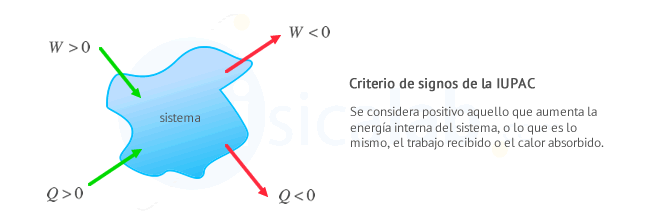
Criterio de signos en termodinámica
Existen dos criterios de signos ampliamente extendidos en termodinámica para relacionar el trabajo y el calor que intercambia un sistema con el entorno:
- Criterio de la IUPAC: Se considera positivo todo lo que aumenta la energía del sistema, es decir, calor recibido y trabajo recibido
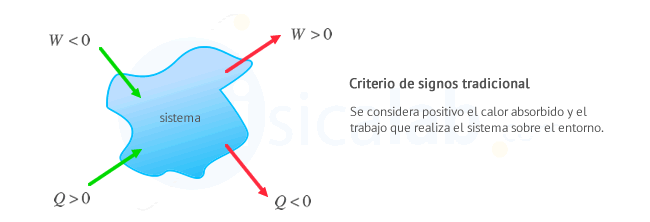
- Criterio Tradicional: Se considera positivo el calor recibido por el sistema y el trabajo que realiza el sistema sobre el entorno. Este criterio es util en el estudio de máquinas térmicas en el que interesa que el trabajo realizado por las máquinas (el sistema) sea positivo
https://www.fisicalab.com/apartado/termodinamica-concepto#contenidos
La termodinámica (del griego termo , que significa " calor " y dinámico , que significa "fuerza") es una rama de la física que estudia los fenómenos relacionados con el calor.
| Motor de combustión interna: transferencia de energía. |
Específicamente, la termodinámica se ocupa de las propiedades macroscópicas (grandes, en oposición a lo microscópico o pequeño) de la materia, especialmente las que son afectadas por el calor y la temperatura, así como de la transformación de unas formas de energía en otras.
Estudia los intercambios de energía térmica entre sistemas y los fenómenos mecánicos y químicos que implican tales intercambios. En particular, estudia los fenómenos en los que existe transformación de energía mecánica en térmica o viceversa.
Cuando la energía (mecánica, térmica, eléctrica, química…) se transforma de una forma a otra, siempre hay una cantidad que se convierte en calor.
Aproximadamente, calor significa "energía en tránsito" y dinámica se refiere al "movimiento", por lo que, en esencia, la termodinámica estudia la circulación de la energía y cómo la energía infunde movimiento.
Históricamente, la termodinámica se desarrolló a partir de la necesidad de aumentar la eficiencia de las primeras máquinas de vapor.
Es importante saber que la termodinámica estudia los sistemas que se encuentran en equilibrio. Esto significa que las propiedades del sistema —típicamente la presión, la temperatura, el volumen y la masa, que se conocen como variables termodinámicas— son constantes.
Además, la termodinámica nos ayuda a comprender por qué los motores no pueden ser nunca totalmente eficientes y por qué es imposible enfriar nada hasta el cero absoluto, una temperatura a la que las sustancias no tienen energía calórica.
Los principios de la termodinámica se pueden aplicar al diseño de motores, al cálculo de la energía liberada en reacciones o a estimar la edad del Universo.
| Intercambio de energía. |
El punto de partida para la mayor parte de las consideraciones termodinámicas son las leyes de la termodinámica, que postulan que la energía puede ser intercambiada entre sistemas físicos en forma de calor o trabajo. También se postula la existencia de una magnitud llamada entropía , que puede ser definida para cualquier sistema.
Las Leyes Termodinámicas pueden expresarse de la siguiente manera:
Ley Cero de la Termodinámica
A esta ley se le llama de "equilibrio térmico". El equilibrio térmico debe entenderse como el estado en el cual los sistemas equilibrados tienen la misma temperatura.
Esta ley dice "Si dos sistemas A y B están a la misma temperatura, y B está a la misma temperatura que un tercer sistema C, entonces A y C están a la misma temperatura". Este concepto fundamental, aun siendo ampliamente aceptado, no fue formulado hasta después de haberse enunciado las otras tres leyes. De ahí que recibe la posición cero.
Un ejemplo de la aplicación de esta ley lo tenemos en los conocidos termómetros.
Primera Ley de la Termodinámica
Esta primera ley, y la más importante de todas, también conocida como principio de conservación de la energía , dice: "La energía no puede ser creada ni destruida, sólo puede transformarse de un tipo de energía en otro".
| Trabajo y energía. |
La primera ley de la termodinámica da una definición precisa del calor, y lo identifica como una forma de energía. Puede convertirse en trabajo mecánico y almacenarse, pero no es una sustancia material.
Experimentalmente se demostró que el calor, que originalmente se medía en unidades llamadas calorías , y el trabajo o energía, medidos en julios , eran completamente equivalentes. Una caloría equivale a 4,186 julios.
Ver: PSU: Física; Pregunta 14_2005(1)
Segunda Ley de la Termodinámica
La segunda ley dice que "solamente se puede realizar un trabajo mediante el paso del calor de un cuerpo con mayor temperatura a uno que tiene menor temperatura". Al respecto, siempre se observa que el calor pasa espontáneamente de los cuerpos calientes a los fríos hasta quedar a la misma temperatura.
La segunda ley de la termodinámica da, además, una definición precisa de una propiedad llamada entropía (fracción de energía de un sistema que no es posible convertir en trabajo).
Para entenderla, la entropía puede considerarse como una medida de lo próximo o no que se halla un sistema al equilibrio; también puede considerarse como una medida del desorden (espacial y térmico) del sistema.
Pues bien, esta segunda ley afirma que "la entropía, o sea, el desorden, de un sistema aislado nunca puede decrecer. Por tanto, cuando un sistema aislado alcanza una configuración de máxima entropía, ya no puede experimentar cambios: ha alcanzado el equilibrio" (Ver: Procesos reversibles e irreversibles en la Naturaleza ).
| El cero absoluto implicaría falta total de movimiento atómico. |
Como la entropía nunca puede disminuir, la naturaleza parece pues "preferir"’ el desorden y el caos. Puede demostrarse que el segundo principio implica que, si no se realiza trabajo, es imposible transferir calor desde una región de temperatura más baja a una región de temperatura más alta.
Tercera Ley de la Termodinámica
El tercer principio de la termodinámica afirma que "el cero absoluto no puede alcanzarse por ningún procedimiento que conste de un número finito de pasos. Es posible acercarse indefinidamente al cero absoluto, pero nunca se puede llegar a él".
Es importante recordar que los principios o leyes de la Termodinámica son sólo generalizaciones estadísticas, válidas siempre para los sistemas macroscópicos, pero inaplicables a nivel cuántico.
Asimismo, cabe destacar que el primer principio, el de conservación de la energía, es una de las más sólidas y universales de las leyes de la naturaleza descubiertas hasta ahora por la ciencia.
http://www.profesorenlinea.cl/fisica/termodinamNociones.htm
No hay comentarios:
Publicar un comentario