Ecuaciones de la termodinámica
El calor específico de los sólidos (igual que el de los gases y líquidos) es función creciente de la temperatura, tendiendo a cero cuando ésta se aproxima a los 0 K. El crecimiento de este calor a partir de 0 K es inicialmente muy rápido, haciéndose después más lento hasta que se alcanza una temperatura que puede corresponder a la de fusión, a la de descomposición o a un cambio de estructura.1
En 1819, los físicos y químicos franceses Pierre Louis Dulong (1785-1835) y Alexis Thérèse Petit (1791-1820) establecieron la ley que lleva sus nombres.
Figura 1.- Dependencia del calor específico atómico de algunos materiales y elementos sólidos con la temperatura.

Figura 2.- Curva representativa del calor atómico de los sólidos cristalinos en el modelo de Debye correspondientes a alguno de ellos.
Explicación
Entendemos por calor atómico el calor intercambiado por un átomo-gramo de sustancia cuando su temperatura varía un 1 K y es igual al producto de la masa atómica del elemento por su calor específico. Como el número de átomos contenido en un átomo-gramo de sustancia es el mismo (número de Avogadro) para todos los elementos, se infiere que se requiere aproximadamente la misma cantidad de calor por átomo para producir el mismo aumento de temperatura en todos los sólidos. En otras palabras, el calor necesario para elevar la temperatura de una cierta masa de sólido depende solamente del número de átomos contenidos en ella, siendo independiente de la masa de cada uno de ellos.
El resultado es extremadamente simple; sin importar el tipo de sólido cristalino, el calor específico (medido en joule por kelvin y por kilogramo) es 3R/M, donde R es la constante universal de los gases ideales (medida en joule por kelvin y por mol) y M es la masa molar (medida en kilogramo por mol). Lo que es equivalente a decir que la capacidad calorífica adimensional es igual a 3.
La ley de Dulong y Petit se cumple tanto mejor cuanto más elevada es la temperatura, acentuándose la discrepancia con los resultados experimentales a medida que disminuye la temperatura; estas discrepancias sólo pueden explicarse en el marco de la Física Cuántica. Así pues, la ley de Dulong y Petit constituye realmente una ley límite, en el sentido de que el valor de 25 J/(mol·K) es el valor a que tienden los calores atómicos de los sólidos a medida que aumenta la temperatura; no obstante, a la temperatura ordinaria ya se alcanza un valor próximo a las 6 cal/(mol·K) para la mayoría de los elementos. Por el contrario, hay elementos (v.g., el carbono) que requieren temperaturas muy altas para acercarse a ese valor (para el carbono, el calor atómico vale 5.3 cal/(mol·K) a la temperatura de 1170 °C).
Podemos conseguir que los calores atómicos de los diferentes sólidos vengan expresados por una misma función c=c(T) sin más que reajustar la escala de temperaturas. Para ello, expresaremos el calor atómico en función del cociente T/TD, donde TD es una temperatura característica de cada sustancia sólida, denominada temperatura de Debye. Esta temperatura está relacionada con la frecuencia de vibración característica de los átomos del sólido en su red cristalina. El excelente acuerdo conseguido en muchos casos entre la teoría de Debye y los resultados experimentales constituyó, en su día, un éxito de la Mecánica Cuántica.
Aplicaciones
Cualquier alteración en la distribución espacial de los iones, átomos o moléculas en un cristal, i.e., cualquier alteración en la estructura cristalina de un sólido, provoca variaciones en su calor específico y, por consiguiente, en su calor atómico. Por este motivo, el estudio de las discontinuidades o anomalías en los calores específicos constituye un método de exploración que permite detectar a menudo cambios de estructura o transiciones electrónicas, atómicas o moleculares. Así, al estudiar la variación del calor específico del azufre en función de la temperatura, se observa que su calor específico pasa de 0.745 a 0.779 J/(g·K) a la presión atmosférica normal y 95.6 °C, lo que corresponde a una transformación entre las formas alotrópicas α y β del azufre. Del mismo modo, una discontinuidad en el calor específico del tántalo a muy baja temperatura permite detectar un tránsito entre un estado superconductor a otro normal para T = 4.39 K.
Casos límite
A pesar de su simplicidad, la ley de Dulong-Petit ofrece una buena predicción de la capacidad calorífica de los sólidos con estructuras cristalinas relativamente simples a altas temperaturas. Sin embargo, no es adecuada y falla en las regiones de bajas temperaturas, donde la naturaleza cuántica del sólido se manifiesta notoriamente. En cambio, en esta última región el modelo de Debye, iniciado por una teoría más precisa que incorpora efectos cuánticos, fue desarrollado por Albert Einstein en 1907 y refinado por Peter Debye en 1911,2 representa en forma correcta los datos experimentales, de acuerdo con los datos de este último modelo la capacidad calorífica molar varía de acuerdo con la expresión:
siendo una constante propia de cada substancia (temperatura de Debye).
Resulta fácil comprobar que el límite de altas temperaturas que predice la ley anterior es precisamente el límite de Dulong-Petit:
Sin embargo, en el límite de bajas temperaturas, cuando los efectos cuánticos son importanes la capacidad calorífica se aleja mucho de límite de Dulong-Petit:
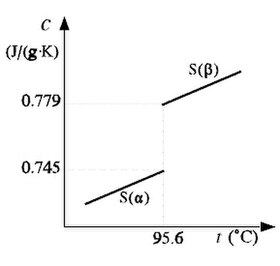 Figura 3.- Discontinuidad en el calor específico de las formas alotrópicas del azufre.
Figura 3.- Discontinuidad en el calor específico de las formas alotrópicas del azufre. Figura 4.- Discontinuidad en el calor específico del tántalo.
Figura 4.- Discontinuidad en el calor específico del tántalo.Masas atómicas aproximadas. ley de Dulong y Petit.
El método de Cannizzaro no puede utilizarse para la determinación del peso atómico de los elementos metálicos puesto que, en general, estos elementos no forman compuestos volátiles. Afortunadamente pudo encontrarse una relación entre el peso atómico y su calor especifico al observar DULONG y PETIT que el producto del calor específico de cualquier elemento sólido por su peso atómico es prácticamente constante e igual a 6,3.
Puesto que el calor específico es la cantidad de calor necesaria para elevar en un grado centígrado la temperatura de un gramo del cuerpo, este producto corresponde a la capacidad calorífica de un mol.
La ley de Dulong y Petit puede enunciarse en la forma siguiente:
Los calores atómicos de los elementos en estado sólido son prácticamente iguales a 6,3.
(Dimensionalmente, este valor viene expresado en cal/ºC. mol.) Por consiguiente,
Calor específico x Peso atómico = 6,3 o sea, Peso atómico = 6,3 / Calor específico
La ley de Dulong y Petit no es muy exacta y además no puede aplicarse a elementos de peso atómico bajo tal como el berilio, boro, carbono y silicio para los cuales el calor atómico es excepcionalmente muy bajo.
EJEMPLO. El calor específico del hierro es igual a 0,113 cal/gramo . grado. Hallar el peso atómico aproximado del hierro.
Aplicando la expresión derivada de la ley de Dulong y Petit se tiene
ley de Hess, propuesta por Germain Henri Hess en 1840, establece que: «si una serie de reactivos reaccionan para dar una serie de productos, el calor de reacción liberado o absorbido es independiente de si la reacción se lleva a cabo en una, dos o más etapas», esto es, que los cambios de entalpía son aditivos: ΔHneta = ΣΔHr.
Equivalentemente, se puede decir que el calor de reacción sólo depende de los reactivos y los productos, o que el calor de reacción es una función de estado; en este sentido la ley de Hess es la aplicación a las reacciones químicas del primer principio de la termodinámica; debido a que fue enunciada unos diez años antes que ésta, conserva su nombre histórico.1 El propósito de este planteamiento es analizar de forma muy breve las bases de la Termoquímica como una solución a problemas de transferencia de calor en dichos procesos.
Cuando se busca saber qué tanto calor como una forma de la energía absorbida o desprendida está presente en una reacción, es porque la misma juega un papel muy importante de los cambios químicos, la pregunta obvia en este caso resulta; ¿A qué se debe esa importancia? Se debe a que en todo cambio químico hay ruptura y formación de nuevos enlaces químicos y para que haya esa ruptura, se requiere energía y algunas veces en la formación de los nuevos enlaces se requiere de menor energía para su formación y por tanto se desprende la energía sobrante, razón por la cual, el estudio del calor y de su relación con los cambios químicos resulta tan importante. Además de lo anterior es necesario también conocer si el proceso depende no solo de si el cambio se efectúa a volumen o presión constante, sino también de las cantidades de sustancia considerada, su estado físico, temperatura y presión.
En virtud de que la cantidad de calor obtenida en una reacción depende de la cantidad de sustancia que intervino en ella, si escribimos que dos gramos de hidrógeno se queman en oxígeno para producir agua líquida, y se desprenden 68,320 calorías, entonces cuando incrementamos a cuatro gramos, el calor desprendido es doble y así sucesivamente. Esto es, que en vez de especificar la cantidad producido por gramo de sustancia para una reacción particular, es usual hacerlo de la siguiente manera:
- H2 + 1/2 O2 D H2O ∆H = - 68,320 cal
Por ejemplo, el carbono en forma de grafito puede oxidarse hasta dióxido (1) o monóxido (2) de carbono, por otro lado, el monóxido de carbono puede oxidarse hasta dióxido (3). Como se ve a continuación, la suma de las entalpías de la reacción en dos pasos (2)+(3) es igual a la entalpía de la reacción en un paso (1):

La ley de Hess se utiliza para deducir el cambio de entalpía en una reacción ΔHr, si se puede escribir esta reacción como un paso intermedio de una reacción más compleja, siempre que se conozcan los cambios de entalpía de la reacción global y de otros pasos.2 En este procedimiento, la suma de ecuaciones químicas parciales lleva a la ecuación de la reacción global. Si la energía se incluye para cada ecuación y es sumada, el resultado será la energía para la ecuación global. Este procedimiento se apoya en que ya han sido tabuladas los calores de reacción para un gran número de reacciones, incluyendo la formación a partir de sus elementos constituyentes de buena parte de las sustancias químicas conocidas.1 Un caso relevante de este tipo de aplicación es el llamado ciclo de Born-Haber.






No hay comentarios:
Publicar un comentario