Las proteínas de fase aguda (APP) son una clase de proteínas cuyas concentraciones plasmáticas aumentan (proteínas de fase aguda positivas) o disminuyen (proteínas de fase aguda negativas) en respuesta a la inflamación . Esta respuesta se llama reacción de fase aguda (también llamada respuesta de fase aguda ). Para la reacción de fase aguda es característico la fiebre , la aceleración de los leucocitos periféricos , los neutrófilos en circulación y sus precursores. [1] Los términos proteína de fase aguda y de fase aguda reactante(APR) a menudo se usan como sinónimos, aunque algunos APR son polipéptidos (en sentido estricto) en lugar de proteínas.
En respuesta a la lesión , las células inflamatorias locales ( granulocitos neutrófilos y macrófagos ) secretan una serie de citoquinas en el torrente sanguíneo, la más notable de las cuales son las interleucinas IL1 , IL6 y TNFα . El hígado responde produciendo una gran cantidad de reactantes de fase aguda. Al mismo tiempo, se reduce la producción de otras proteínas ; estas proteínas se denominan, por lo tanto, reactantes de fase aguda "negativos". Aumento de las proteínas de fase aguda del hígado. También puede contribuir a la promoción de la sepsis .
Regulación de la síntesis [ editar ]
TNF-α , IL-1β e INF-γ son importantes para la expresión de mediadores inflamatorios como prostagladinas y leucotrienos y también causan la producción de factor activador de plaquetas e IL-6 . Después de la estimulación de las citocinas proinflamatorias , las células de Kupffer producen IL-6 en el hígado y la presentan a los hepatocitos . IL-6 es el principal mediador para la secreción hepatocítica de las APP. La síntesis de APP también puede ser regulada indirectamente por cortisol . El cortisol puede aumentar la expresión de IL-6 receptoresen las células del hígado e inducir la producción mediada por IL-6 de APPs. [1]
Positivo [ editar ]
Las proteínas positivas de fase aguda sirven (como parte del sistema inmune innato) diferentes funciones fisiológicas dentro del sistema inmune . Algunos actúan para destruir o inhibir el crecimiento de microbios , por ejemplo, proteína C reactiva , proteína de unión a manosa , [3] factores del complemento , ferritina , ceruloplasmina , amiloide sérico A y haptoglobina . Otros dan retroalimentación negativa sobre la respuesta inflamatoria, por ejemplo, serpinas . La alfa 2-macroglobulina y los factores de coagulación afectan la coagulación, principalmente estimulándolo. Este efecto pro coagulante puede limitar la infección al atrapar patógenos en coágulos de sangre locales . [1] Además, algunos productos del sistema de coagulación pueden contribuir al sistema inmunitario innato por su capacidad para aumentar la permeabilidad vascular y actuar como agentes quimiotácticos para las células fagocíticas .
| Proteína | Función del sistema inmune |
|---|---|
| Proteína C-reactiva | Opsonin sobre microbios [4] (no es un reactivo de fase aguda en ratones) |
| Suero amiloide P componente | Opsonin |
| Suero amiloide A |
|
| Factores complementarios | Opsonización , lisis y agrupación de células diana. Quimiotaxis |
| Lectina de unión al manano | Manina de lectina de unión a manano de la activación del complemento |
| Fibrinógeno , protrombina ,factor VIII , factor de von Willebrand | Factores de coagulación , atrapando microbios invasores en coágulos de sangre. Algunas causan quimiotaxis. |
| Inhibidor del activador de plasminógeno-1 (PAI-1) | Previene la degradación de los coágulos de sangre al inhibir el tejido Activador de plasminógeno (tPA) [5] |
| Alfa 2-macroglobulina |
|
| Ferritina | Unión de hierro , inhibición de la absorción de hierro microbio [7] |
| Hepcidina [8] | Estimula la internalización de la ferroportina , evitando la liberación de hierrounida a la ferritina en los enterocitos y macrófagos intestinales. |
| Ceruloplasmina | Oxida el hierro, facilitando la ferritina , inhibiendo la absorción de hierro por los microbios. |
| Haptoglobina | Se une a la hemoglobina , inhibe la absorción de hierro de los microbios y previene el daño renal |
| Orosomucoide (glicoproteína de ácido alfa-1, AGP) | Portador de esteroides |
| Alfa 1-antitripsina | Serpin , regula hacia abajo la inflamación |
| Alfa 1-anticimotripsina | Serpin, regula hacia abajo la inflamación |
Negativo [ editar ]
Las proteínas de fase aguda "negativas" disminuyen en la inflamación. Los ejemplos incluyen albúmina , [9]transferrina , [9] transtiretina , [9] proteína de unión a retinol , antitrombina , transcortina . La disminución de tales proteínas puede usarse como marcadores de inflamación. El papel fisiológico de la síntesis disminuida de tales proteínas es generalmente para ahorrar aminoácidos para producir proteínas de fase aguda "positivas" de manera más eficiente. Teóricamente, una disminución en la transferrina también podría disminuir por una regulación al alza de los receptores de la transferrina , pero este último no parece cambiar con la inflamación. [10]
Importancia clínica [ editar ]
La medición de las proteínas de fase aguda, especialmente la proteína C reactiva, es un marcador útil de la inflamación en la patología clínica médica y veterinaria . Se correlaciona con la tasa de sedimentación eritrocítica(ESR), pero no siempre de forma directa. Esto se debe a que la ESR depende en gran medida de la elevación del fibrinógeno , un reactante de fase aguda con una vida media de aproximadamente una semana. Por lo tanto, esta proteína permanecerá más alta durante más tiempo a pesar de la eliminación de los estímulos inflamatorios. En contraste, la proteína C reactiva (con una vida media de 6 a 8 horas) aumenta rápidamente y puede volver rápidamente al rango normal si se emplea el tratamiento. Por ejemplo, en el lupus eritematoso sistémico activo., uno puede encontrar una ESR elevada pero una proteína C reactiva normal.
También pueden indicar insuficiencia hepática.
El sistema inmunitario adaptativo , también conocido como sistema inmunitario adquirido o, más raramente, como sistema inmunitario específico , es un subsistema del sistema inmunitario general que está compuesto por células sistémicas altamente especializadas y procesos que eliminan los patógenos o impiden su crecimiento. El sistema inmunitario adquirido es una de las dos estrategias principales de inmunidad que seencuentran en los vertebrados (el otro es el sistema inmunitario innato ).
La inmunidad adquirida crea una memoria inmunológica después de una respuesta inicial a un patógeno específico, y conduce a una respuesta mejorada a los encuentros posteriores con ese patógeno. Este proceso de inmunidad adquirida es la base de la vacunación . Al igual que el sistema innato, el sistema adquirido incluye componentes de inmunidad humoral y componentes de inmunidad mediada por células .
El término "adaptativo" fue usado por primera vez por Robert Good en referencia a las respuestas de anticuerpos en ranas como sinónimo de "respuesta inmune adquirida" en 1964. Good reconoció que usaba los términos como sinónimos, pero solo explicó que "prefería" usar el término "adaptado". Podría haber estado pensando en la entonces improbable teoría de la formación de anticuerpos en la que los anticuerpos eran plásticos y podían adaptarse a la forma molecular de los antígenos, y / o al concepto de "enzimas adaptativas" como lo describe Monod en bacterias, es decir , enzimas cuya expresión podría ser inducida por sus sustratos. La frase fue utilizada casi exclusivamente por Good y sus estudiantes y algunos otros inmunólogos que trabajaban con organismos marginales hasta la década de los 90, cuando se generalizó su uso junto con el término "Drosophila , un organismo previamente marginal para el estudio de la inmunología. El término "adaptativo" tal como se usa en inmunología es problemático, ya que las respuestas inmunitarias adquiridas pueden ser tanto adaptativas como inadaptadas en el sentido fisiológico. De hecho, tanto las respuestas inmunitarias adquiridas como las innatas pueden ser tanto adaptativas como maladaptativas en el sentido evolutivo. La mayoría de los libros de texto de hoy, después del uso inicial de Janeway, usan "adaptativo" casi exclusivamente y señalan en los glosarios que el término es sinónimo de "adquirido".
El sentido clásico de "inmunidad adquirida" llegó a significar, desde el descubrimiento de Tonegawas, "inmunidad específica de antígeno mediada por reordenamientos de genes somáticos que crean receptores de antígenos que definen el clon". En la última década, el término "adaptativo" se ha aplicado cada vez más a otra clase de respuesta inmune que hasta ahora no se ha asociado con reordenamientos de genes somáticos. Estos incluyen la expansión de las células asesinas naturales (NK) con una especificidad hasta ahora inexplicable para los antígenos, la expansión de las células NK que expresan receptores codificados en la línea germinal y la activación de otras células inmunes innatas a un estado activado que confiere una "memoria inmune a corto plazo" ". En este sentido, "inmunidad adaptativa" se asemeja más al concepto de "estado activado" o "heterostasis",
A diferencia del sistema inmunitario innato, el sistema inmunitario adquirido es altamente específico para un patógeno en particular. La inmunidad adquirida también puede proporcionar una protección duradera; por ejemplo, alguien que se recupera del sarampión ahora está protegido contra el sarampión durante toda su vida. En otros casos no proporciona protección de por vida; por ejemplo, la varicela . La respuesta del sistema adquirido destruye los patógenos invasores y las moléculas tóxicas que producen. A veces, el sistema adquirido es incapaz de distinguir moléculas extrañas dañinas de inofensivas; Los efectos de esto pueden ser fiebre del heno , asma o cualquier otra alergia . Antigenosson sustancias que provocan la respuesta inmune adquirida (ya sea adaptativa o inadaptada al organismo). Las células que llevan a cabo la respuesta inmune adquirida son glóbulos blancos conocidos como linfocitos. Dos linfocitos diferentes (células B y células T) transmiten dos clases principales: respuestas de anticuerpos y respuesta inmunitaria mediada por células. En las respuestas de anticuerpos, las células B se activan para secretar anticuerpos , que también son proteínas conocidas como inmunoglobulinas. Los anticuerpos viajan a través del torrente sanguíneo y se unen al antígeno extraño, lo que hace que se inactive, lo que no permite que el antígeno se una al huésped. [1]
En la inmunidad adquirida, los receptores específicos de patógenos se "adquieren" durante la vida útil del organismo (mientras que en la inmunidad innata, los receptores específicos de patógenos ya están codificados en la línea germinal ). La respuesta adquirida se denomina "adaptativa" porque prepara el sistema inmunológico del cuerpo para futuros desafíos (aunque en realidad también puede ser inadaptado cuando se traduce en autoinmunidad ). [n 1]
El sistema es altamente adaptable debido a la hipermutación somática (un proceso de mutaciones somáticasaceleradas ) y la recombinación V (D) J (una recombinación genética irreversible de segmentos de genes de receptores de antígenos). Este mecanismo permite que un pequeño número de genes genere un gran número de receptores de antígeno diferentes, que luego se expresan de forma única en cada linfocito individual . Dado que el reordenamiento genético conduce a un cambio irreversible en el ADN de cada célula, toda la progenie(descendencia) de esa célula hereda genes que codifican la misma especificidad del receptor, incluidas las células B de memoria yCélulas T de memoria que son las claves de una inmunidad específica de larga duración.
La teoría de la red inmune proporciona un marco teórico que explica el funcionamiento del sistema inmunitario adquirido . Esta teoría, que se basa en conceptos establecidos de selección clonal , se está aplicando en la búsqueda de una vacuna contra el VIH .
Funciones [ editar ]
La inmunidad adquirida se activa en vertebrados cuando un patógeno elude el sistema inmunitario innato y (1) genera un nivel umbral de antígeno y (2) genera señales "extrañas" o "peligrosas" que activan las células dendríticas. [2]
Las funciones principales del sistema inmune adquirido incluyen:
- Reconocimiento de antígenos "no propios" específicos en presencia de "self", durante el proceso de presentación de antígenos .
- Generación de respuestas que se adaptan para eliminar al máximo patógenos específicos o células infectadas por patógenos.
- Desarrollo de la memoria inmunológica , en la que los patógenos se "recuerdan" a través de las células B de la memoria y las células T de la memoria .
Linfocitos [ editar ]
Las células del sistema inmunitario adquirido son linfocitos T y B ; Los linfocitos son un subconjunto de leucocitos. Las células B y las células T son los principales tipos de linfocitos. El cuerpo humano tiene aproximadamente 2 billones de linfocitos, que constituyen el 20–40% de los glóbulos blancos (GB); su masa total es aproximadamente la misma que la del cerebro o el hígado. La sangre periférica contiene 2% de linfocitos circulantes; El resto se mueve dentro de los tejidos y el sistema linfático . [1]
Las células B y las células T se derivan de las mismas células madre hematopoyéticas multipotentes , y son morfológicamente indistinguibles entre sí hasta después de que se activan. Las células B desempeñan un papel importante en la respuesta inmune humoral , mientras que las células T están íntimamente involucradas en las respuestas inmunes mediadas por células . En todos los vertebrados, excepto Agnatha , las células madre producen células B y células T en la médula ósea. [3]
Los progenitores de T migran de la médula ósea al timo, donde se llaman timocitos y se desarrollan en células T. En los seres humanos, aproximadamente 1 a 2% del conjunto de linfocitos recircula cada hora para optimizar las oportunidades para que los linfocitos específicos de antígeno encuentren su antígeno específico dentro de los tejidos linfoides secundarios. [4] En un animal adulto, los órganos linfoides periféricos contienen una mezcla de células B y T en al menos tres etapas de diferenciación:
- Las células T ingenuas B y las células T ingenuas (células que no han madurado), que abandonan la médula ósea o el timo, han ingresado al sistema linfático, pero aún no han encontrado su antígeno afín,
- Las células efectoras que han sido activadas por su antígeno afín, y están activamente involucradas en la eliminación de un patógeno.
- células de memoria - los sobrevivientes de infecciones pasadas.
La presentación del antígeno [ editar ]
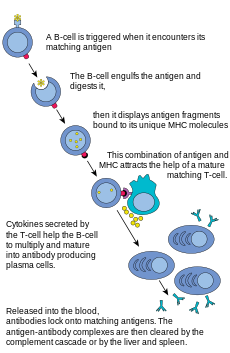
La inmunidad adquirida se basa en la capacidad de las células inmunitarias para distinguir entre las propias células del cuerpo y los invasores no deseados. Las células del huésped expresan antígenos " propios " . Estos antígenos son diferentes de los que se encuentran en la superficie de las bacterias o en la superficie de las células huésped infectadas por el virus (antígenos "no propios" o "extraños"). La respuesta inmune adquirida se desencadena al reconocer un antígeno extraño en el contexto celular de una célula dendrítica activada.
Con la excepción de las células no nucleadas (incluidos los eritrocitos ), todas las células son capaces de presentar antígenos a través de la función de las moléculas del complejo principal de histocompatibilidad (MHC). [3] Algunas células están especialmente equipadas para presentar antígeno y para cebar células T vírgenes. Las células dendríticas , las células B y los macrófagos están equipados con ligandos "coestimulantes" especiales reconocidos por los receptores coestimulantes en las células T, y se denominan células presentadoras de antígenos profesionales (APC).
Varios subgrupos de células T pueden ser activados por APC profesionales, y cada tipo de célula T está especialmente equipado para tratar cada toxina única o patógeno microbiano. El tipo de célula T activada y el tipo de respuesta generada dependen, en parte, del contexto en el que la APC encontró por primera vez el antígeno. [2]
Antigenos exógenos [ editar ]
Las células dendríticas engullen patógenos exógenos , como bacterias, parásitos o toxinas en los tejidos y luego migran, a través de señales quimiotácticas , a los ganglios linfáticos enriquecidos con células T. Durante la migración, las células dendríticas experimentan un proceso de maduración en el que pierden la mayor parte de su capacidad de engullir otros patógenos y desarrollan la capacidad de comunicarse con las células T. La célula dendrítica usa enzimas para cortar el patógeno en pedazos más pequeños, llamados antígenos . En el ganglio linfático, la célula dendrítica muestra estos antígenos no propios en su superficie al acoplarlos a un receptor llamado complejo principal de histocompatibilidad , o MHC (también conocido en humanos como antígeno leucocitario humano).(HLA)). Este complejo MHC: antígeno es reconocido por las células T que pasan a través del ganglio linfático. Antígenos exógenos generalmente se muestran en MHC de clase II moléculas, que activan CD4 + células T cooperadoras . [2]
Antígenos endógenos [ editar ]
Los antígenos endógenos son producidos por bacterias intracelulares y virus que se replican dentro de una célula huésped. La célula huésped utiliza enzimas para digerir proteínas asociadas a virus, y muestra estas piezas en su superficie a las células T mediante su acoplamiento a MHC. Los antígenos endógenos se muestran típicamente en las moléculas MHC de clase I y activan las células T citotóxicas CD8 +. Con la excepción de las células no nucleadas (incluidos los eritrocitos ), el MHC de clase I se expresa en todas las células huésped. [2]
Linfocitos T [ editar ]
Los linfocitos T CD8 + y la citotoxicidad [ editar ]
Las células T citotóxicas (también conocidas como TC, células T asesinas o linfocitos T citotóxicos (CTL)) son un subgrupo de células T que inducen la muerte de células infectadas con virus (y otros patógenos), o son de otra manera Dañado o disfuncional. [2]
Las células T citotóxicas naive se activan cuando su receptor de células T (TCR) interactúa fuertemente con una molécula de clase I del MHC unida a péptido. Esta afinidad depende del tipo y la orientación del complejo antígeno / MHC, y es lo que mantiene a la CTL y la célula infectada unidas. [2] Una vez activado, el CTL experimenta un proceso llamado selección clonal , en el cual gana funciones y se divide rápidamente para producir un ejército de células efectoras "armadas". La CTL activada luego viaja por todo el cuerpo en busca de células que contengan ese péptido MHC Class I + único. [ cita requerida ]
Cuando se exponen a estas células somáticas infectadas o disfuncionales , las CTL efectoras liberan perforina y granulisina : citotoxinas que forman poros en la membrana plasmática de la célula objetivo , permitiendo que los iones y el agua fluyan hacia la célula infectada y causen que estalle o se lije . La CTL libera granzima , una serina proteasa que ingresa a las células a través de los poros para inducir la apoptosis (muerte celular). Para limitar el daño tisular extenso durante una infección, la activación de CTL está estrechamente controlada y, en general, requiere una señal de activación de MHC / antígeno muy fuerte, o señales de activación adicionales proporcionadas por las células T "auxiliares" (ver más abajo).[2]
En la resolución de la infección, la mayoría de las células efectoras mueren y los fagocitos los eliminan, pero algunas de estas células permanecen como células de memoria. [3] En un encuentro posterior con el mismo antígeno, estas células de memoria se diferencian rápidamente en células efectoras, acortando dramáticamente el tiempo requerido para montar una respuesta efectiva. [ cita requerida ]
Células T Ayudantes [ editar ]
Los linfocitos CD4 +, también llamados células T "auxiliares" o "reguladoras", son mediadores de la respuesta inmunitaria y desempeñan un papel importante en el establecimiento y la maximización de las capacidades de la respuesta inmunitaria adquirida. [2] Estas células no tienen actividad citotóxica o fagocítica; y no puede matar células infectadas o eliminar patógenos, pero, en esencia, "administrar" la respuesta inmune, dirigiendo a otras células a realizar estas tareas.
Las células T auxiliares expresan receptores de células T (TCR) que reconocen el antígeno unido a moléculas MHC de clase II. La activación de una célula T ayudante ingenua hace que libere citoquinas, que influyen en la actividad de muchos tipos de células, incluida la APC (célula presentadora de antígeno) que la activó. Las células T auxiliares requieren un estímulo de activación mucho más suave que las células T citotóxicas. Las células T colaboradoras pueden proporcionar señales adicionales que "ayudan" a activar las células citotóxicas. [3]
Th1 y Th2: respuestas de las células T auxiliares [ editar ]
Clásicamente, un APC profesional, designado como Th1 y Th2, puede inducir dos tipos de respuestas de células auxiliares CD4 + efectoras, cada una diseñada para eliminar diferentes tipos de patógenos. Los factores que determinan si una infección desencadena una respuesta de tipo Th1 o Th2 no se entienden completamente, pero la respuesta generada juega un papel importante en la eliminación de diferentes patógenos. [2]
La respuesta Th1 se caracteriza por la producción de interferón-gamma , que activa las actividades bactericidasde los macrófagos e induce a las células B a producir anticuerpos opsonizantes (de recubrimiento) y de fijación del complemento, y conduce a la inmunidad mediada por células . [2] En general, las respuestas Th1 son más efectivas contra los patógenos intracelulares (virus y bacterias que se encuentran dentro de las células huésped).
La respuesta Th2 se caracteriza por la liberación de interleucina 5 , que induce a los eosinófilos en la eliminación de parásitos. [6] Th2 también producen interleucina 4 , lo que facilita células B cambio de isotipo . [2] En general, las respuestas de Th2 son más efectivas contra bacterias extracelulares , parásitos, incluidos los helmintos y toxinas . [2] Al igual que las células T citotóxicas, la mayoría de las células auxiliares CD4 + mueren por resolución de la infección, y algunas quedan como células de memoria CD4 +.
Cada vez más, hay pruebas sólidas de estudios científicos basados en ratón y humanos de una diversidad más amplia en los subconjuntos de células auxiliares T del efector CD4 +. Las células T reguladoras (Treg) , se han identificado como importantes reguladores negativos de la inmunidad adaptativa, ya que limitan y suprimen el sistema inmunitario para controlar las respuestas inmunes aberrantes a los antígenos propios; Un importante mecanismo para controlar el desarrollo de enfermedades autoinmunes. [3] Las células T auxiliares foliculares (Tfh) son otra población distinta de células T CD4 + efectoras que se desarrollan a partir de células T vírgenes después de la activación del antígeno. Las células Tfh están especializadas en ayudar a la inmunidad humoral de las células B, ya que tienen una capacidad única para migrar a las células B foliculares.en los órganos linfoides secundarios y proporcionarles señales paracrinas positivas para permitir la generación y recuperación de la producción de anticuerpos madurados por afinidad de alta calidad . Al igual que las Treg, las células Tfh también desempeñan un papel en la tolerancia inmunológica, ya que una expansión anormal de los números de células Tfh puede conducir a una producción de anticuerpos autorreactivos sin restricciones que causan trastornos autoinmunes sistémicos graves. [7]
La relevancia de las células auxiliares CD4 + T se destaca durante una infección por VIH . El VIH es capaz de subvertir el sistema inmunológico atacando específicamente las células T CD4 +, precisamente las células que podrían conducir a la eliminación del virus, pero también las células que impulsan la inmunidad contra todos los otros patógenos encontrados durante la vida de un organismo. [3]
Celulas gamma delta T [ editar ]
Las células T gamma delta (células T γδ) poseen un receptor de células T alternativo (TCR) en oposición a las células T αβ CD4 + y CD8 + y comparten las características de las células T auxiliares, las células T citotóxicas y las células asesinas naturales. Al igual que otros subconjuntos de células T 'no convencionales' que tienen TCR invariantes, como las células T asesinas naturales restringidas a CD1d , las células T γδ presentan características que las ubican en el límite entre la inmunidad innata y adquirida. Por un lado, las células T γδ pueden considerarse un componente de la inmunidad adaptativa, ya que reorganizan los genes TCR a través de la recombinación V (D) J , que también produce diversidad de unión., y desarrollar un fenotipo de memoria. Por otro lado, sin embargo, los diversos subconjuntos también pueden considerarse parte del sistema inmune innato en el que se puede usar un receptor restringido de TCR o NK como receptor de reconocimiento de patrones . Por ejemplo, según este paradigma, un gran número de células T Vγ9 / V /2 responden en cuestión de horas a moléculas comunes producidas por microbios, y las células T Vδ1 intraepiteliales altamente restringidas responden a células epiteliales estresadas.
B linfocitos y la producción de anticuerpos [ editar ]
Las células B son las principales células involucradas en la creación de anticuerpos que circulan en el plasma sanguíneo y la linfa, conocida como inmunidad humoral . Los anticuerpos (también conocidos como inmunoglobulina, Ig), son proteínas grandes en forma de Y utilizadas por el sistema inmunológico para identificar y neutralizar objetos extraños. En los mamíferos, existen cinco tipos de anticuerpos: IgA , IgD , IgE , IgG e IgM , que difieren en sus propiedades biológicas; Cada uno ha evolucionado para manejar diferentes tipos de antígenos. Tras la activación, las células B producen anticuerpos, cada uno de los cuales reconoce un antígeno único y neutraliza patógenos específicos. [2]
La unión de antígenos y anticuerpos causaría cinco mecanismos de protección diferentes:
- Aglutinación: reduce el número de unidades infecciosas a tratar
- Activación del complemento: causa inflamación y lisis celular.
- Opsonización: el antígeno de recubrimiento con anticuerpo mejora la fagocitosis
- Citootoxicidad mediada por células dependientes de anticuerpos: los anticuerpos unidos a las células diana causan la destrucción por macrófagos, eosinófilos y células NK
- Neutralización: bloquea la adhesión de bacterias y virus a la mucosa.
Al igual que las células T, las células B expresan un receptor único de células B (BCR), en este caso, una molécula de anticuerpo unida a la membrana. Todo el BCR de cualquier clon de células B reconoce y se une a un solo antígeno en particular. Una diferencia crítica entre las células B y las células T es cómo cada célula "ve" un antígeno. Las células T reconocen su antígeno afín en una forma procesada, como un péptido en el contexto de una molécula MHC, [2] mientras que las células B reconocen los antígenos en su forma nativa. [2] Una vez que una célula B encuentra su antígeno cognado (o específico) (y recibe señales adicionales de una célula T auxiliar(predominantemente tipo Th2)), se diferencia aún más en una célula efectora, conocida como célula plasmática. [2]
Las células plasmáticas son células de vida corta (2-3 días) que secretan anticuerpos. Estos anticuerpos se unen a los antígenos, lo que los hace blancos más fáciles para los fagocitos y desencadenan la cascada del complemento . [2] Alrededor del 10% de las células plasmáticas sobreviven para convertirse en células B de memoria específicas de antígeno de larga duración . [2] Ya preparadas para producir anticuerpos específicos, estas células pueden ser llamadas a responder rápidamente si el mismo patógeno vuelve a infectar al huésped, mientras que el huésped experimenta pocos síntomas, si es que presenta alguno.
Sistemas alternativos [ editar ]
En vertebrados sin mandíbula [ editar ]
Los vertebrados sin mandíbulas primitivos , como la lamprea y el hagfish , tienen un sistema inmune adaptativo que muestra 3 linajes celulares diferentes, cada uno de los cuales comparte un origen común con las células B, las células T αβ y las células T γΔ de tipo innato. [8] [9] En lugar de los anticuerpos clásicos y los receptores de células T , estos animales poseen una gran variedad de moléculas llamadas receptores variables de linfocitos(VLR, por sus siglas en inglés) que, al igual que los receptores de antígeno de los vertebrados mandibulares, se producen a partir de solo un pequeño número (uno o dos) de genes . Se cree que estas moléculas se unen a antígenos patógenosde manera similar a los anticuerpos, y con el mismo grado de especificidad. [10]
En insectos [ editar ]
Durante mucho tiempo se pensó que los insectos y otros invertebrados poseen solo un sistema inmunitario innato . Sin embargo, en los últimos años se han descubierto algunos de los distintivos básicos de la inmunidad adaptativa en los insectos. Esos rasgos son la memoria inmune y la especificidad. Aunque los sellos están presentes, los mecanismos son diferentes de los de los vertebrados .
La memoria inmune en los insectos fue descubierta a través del fenómeno de cebado. Cuando los insectos se exponen a una dosis no letal o bacterias muertas por calor , pueden desarrollar un recuerdo de esa infección que les permite soportar una dosis letal de la misma bacteria a la que fueron expuestos antes. [11] [12] A diferencia de los vertebrados, los insectos no poseen células específicas para inmunidad adaptativa. En cambio, esos mecanismos están mediados por los hemocitos . Los hemocitos funcionan de manera similar a los fagocitos y, después del cebado, son capaces de reconocer y engullir con más eficacia al patógeno. [13] También se demostró que es posible transferir la memoria a la descendencia. Por ejemplo en las abejas.Si la reina está infectada con bacterias, los trabajadores recién nacidos tienen habilidades mejoradas para luchar contra las mismas bacterias. [14] Otro modelo experimental basado en el escarabajo rojo de la harina también mostró la transferencia de memoria cebada específica de patógenos a la descendencia de madres y padres. [15]
La teoría de la especificidad más comúnmente aceptada se basa en el gen Dscam . El gen Dscam , también conocido como molécula adhesiva celular de síndrome de Down, es un gen que contiene 3 dominios de Igvariables . Esos dominios pueden ser empalmados alternativamente, alcanzando altos números de variaciones. [16] Se demostró que después de la exposición a diferentes patógenos se producen diferentes formas de empalme de dscam. Después de que los animales con diferentes formas de empalme son expuestos al mismo patógeno, solo los individuos con la forma de empalme específica para ese patógeno sobreviven. [dieciséis]
Otros mecanismos que apoyan la especificidad de la inmunidad contra insectos son la interferencia de ARN(ARNi). El ARNi es una forma de inmunidad antiviral con alta especificidad. [17] Tiene varias vías diferentes que terminan con la imposibilidad de replicación del virus. Una de las vías es el ARNsi en el que el ARN bicatenario largo se corta en pedazos que sirven como plantillas para el complejo proteico Ago2-RISC que encuentra y degrada el ARN complementario del virus. La ruta MiRNA en el citoplasma se une al complejo Ago1-RISC y funciona como una plantilla para la degradación del ARN viral. El último es el ARNip, donde el pequeño ARN se une a la familia de proteínas Piwi y controla los transposones y otros elementos móviles. [18] A pesar de la investigación, los mecanismos exactos responsables del cebado inmunológico y la especificidad en insectos no están bien descritos.
Memoria inmunológica [ editar ]
Cuando las células B y las células T se activan, algunas se convierten en células B de memoria y algunas células T de memoria . A lo largo de la vida de un animal, estas células de memoria forman una base de datos de linfocitos B y T efectivos. Tras la interacción con un antígeno encontrado previamente, se seleccionan y activan las células de memoria apropiadas. De esta manera, la segunda y posteriores exposiciones a un antígeno producen una respuesta inmunitaria más fuerte y más rápida. Esto es "adaptativo" en el sentido de que el sistema inmunológico del cuerpo se prepara para los desafíos futuros, pero es "inadaptado", por supuesto, si los receptores son autoinmunes. La memoria inmunológica puede estar en forma de memoria pasiva a corto plazo o memoria activa a largo plazo.
Memoria pasiva [ editar ]
La memoria pasiva suele ser a corto plazo y dura entre unos pocos días y varios meses. Los bebés recién nacidos no han tenido exposición previa a microbios y son particularmente vulnerables a la infección. La madre proporciona varias capas de protección pasiva. En el útero , la IgG materna se transporta directamente a través de la placenta , de modo que, al nacer, los bebés humanos tienen niveles altos de anticuerpos, con el mismo rango de especificidades de antígeno que su madre. [2] La leche materna contiene anticuerpos (principalmente IgA) que se transfieren al intestino del bebé, protegiendo contra infecciones bacterianas, hasta que el recién nacido pueda sintetizar sus propios anticuerpos. [2]
Esto es inmunidad pasiva porque el feto no produce realmente células de memoria o anticuerpos: solo los toma prestados. La inmunidad pasiva a corto plazo también puede transferirse artificialmente de un individuo a otro a través de un suero rico en anticuerpos .
Memoria activa [ editar ]
En general, la inmunidad activa es a largo plazo y puede ser adquirida por una infección seguida por la activación de las células B y las células T, o adquirida artificialmente por vacunas, en un proceso llamado inmunización.
Inmunización [ editar ]
Históricamente, las enfermedades infecciosas han sido la principal causa de muerte en la población humana. Durante el último siglo, se han desarrollado dos factores importantes para combatir su propagación: el saneamiento y la inmunización . [3] La inmunización (comúnmente conocida como vacunación ) es la inducción deliberada de una respuesta inmunitaria, y representa la manipulación más efectiva del sistema inmunitario que los científicos han desarrollado. [3] Las inmunizaciones son exitosas porque utilizan la especificidad natural del sistema inmunológico así como su inducibilidad.
El principio detrás de la inmunización es introducir un antígeno, derivada de un organismo causante de la enfermedad, que estimula el sistema inmune para desarrollar inmunidad protectora contra ese organismo, pero que no en sí causa los efectos patogénicos de ese organismo. Un antígeno (abreviatura de anti- generador decuerpo ), se define como cualquier sustancia que se une a un anticuerpo específico y provoca una respuesta inmune adaptativa . [1]
La mayoría de las vacunas virales se basan en virus vivos atenuados , mientras que muchas vacunas bacterianas se basan en componentes acelulares de microorganismos, incluidos componentes inofensivos de toxinas . [1] Muchos antígenos derivados de vacunas acelulares no inducen fuertemente una respuesta adaptativa, y la mayoría de las vacunas bacterianas requieren la adición de adyuvantes que activan las células presentadoras de antígenos del sistema inmunitario innato para mejorar la inmunogenicidad. [3]
La diversidad inmunológica [ editar ]
La mayoría de las moléculas grandes, que incluyen prácticamente todas las proteínas y muchos polisacáridos , pueden servir como antígenos. [2]Las partes de un antígeno que interactúan con una molécula de anticuerpo o un receptor de linfocitos, se denominan epítopos o determinantes antigénicos. La mayoría de los antígenos contienen una variedad de epítopos y pueden estimular la producción de anticuerpos, respuestas de células T específicas o ambos. [2] Una proporción muy pequeña (menos del 0.01%) de los linfocitos totales puede unirse a un antígeno particular, lo que sugiere que solo unas pocas células responden a cada antígeno. [3]
Para que la respuesta adquirida "recuerde" y elimine una gran cantidad de patógenos, el sistema inmunológico debe poder distinguir entre muchos antígenos diferentes [1] y los receptores que reconocen los antígenos deben producirse en una gran variedad de configuraciones, en esencia una receptor (al menos) para cada patógeno diferente que pueda encontrarse. Incluso en ausencia de estimulación de antígeno, un ser humano puede producir más de 1 billón de moléculas de anticuerpos diferentes. [3] Se requerirían millones de genes para almacenar la información genética que produce estos receptores, pero el genoma humano completo contiene menos de 25,000 genes . [19]
Se producen miles de receptores a través de un proceso conocido como selección clonal . [1] [2] De acuerdo con la teoría de la selección clonal, al nacer, un animal genera aleatoriamente una gran diversidad de linfocitos (cada uno con un receptor de antígeno único) a partir de información codificada en una pequeña familia de genes. Para generar cada receptor de antígeno único, estos genes se han sometido a un proceso denominado recombinación V (D) J o diversificación combinatoria, en el que un segmento genético se recombina con otros segmentos genéticos para formar un único gen único. Este proceso de ensamblaje genera la enorme diversidad de receptores y anticuerpos, antes de que el cuerpo encuentre antígenos, y permite que el sistema inmunitario responda a una diversidad de antígenos casi ilimitada. [2] A lo largo de la vida de un animal, los linfocitos que pueden reaccionar contra los antígenos que un animal realmente encuentra son seleccionados para la acción, dirigidos contra cualquier cosa que exprese ese antígeno.
Tenga en cuenta que las partes innatas y adquiridas del sistema inmunológico trabajan juntas, no a pesar de las demás. El brazo adquirido, las células B y las células T no podrían funcionar sin la entrada del sistema innato. Las células T son inútiles sin que las células presentadoras de antígeno las activen, y las células B están mutiladas sin la ayuda de las células T. Por otro lado, es probable que el sistema innato esté saturado de patógenos sin la acción especializada de la respuesta inmune adaptativa.





No hay comentarios:
Publicar un comentario