' Procesamiento de antígenos o citosólica' vía es un proceso inmunológico que prepara a antígenos para la presentación a las células especiales del sistema inmunológico llamado linfocitos T . Se considera una etapa de las vías de presentación de antígenos. Este proceso involucra dos vías distintas para el procesamiento de antígenos a partir de proteínas propias del organismo o patógenos intracelulares (por ejemplo, virus ), o de patógenos fagocitados (por ejemplo, bacterias ); Presentación posterior de estos antígenos en el complejo de histocompatibilidad principal de clase I o clase II Las moléculas (MHC) dependen de la vía que se utilice. Tanto el MHC de clase I como el II deben unirse al antígeno antes de que se expresen de manera estable en la superficie de una célula. La presentación del antígeno MHC I normalmente (considerando la presentación cruzada ) implica la ruta endógena del procesamiento del antígeno, y la presentación del antígeno MHC II implica la ruta exógena del procesamiento del antígeno. La presentación cruzada involucra partes de las rutas exógenas y endógenas, pero en última instancia involucra la última parte de la ruta endógena (por ejemplo, la proteólisis de antígenos para unirse a las moléculas del MHC I).
Si bien la distinción conjunta entre las dos vías es útil, hay casos en que los péptidos derivados extracelulares se presentan en el contexto de MHC de clase I y los péptidos citosólicos se presentan en el contexto de MHC de clase II (esto sucede a menudo en las células dendríticas ).
El Camino endógena [ editar ]
La ruta endógena se utiliza para presentar fragmentos de péptidos celulares en la superficie celular en moléculas de clase I de MHC. Si un virus hubiera infectado la célula, también se presentarían péptidos virales, permitiendo que el sistema inmunitario reconozca y mate a la célula infectada. Las proteínas desgastadas dentro de la célula se ubican en forma ubicua , marcándolas para la degradación del proteasoma . Los proteasomas dividen la proteína en péptidos que incluyen alrededor de nueve aminoácidos de largo (adecuados para encajar dentro de la hendidura de unión al péptido de las moléculas de MHC de clase I) Transportador asociado con el procesamiento de antígenos (TAP), una proteína que atraviesa la membrana del retículo endoplasmático rugoso, transporta los péptidos a la luz del retículo endoplasmático rugoso (ER). También dentro del ER aproximado, una serie de proteínas chaperonas , que incluyen calnexina , calreticulina , ERp57 y la proteína de inmunoglobulina de unión (BiP) facilitan el plegamiento adecuado de la clase I MHC y su asociación con la microglobulina β2 . La molécula de MHC clase I parcialmente plegada luego interactúa con TAP a través de la tapasina (el complejo completo también contiene calreticulina y Erp57 y, en ratones, calnexina). Una vez que el péptido se transporta a la luz del RE, se une a la hendidura de la molécula de clase I del MHC en espera, estabilizando el MHC y permitiendo que sea transportado a la superficie celular por elaparato de golgi .
El Camino exógena [ editar ]
La vía exógena es utilizada por células especializadas presentadoras de antígenos para presentar péptidos derivados de proteínas que la célula ha endocitosado. Los péptidos se presentan en moléculas MHC de clase II. Las proteínas son endocitadas y degradadas por proteasas dependientes de ácido en endosomas ; este proceso dura aproximadamente una hora. [1]
La naciente proteína MHC de clase II en el RE rugoso tiene su hendidura de unión a péptido bloqueada por Ii (la cadena invariante ; un trímero) para evitar que se una a los péptidos o péptidos celulares de la vía endógena. La cadena invariante también facilita la exportación de MHC de clase II desde la ER en una vesícula. Esto se fusiona con un endosoma tardío que contiene las proteínas degradadas y endocitadas. La cadena invariante se divide en etapas, dejando solo un pequeño fragmento llamado "péptido de cadena invariante asociado a la Clase II" ( CLIP ) que todavía bloquea la hendidura de unión del péptido. Una estructura similar a MHC clase II, HLA-DM , elimina el CLIP y lo reemplaza con un péptido del endosoma. El MHC estable clase II se presenta luego sobre la superficie celular.
La presentación cruzada de Procesamiento [ editar ]
En presentación cruzadaLos péptidos derivados de proteínas extracelulares se presentan en el contexto de la clase I del MHC. La célula comienza con las vías exógenas pero desvía los antígenos (desviación citosólica) a la vía endógena. Esto puede permitir que la célula se salte las partes de la ruta endógena que involucra la síntesis de antígenos a partir de genes antigénicos con maquinaria celular en la infección, ya que la ruta endógena puede involucrar una infección antes de poder presentar antígenos con MHC I, y la presentación cruzada guarda El esfuerzo es necesario para eso y permite que las células presentadoras de antígenos profesionales (células dendríticas) procesen y presenten antígenos sin infectarse, lo que no tiende a pasar a las células dendríticas y es un escenario muy común de procesamiento de antígenos utilizando la vía endógena. [2] No todas las células presentadoras de antígenos utilizan la presentación cruzada.
Evasión Viral de procesamiento de antígenos [ editar ]
Ciertas especies de la familia de los citolomegavirus pueden hacer que la célula infectada produzca proteínas como US2, 3, 6 y / o 11. US11 y US2 confunden al MHC I con el citoplasma; US3 inhibe el transporte de MHC I en la ER (una parte de la ruta endógena y la presentación cruzada); US6 bloquea el transporte de péptidos por TAP a MHC I.
Mycobacterium tuberculosis inhibe la fusión fagosoma-endosoma, evitando así ser destruido por el duro ambiente del fagosoma. [3]
ICP47 de algunos herpesvirus bloquea el transporte del péptido por TAP. U21 de algunos herpesvirus 7 humanos se une y se dirige a ciertas moléculas de MHC I para la degradación lisosomal.
E19 de algunos adenovirus bloquea el movimiento de MHC I a las ubicaciones apropiadas para la ruta endógena.
El Nef de algunas cepas de VIH mejora el movimiento de las moléculas de MHC de vuelta al citoplasma, evitando que presenten antígenos.
El papel de las células dendríticas de Langerhans en el procesamiento de antígenos [ editar ]
Las células de Langerhans son un tipo particular de células dendríticas presentes en tejidos no linfoides junto con células intersticiales. Cuando estas células (en estado inmaduro) entran en contacto con células antigénicas o virus causantes de enfermedades, estas células producen un estímulo inflamatorio y comienzan el procesamiento del antígeno. y avanzar hacia los ganglios linfáticos donde estas APC presentan antígeno a los linfocitos T maduros.
Antígeno dependiente de T: antígenos que requieren la asistencia de las células T para inducir la formación de anticuerpos específicos. Antígeno T independiente: antígenos que estimulan las células B directamente.
Activación de células B con interacciones de células BT [ editar ]
Los linfocitos son uno de los cinco tipos de glóbulos blancos o leucocitos que circulan en la sangre. Aunque todos los linfocitos maduros se parecen mucho, son extraordinariamente diversos en sus funciones. Los linfocitos más abundantes son: linfocitos B (a menudo llamados simplemente células B) y linfocitos T (también llamados células T). Las células B se producen en la médula ósea. Los precursores de las células T también se producen en la médula ósea, pero dejan la médula ósea y maduran en el timo (lo que explica su designación). Enlace al dibujo que muestra los órganos del sistema inmunológico. Cada célula B y T es específica para un antígeno particular. Lo que esto significa es que cada uno es capaz de unirse a una estructura molecular particular. La especificidad de la unión reside en un receptor para el antígeno: el receptor de células B(BCR) para el antígeno y el receptor de células T (TCR) respectivamente. Tanto BCR como TCRComparte estas propiedades: Son proteínas integrales de membrana. Están presentes en miles de copias idénticas expuestas en la superficie de la célula. Se fabrican antes de que la célula se encuentre con un antígeno. Están codificados por genes ensamblados por la recombinación de segmentos de ADN. Cómo se genera la diversidad de receptores de antígenos. Tienen un sitio de unión único. Este sitio se une a una porción del antígeno llamado determinante antigénico o epítope. La unión, como la que existe entre una enzima y su sustrato, depende de la complementariedad de la superficie del receptor y la superficie del epítope. La unión se produce por fuerzas no covalentes (de nuevo, como una enzima que se une a su sustrato). La unión exitosa del receptor de antígeno al epítope, si se acompaña de señales adicionales, resulta en: la estimulación de la célula para que abandone G0 y entre en el ciclo celular. La mitosis repetida conduce al desarrollo de un clon de células que tienen el mismo receptor de antígeno; es decir, un clon de células de idéntica especificidad. Los BCR y los TCR difieren en: su estructura; los genes que los codifican; El tipo de epítope al que se unen. Células B
Los BCR se unen a antígenos intactos (como el toxoide diftérico, la proteína introducida en su cuerpo en la vacuna DTP). Estas pueden ser moléculas solubles presentes en el fluido extracelular; moléculas intactas que las células B extraen de la superficie de las células presentadoras de antígenos, como los macrófagos y las células dendríticas. Las moléculas de antígeno unidos se envuelven en la célula B mediante endocitosis mediada por receptor. El antígeno se digiere en fragmentos que luego se muestran en la superficie celular anidada dentro de una molécula de histocompatibilidad de clase II. Las células T auxiliares específicas para esta estructura (es decir, con TCR complementarios) se unen a las células B y secretan linfoquinas que: estimulan a las células B para que entren en el ciclo celular y se desarrollen, mediante mitosis repetida, en un clon de células con BCR idénticas; Enlace a la discusión de la selección clonal. pasar de sintetizar sus BCR como proteínas integrales de membrana a una versión soluble; diferenciarse en células plasmáticas que secretan estos BCR solubles, que ahora llamamos anticuerpos.
La superficie de cada célula T también muestra miles de receptores de células T idénticos (TCR). Hay dos tipos de células T que difieren en su TCR: células T alfa / beta (αβ). Su TCR es un heterodímero de una cadena alfa con una cadena beta. Cada cadena tiene una región variable (V) y una región constante (C). Cada una de las regiones V contiene 3 regiones hipervariables que forman el sitio de unión al antígeno. Células T gamma / delta (γδ). Su TCR también es un heterodímero de una cadena gamma emparejada con una cadena delta. La discusión que sigue ahora se refiere a las células T alfa / beta. Las células T gamma / delta, que son menos conocidas. El TCR (de las células T alfa / beta) se une a un complejo bimolecular que se muestra en la superficie de alguna otra célula llamada célula presentadora de antígeno (APC).
La interacción antígeno-anticuerpo, o reacción antígeno-anticuerpo , es una interacción química específica entre los anticuerpos producidos por las células B de los glóbulos blancos y los antígenos durante la reacción inmune . Es la reacción fundamental en el cuerpo mediante la cual el cuerpo está protegido de moléculas extrañas complejas, como los patógenos y sus toxinas químicas. En la sangre, los antígenos están específicamente y con alta afinidad unidos por los anticuerpos para formar un complejo antígeno-anticuerpo. El complejo inmune luego se transporta a los sistemas celulares donde se puede destruir o desactivar.
La primera descripción correcta de la reacción antígeno-anticuerpo fue dada por Richard J. Goldberg en la Universidad de Wisconsin en 1952. [1] [2] Llegó a conocerse como la "teoría de Goldberg" (de la reacción antígeno-anticuerpo). [3]
Hay varios tipos de anticuerpos y antígenos, y cada anticuerpo es capaz de unirse solo a un antígeno específico. La especificidad de la unión se debe a la constitución química específica de cada anticuerpo. El determinante antigénico o epítopo es reconocido por el parátope del anticuerpo, situado en la región variable de la cadena polipeptídica. La región variable a su vez tiene regiones hipervariables que son secuencias de aminoácidosúnicas en cada anticuerpo. Los antígenos se unen a los anticuerpos a través de interacciones débiles y no covalentes, tales como interacciones electrostáticas , enlaces de hidrógeno , fuerzas de Van der Waals e interacciones hidrófobas . [4]
Los principios de especificidad y reactividad cruzada de la interacción antígeno-anticuerpo son útiles en el laboratorio clínico para fines de diagnóstico. Una aplicación básica es la determinación del grupo sanguíneo ABO. También se usa como una técnica molecular para la infección con diferentes patógenos, como el VIH, los microbios y los parásitos helmintos.
Bases moleculares [ editar ]
La inmunidad desarrollada a medida que un individuo se expone a antígenos se denomina inmunidad adaptativa o adquirida, en contraste con la inmunidad desarrollada al nacer, que es inmunidad innata. La inmunidad adquirida depende de la interacción entre los antígenos y un grupo de proteínas llamadas anticuerpos producidos por las células B de la sangre. Hay muchos anticuerpos y cada uno es específico para un tipo particular de antígeno. Por lo tanto, la respuesta inmune en la inmunidad adquirida se debe a la unión precisa de los antígenos al anticuerpo. Solo un área muy pequeña de los antígenos y las moléculas de anticuerpos realmente interactúan a través de los sitios de unión complementarios, llamados epítopos en antígenos y paratopes en anticuerpos. [5]
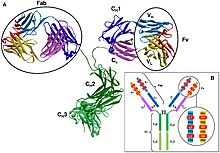
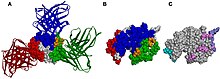
Estructura de anticuerpos [ editar ]
En un anticuerpo, la región Fab (fragmento, unión a antígeno) se forma a partir del extremo amino terminal de las cadenas ligeras y pesadas del polipéptido de inmunoglobulina . Esta región, llamada dominio variable (V), está compuesta por secuencias de aminoácidos que definen cada tipo de anticuerpo y su afinidad de unión a un antígeno. La secuencia combinada de cadena ligera variable (V L ) y variable de cadena pesada (V H ) crea tres regiones hipervariables (HV1, HV2, HV3 y). En V Lestos son aproximadamente de los residuos 28 a 35, de 49 a 59, y de 92 a 103, respectivamente. HV3 es la parte más variable. Así, estas regiones son el paratopo, el sitio de unión de un antígeno. El resto de la región V entre las regiones hipervariables se denominan regiones marco. Cada dominio V tiene cuatro dominios marco, a saber, FR1, FR2, FR3 y FR4. [4] [6]
Propiedades [ editar ]
Base química de la interacción antígeno-anticuerpo [ editar ]
Los anticuerpos se unen a los antígenos a través de interacciones químicas débiles, y el enlace es esencialmente no covalente . Se sabe que las interacciones electrostáticas , los enlaces de hidrógeno , las fuerzas de van der Waals y las interacciones hidrófobas están involucradas, dependiendo de los sitios de interacción. [7] [8] Los enlaces no covalentes entre el anticuerpo y el antígeno también pueden estar mediados por moléculas de agua interfacial. Tales enlaces indirectos pueden contribuir al fenómeno de la reactividad cruzada, es decir, el reconocimiento de antígenos diferentes pero relacionados por un solo anticuerpo. [9]
Afinidad de la interacción [ editar ]
El antígeno y el anticuerpo interactúan a través de una unión de alta afinidad, como el bloqueo y la llave. [10]Existe un equilibrio dinámico para la unión. Por ejemplo, la reacción es reversible y se puede expresar como:
donde [Ab] es la concentración de anticuerpo y [Ag] es la concentración de antígeno , ya sea en estado libre ([Ab], [Ag]) o unido ([AbAg]).
La constante de asociación de equilibrio puede por lo tanto representarse como:
Recíprocamente la constante de disociación será:
Sin embargo, estas ecuaciones son aplicables solo a la unión de un único epítopo, es decir, un antígeno en un anticuerpo. Dado que el anticuerpo necesariamente tiene dos paratopes, y en muchas circunstancias se produce una unión compleja, el equilibrio de unión múltiple se puede resumir como:
donde, en el equilibrio, c es la concentración de ligando libre, r representa la relación de la concentración de ligando unido a la concentración total de anticuerpo yn es el número máximo de sitios de unión por molécula de anticuerpo (la valencia del anticuerpo).
La fuerza global de la unión de un anticuerpo a un antígeno se denomina su avidez por ese antígeno. Dado que los anticuerpos son bivalentes o polivalentes, esta es la suma de las fortalezas de las interacciones anticuerpo-antígeno individuales. La fuerza de una interacción individual entre un único sitio de unión en un anticuerpo y su epítopo objetivo se denomina afinidad de esa interacción.
La avidez y la afinidad se pueden juzgar por la constante de disociación de las interacciones que describen. Cuanto más baja sea la constante de disociación, mayor será la avidez o afinidad y más fuerte será la interacción.
Enfermedad autoinmune [ editar ]
Normalmente, los anticuerpos pueden detectar y diferenciar moléculas del exterior del cuerpo y aquellas producidas dentro del cuerpo como resultado de actividades celulares. Moléculas propias como ignoradas por el sistema inmune. Sin embargo, en ciertas condiciones, los anticuerpos reconocen las moléculas propias como antígenos y desencadenan respuestas inmunes inesperadas. Esto resulta en diferentes enfermedades autoinmunes dependiendo del tipo de antígenos y anticuerpos involucrados. Tales condiciones son siempre dañinas y algunas veces mortales. Aún no se conoce la naturaleza exacta de la interacción anticuerpo-antígeno en la enfermedad autoinmune. [11] [12] .
Aplicación [ editar ]
La interacción antígeno-anticuerpo se utiliza en técnicas de laboratorio para pruebas serológicas de compatibilidad sanguínea y diversas infecciones patógenas. La más básica es la determinación de grupo sanguíneo ABO, que es útil para la transfusión de sangre. [13] Las aplicaciones sofisticadas incluyen ELISA , [14]immunospot ligado a enzimas (Elispot), inmunofluorescencia e inmunoelectroforesis. [15] [16] [17]
Reacción de precipitación [ editar ]
Los antígenos solubles se combinan con anticuerpos solubles en presencia de un electrolito a una temperatura y pH adecuados para formar un complejo visible insoluble. Esto se llama una reacción de precipitación. Se utiliza para la determinación cualitativa y cuantitativa de antígeno y anticuerpo. Una prueba de anillo especial es útil para el diagnóstico de ántrax y la determinación de la adulteración en los alimentos.
Reacción de aglutinación [ editar ]
Actúa sobre la reacción antígeno-anticuerpo en la que los anticuerpos entrecruzan los antígenos particulados dando como resultado la aglomeración visible de la partícula. Hay dos tipos, a saber, aglutinación activa y pasiva. Se utilizan en los análisis de sangre para el diagnóstico de fiebre entérica.
![{\ displaystyle {\ ce {[Ab] + [Ag] <=> [AbAg]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/811fa758653c8d49cd0ce39294d057605d41ea0c)
![{\ displaystyle K_ {a} = {\ frac {k _ {{\ ce {on}}}} {k _ {{\ ce {off}}}}} = {\ frac {{\ ce {[AbAg]}} } {{\ ce {[Ab] [Ag]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3b1a025e34905d807924817cf21ed4e800e2bd87)
![{\ displaystyle K_ {d} = {\ frac {k _ {{\ ce {off}}}} {k _ {{\ ce {on}}}}} = {\ frac {{\ ce {[Ab] [Ag ]}}} {{\ ce {[AbAg]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/06053e68e377c191d306c1b2e3e107b501c690eb)
![{\ displaystyle K_ {a} = {\ frac {k _ {{\ ce {on}}}} {k _ {{\ ce {off}}}}} = {\ frac {{\ ce {[AbAg]}} } {{\ ce {[Ab] [Ag]}}}} = {\ frac {r} {c (nr)}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8f9f4e8ebefef3ea5f8e78c76d74c29395c8f23c)
No hay comentarios:
Publicar un comentario