En física , un estado de la materia es una de las formas distintas en que puede existir la materia . Cuatro estados de la materia son observables en la vida cotidiana: sólido , líquido , gas y plasma . Se sabe que existen muchos estados intermedios, como el cristal líquido , y algunos estados solo existen en condiciones extremas, como los condensados de Bose-Einstein , la materia degenerada de neutrones y el plasma de quarks y gluones , que solo ocurren, respectivamente, en situaciones de extrema Frío, densidad extrema, y extremadamente alta energía. Para una lista completa de todos los estados exóticos de la materia, vea laLista de estados de la materia .
Históricamente, la distinción se hace en base a diferencias cualitativas en las propiedades. La materia en estado sólido mantiene un volumen y una forma fijos, con partículas componentes ( átomos , moléculas o iones ) juntas y fijas en su lugar. La materia en estado líquido mantiene un volumen fijo, pero tiene una forma variable que se adapta para adaptarse a su contenedor. Sus partículas todavía están juntas pero se mueven libremente. La materia en estado gaseoso tiene volumen y forma variables, y se adapta a ambos para que se ajusten a su recipiente. Sus partículas no están ni juntas ni fijas en su lugar. La materia en el estado de plasma tiene volumen y forma variables, y contiene átomos neutros, así como un número significativo de iones y electrones, los cuales pueden moverse libremente.
El término fase se usa a veces como sinónimo para el estado de la materia, pero un sistema puede contener varias fases inmiscibles del mismo estado de la materia.
Los cuatro estados fundamentales.
Sólido
En un sólido, las partículas constituyentes (iones, átomos o moléculas) están muy juntas. Las fuerzas entre las partículas son tan fuertes que las partículas no pueden moverse libremente sino que solo pueden vibrar. Como resultado, un sólido tiene una forma estable y definida, y un volumen definido. Los sólidos solo pueden cambiar su forma por la fuerza, como cuando se rompen o se cortan.
En los sólidos cristalinos , las partículas (átomos, moléculas o iones) se empaquetan en un patrón de repetición regularmente ordenado. Hay varias estructuras cristalinas diferentes , y la misma sustancia puede tener más de una estructura (o fase sólida). Por ejemplo, el hierro tiene una estructura cúbica centrada en el cuerpo a temperaturas inferiores a 912 ° C (1.674 ° F) y una estructura cúbica centrada en la cara entre 912 y 1.394 ° C (2.541 ° F). El hielo tiene quince estructuras cristalinas conocidas, o quince fases sólidas, que existen a diferentes temperaturas y presiones. [1]
Los vidrios y otros sólidos amorfos no cristalinos sin orden de largo alcance no son estados fundamentales de equilibrio térmico ; por lo tanto, se describen a continuación como estados no clásicos de la materia.
Los sólidos se pueden transformar en líquidos por fusión, y los líquidos se pueden transformar en sólidos por congelación. Los sólidos también pueden transformarse directamente en gases a través del proceso de sublimación , y los gases también pueden cambiar directamente en sólidos a través de la deposición .
Líquido
Un líquido es un fluido casi incompresible que se adapta a la forma de su recipiente pero retiene un volumen (casi) constante independiente de la presión. El volumen es definido si la temperatura y la presión son constantes. Cuando un sólido se calienta por encima de su punto de fusión , se vuelve líquido, dado que la presión es más alta que el punto triplede la sustancia. Las fuerzas intermoleculares (o interatómicas o interiónicas) siguen siendo importantes, pero las moléculas tienen suficiente energía para moverse entre sí y la estructura es móvil. Esto significa que la forma de un líquido no es definida pero está determinada por su contenedor. El volumen es por lo general mayor que la de la, siendo el más conocido excepción sólido correspondiente de agua , H 2O. La temperatura más alta a la que puede existir un líquido dado es su temperatura crítica . [2]
Gas
Un gas es un fluido compresible. Un gas no solo se adaptará a la forma de su recipiente, sino que también se expandirá para llenar el recipiente.
En un gas, las moléculas tienen suficiente energía cinética para que el efecto de las fuerzas intermoleculares sea pequeño (o cero para un gas ideal ), y la distancia típica entre las moléculas vecinas es mucho mayor que el tamaño molecular. Un gas no tiene una forma o volumen definido, pero ocupa todo el contenedor en el que está confinado. Un líquido se puede convertir en gas calentando a presión constante hasta el punto de ebullición , o bien reduciendo la presión a temperatura constante.
A temperaturas inferiores a su temperatura crítica , un gas también se denomina vapor y se puede licuar solo por compresión sin enfriamiento. Un vapor puede existir en equilibrio con un líquido (o sólido), en cuyo caso la presión del gas es igual a la presiónde vapor del líquido (o sólido).
Un fluido supercrítico (SCF) es un gas cuya temperatura y presión están por encima de la temperatura crítica y la presión crítica, respectivamente. En este estado, la distinción entre líquido y gas desaparece. Un fluido supercrítico tiene las propiedades físicas de un gas, pero su alta densidad confiere propiedades de solvente en algunos casos, lo que conduce a aplicaciones útiles. Por ejemplo, el dióxido de carbono supercrítico se usa para extraer cafeína en la fabricación de café descafeinado . [3]
Plasma
Como un gas, el plasma no tiene una forma o volumen definido. A diferencia de los gases, los plasmas son eléctricamente conductores, producen campos magnéticos y corrientes eléctricas y responden fuertemente a las fuerzas electromagnéticas. Los núcleos cargados positivamente nadan en un "mar" de electrones disociados que se mueven libremente, similar a la forma en que existen tales cargas en el metal conductor, donde este electrón "mar" permite que la materia en el estado de plasma conduzca la electricidad.
Un gas generalmente se convierte en plasma en una de dos formas, por ejemplo, a partir de una enorme diferencia de voltaje entre dos puntos, o al exponerlo a temperaturas extremadamente altas. Calentar la materia a altas temperaturas hace que los electrones salgan de los átomos, lo que resulta en la presencia de electrones libres. Esto crea un llamado plasma parcialmente ionizado. A temperaturas muy altas, como las que se encuentran en las estrellas, se supone que esencialmente todos los electrones son "libres" y que un plasma de muy alta energía es esencialmente un núcleo desnudo que se encuentra en un mar de electrones. Esto forma el llamado plasma completamente ionizado.
El estado del plasma a menudo se malinterpreta y, aunque no existe libremente en condiciones normales en la Tierra, se genera con bastante frecuencia mediante rayos , chispas eléctricas , luces fluorescentes , luces de neón o televisores de plasma . La corona solar , algunos tipos de llamas y las estrellas son ejemplos de materia iluminada en el estado de plasma.
Transiciones de fase
Un estado de la materia también se caracteriza por transiciones de fase . Una transición de fase indica un cambio en la estructura y puede reconocerse por un cambio abrupto en las propiedades. Un estado distinto de la materia se puede definir como cualquier conjunto de estados que se distingue de cualquier otro conjunto de estados mediante una transición de fase . Se puede decir que el agua tiene varios estados sólidos distintos. [4] La aparición de la superconductividad se asocia con una transición de fase, por lo que hay estados superconductores . Asimismo, los estados ferromagnéticos están demarcados por transiciones de fase y tienen propiedades distintivas. Cuando el cambio de estado ocurre en etapas, los pasos intermedios se llaman mesofases.. Tales fases han sido explotadas por la introducción de la tecnología de cristal líquido . [5] [6]
El estado o fase de un conjunto dado de materia puede cambiar dependiendo de las condiciones de presión y temperatura , haciendo la transición a otras fases a medida que estas condiciones cambian para favorecer su existencia; por ejemplo, transiciones sólidas a líquido con un aumento de temperatura. Cerca del cero absoluto , una sustancia existe como un sólido . A medida que se agrega calor a esta sustancia, se funde en un líquido en su punto de fusión , hierve en un gas en su punto de ebullición , y si se calienta lo suficientemente alto entraría en un estado de plasma en el que los electrones están tan energizados que dejan sus átomos principales.
Las formas de materia que no están compuestas de moléculas y que están organizadas por diferentes fuerzas también pueden considerarse diferentes estados de materia. Los superfluidos (como el condensado fermiónico ) y el plasma quark-gluon son ejemplos.
En una ecuación química, el estado de la materia de los productos químicos se puede mostrar como (s) para el sólido, (l) para el líquido y (g) para el gas. Una solución acuosa se denota (aq). La materia en el estado de plasma rara vez se usa (si es que existe) en las ecuaciones químicas, por lo que no hay un símbolo estándar para denotarla. En las raras ecuaciones en que el plasma se usa en plasma, se simboliza como (p).
Estados no clasicos
Vaso
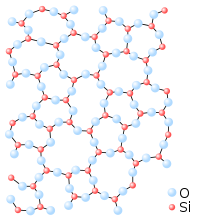
El vidrio es un material sólido no cristalino o amorfo que muestra una transición vítreacuando se calienta hacia el estado líquido. Los vidrios pueden fabricarse de clases de materiales bastante diferentes: redes inorgánicas (como vidrio de ventana, hechas de silicato más aditivos), aleaciones metálicas, fundidos iónicos, soluciones acuosas, líquidos moleculares y polímeros. Termodinámicamente, un vidrio está en un estado metaestable con respecto a su contraparte cristalina. La tasa de conversión, sin embargo, es prácticamente cero.
Cristales con cierto grado de desorden.
Un cristal de plástico es un sólido molecular con un orden posicional de largo alcance pero con moléculas constituyentes que conservan la libertad de rotación; en un vaso orientativo, este grado de libertad se congela en un estado de desorden apagado .
Estados de cristal liquido
Los estados de cristal líquido tienen propiedades intermedias entre los líquidos móviles y los sólidos ordenados. Generalmente, son capaces de fluir como un líquido, pero exhiben un orden de largo alcance. Por ejemplo, la fase nemática consiste en moléculas similares a barras largas, como el para-azoxianisol , que es nemática en el rango de temperatura 118–136 ° C (244–277 ° F). [7] En este estado, las moléculas fluyen como en un líquido, pero todas apuntan en la misma dirección (dentro de cada dominio) y no pueden girar libremente. Como un sólido cristalino, pero a diferencia de un líquido, los cristales líquidos reaccionan a la luz polarizada.
Otros tipos de cristales líquidos se describen en el artículo principal sobre estos estados. Varios tipos tienen importancia tecnológica, por ejemplo, en pantallas de cristal líquido .
Magnéticamente ordenado
Los átomos de metales de transición a menudo tienen momentos magnéticos debido al giro neto de los electrones que permanecen sin par y no forman enlaces químicos. En algunos sólidos, los momentos magnéticos en diferentes átomos están ordenados y pueden formar un ferromagneto, un antiferromagneto o un ferrimagneto.
En un ferromagneto , por ejemplo, en hierro sólido, el momento magnético en cada átomo está alineado en la misma dirección (dentro de un dominio magnético ). Si los dominios también están alineados, el sólido es un imán permanente , que es magnético incluso en ausencia de un campo magnético externo . La magnetizacióndesaparece cuando el imán se calienta hasta el punto de Curie , que para el hierro es de 768 ° C (1,414 ° F).
Un antiferromagneto tiene dos redes de momentos magnéticos iguales y opuestos, que se cancelan mutuamente para que la magnetización neta sea cero. Por ejemplo, en el óxido de níquel (II) (NiO), la mitad de los átomos de níquel tienen momentos alineados en una dirección y la otra mitad en la dirección opuesta.
En un ferrimagneto , las dos redes de momentos magnéticos son opuestas pero desiguales, por lo que la cancelación está incompleta y existe una magnetización neta no cero. Un ejemplo es la magnetita (Fe 3 O 4 ), que contiene iones Fe 2+ y Fe 3+ con diferentes momentos magnéticos.
Un líquido de espín cuántico (QSL) es un estado desordenado en un sistema de espines cuánticos interactivos que conserva su desorden a temperaturas muy bajas, a diferencia de otros estados desordenados. No es un líquido en el sentido físico, sino un sólido cuyo orden magnético está inherentemente desordenado. El nombre "líquido" se debe a una analogía con el trastorno molecular en un líquido convencional. Un QSL no es un ferromagneto , donde los dominios magnéticos son paralelos, ni un antiferromagneto , donde los dominios magnéticos son antiparalelos; en cambio, los dominios magnéticos están orientados al azar. Esto se puede realizar, por ejemplo, por frustrado geométricamenteMomentos magnéticos que no pueden apuntar uniformemente paralelos o antiparalelos. Al enfriarse y establecerse en un estado, el dominio debe "elegir" una orientación, pero si los estados posibles son similares en energía, se elegirá uno al azar. En consecuencia, a pesar de un orden fuerte de corto alcance, no hay un orden magnético de largo alcance.
Separado por microfase
Los copolímeros pueden sufrir una separación de microfases para formar una serie diversa de nanoestructuras periódicas, como se muestra en el ejemplo del copolímero de bloques de estireno-butadieno-estireno que se muestra a la derecha. La separación de microfases se puede entender por analogía con la separación de fases entre el aceite y el agua. Debido a la incompatibilidad química entre los bloques, los copolímeros de bloques experimentan una separación de fase similar. Sin embargo, debido a que los bloques están unidos covalentementeentre sí, no pueden mezclarse macroscópicamente como el agua y el aceite, y así los bloques forman estructuras de tamaño nanométrico . Dependiendo de las longitudes relativas de cada bloque y de la topología de bloque global del polímero, se pueden obtener muchas morfologías, cada una de ellas su propia fase de materia.
Los líquidos iónicos también muestran la separación de microfases. El anión y el catión no son necesariamente compatibles y se mezclarían de otro modo, pero la atracción de carga eléctrica evita que se separen. Sus aniones y cationes parecen difundirse dentro de capas o micelas compartimentadas en lugar de libremente como en un líquido uniforme. [8]
Estados de baja temperatura
Superfluido
Cerca del cero absoluto, algunos líquidos forman un segundo estado líquido descrito como superfluido porque tiene una viscosidad cero (o fluidez infinita; es decir, fluye sin fricción). Esto se descubrió en 1937 para el helio , que forma un superfluido por debajo de la temperatura lambda de 2.17 K (−270.98 ° C) (con −270.98 ° C (−455.76 ° F)). En este estado intentará "trepar" fuera de su contenedor. [9] También tiene una conductividad térmica infinita, de modo que no se puede formar un gradiente de temperatura en un superfluido. Colocar un superfluido en un contenedor giratorio dará como resultado vórtices cuantificados .
Estas propiedades se explican por la teoría de que el isótopo común helio-4 forma un condensado de Bose-Einstein (ver la siguiente sección) en el estado superfluido. Más recientemente, los superfluidos de condensado fermiónico se han formado a temperaturas incluso más bajas por el raro isótopo helio-3 y por litio-6 . [10]
Condensado de Bose-Einstein
En 1924, Albert Einstein y Satyendra Nath Bose predijeron el "condensado de Bose-Einstein" (BEC), a veces denominado el quinto estado de la materia. En un BEC, la materia deja de comportarse como partículas independientes y se colapsa en un solo estado cuántico que se puede describir con una función de onda única y uniforme.
En la fase gaseosa, el condensado de Bose-Einstein siguió siendo una predicción teórica sin verificar durante muchos años. En 1995, los grupos de investigación de Eric Cornell y Carl Wieman , de JILA en la Universidad de Colorado en Boulder , produjeron el primer condensado de este tipo experimentalmente. Un condensado de Bose-Einstein es "más frío" que un sólido. Puede ocurrir cuando los átomos tienen niveles cuánticos muy similares (o iguales) , a temperaturas muy cercanas al cero absoluto: -273.15 ° C (-459.67 ° F).
Condensado fermionico
Un condensado fermiónico es similar al condensado de Bose-Einstein pero está compuesto de fermiones . El principio de exclusión de Pauli evita que los fermiones entren en el mismo estado cuántico, pero un par de fermiones pueden comportarse como un bosón, y múltiples pares pueden ingresar al mismo estado cuántico sin restricción.
Molécula de Rydberg
Uno de los estados metaestables del plasma fuertemente no ideal es la materia de Rydberg , que se forma tras la condensación de los átomos excitados . Estos átomos también pueden convertirse en iones y electrones si alcanzan una cierta temperatura. En abril de 2009, Nature informó sobre la creación de moléculas de Rydberg a partir de un átomo de Rydberg y un átomo de estado fundamental , [11] confirmando que tal estado de materia podría existir. [12] El experimento se realizó utilizando átomos de rubidio ultrafríos .
Estado de Quantum Hall
Un estado Hall cuántico da lugar a un voltaje Hall medido en la dirección perpendicular al flujo de corriente. Un estado Hall Hall de espín cuántico es una fase teórica que puede allanar el camino para el desarrollo de dispositivos electrónicos que disipan menos energía y generan menos calor. Esta es una derivación del estado de materia Quantum Hall.
Materia fotonica
La materia fotónica es un fenómeno en el que los fotones que interactúan con un gas desarrollan una masa aparente y pueden interactuar entre sí, incluso formando "moléculas" fotónicas. La fuente de masa es el gas, que es masivo. Esto contrasta con los fotones que se mueven en el espacio vacío, que no tienen masa en reposo y no pueden interactuar.
Dropleton
Una "niebla cuántica" de electrones y agujeros que fluyen entre sí e incluso se ondulan como un líquido, en lugar de existir como pares discretos. [13]
Estados de alta energia
Materia degenerada
Bajo una presión extremadamente alta, como en los núcleos de las estrellas muertas, la materia ordinaria experimenta una transición a una serie de estados exóticos de la materia conocidos colectivamente como materia degenerada , que son soportados principalmente por efectos mecánicos cuánticos. En física, "degenerado" se refiere a dos estados que tienen la misma energía y, por lo tanto, son intercambiables. La materia degenerada está respaldada por el principio de exclusión de Pauli , que evita dos fermiónicos.Partículas que ocupan el mismo estado cuántico. A diferencia del plasma normal, el plasma degenerado se expande poco cuando se calienta, porque simplemente no quedan estados de impulso. En consecuencia, las estrellas degeneradas colapsan en densidades muy altas. Las estrellas degeneradas más masivas son más pequeñas, porque la fuerza gravitacional aumenta, pero la presión no aumenta proporcionalmente.
La materia degenerada en electrones se encuentra dentro de las estrellas enanas blancas . Los electrones permanecen unidos a los átomos, pero pueden transferirse a los átomos adyacentes. La materia degenerada de neutrones se encuentra en las estrellas de neutrones . La gran presión gravitacional comprime los átomos con tanta fuerza que los electrones se ven obligados a combinarse con los protones a través de la desintegración beta inversa, lo que resulta en una conglomeración de neutrones superdensa. Normalmente, los neutrones libresfuera de un núcleo atómico se descompondrán con una vida media de poco menos de 15 minutos, pero en una estrella de neutrones, la descomposición es superada por la descomposición inversa. La materia degenerada en frío también está presente en planetas como Júpiter y en las enanas marrones aún más masivas., que se espera que tengan un núcleo con hidrógeno metálico . Debido a la degeneración, las enanas marrones más masivas no son significativamente más grandes. En los metales, los electrones pueden modelarse como un gas degenerado que se mueve en una red de iones positivos no degenerados.
Materia quark
En la materia fría regular, los quarks , partículas fundamentales de la materia nuclear, están confinados por la fuerza fuerte en los hadrones que constan de 2 a 4 quarks, como los protones y los neutrones. La materia de quark o la materia de cromodianámica cuántica (QCD) es un grupo de fases en las que se supera la fuerza fuerte y los quarks se deconfinan y se mueven libremente. Las fases de la materia de quark se producen a densidades o temperaturas extremadamente altas, y no hay formas conocidas de producirlas en equilibrio en el laboratorio; En condiciones normales, cualquier materia de quark formada inmediatamente sufre un deterioro radioactivo.
La materia extraña es un tipo de materia quark que se sospecha que existe dentro de algunas estrellas de neutrones cerca del límite de Tolman-Oppenheimer-Volkoff (aproximadamente 2–3 masas solares ), aunque no hay evidencia directa de su existencia. En materia extraña, parte de la energía disponible se manifiesta como quarks extraños , un análogo más pesado del quark down común . Puede ser estable en estados de menor energía una vez formado, aunque esto no se conoce.
El plasma de quarks y gluones es una fase de muy alta temperatura en la que los quarks se liberan y pueden moverse de forma independiente, en lugar de estar permanentemente unidos en partículas, en un mar de gluones , partículas subatómicas que transmiten la fuerza fuerte que une a los quarks. Esto es análogo a la liberación de electrones de los átomos en un plasma. Este estado es alcanzable brevemente en colisiones de iones pesados de energía extremadamente alta en aceleradores de partículas , y permite a los científicos observar las propiedades de los quarks individuales, y no solo teorizar. El plasma Quark-gluon se descubrió en el CERN en 2000. A diferencia del plasma, que fluye como un gas, las interacciones dentro de QGP son fuertes y fluyen como un líquido.
A densidades altas pero a temperaturas relativamente bajas, los quarks se teorizan para formar un líquido de quarks cuya naturaleza es actualmente desconocida. Forma una fase distinta de color-sabor bloqueado (CFL) en densidades aún más altas. Esta fase es superconductora para la carga de color. Estas fases pueden ocurrir en estrellas de neutrones, pero actualmente son teóricas.
Color de vidrio condensado
El condensado de vidrio coloreado es un tipo de materia que se cree que existe en los núcleos atómicos que viajan cerca de la velocidad de la luz. Según la teoría de la relatividad de Einstein, un núcleo de alta energía parece tener una longitud contraída o comprimida a lo largo de su dirección de movimiento. Como resultado, los gluones dentro del núcleo aparecen ante un observador estacionario como una "pared gluónica" que viaja cerca de la velocidad de la luz. A energías muy altas, la densidad de los gluones en esta pared se ve que aumenta enormemente. A diferencia del plasma de quark-gluón producido en la colisión de tales paredes, el condensado de vidrio coloreado describe las paredes en sí mismas, y es una propiedad intrínseca de las partículas que solo se puede observar en condiciones de alta energía, como las de RHIC y posiblemente en el Gran Colisionador de Hadrones también.
Estados de muy alta energia
Varias teorías predicen nuevos estados de la materia a energías muy altas. Un estado desconocido ha creado la asimetría bariónica en el universo, pero se sabe poco al respecto. En la teoría de cuerdas , se predice una temperatura Hagedorn para las supercuerdas a aproximadamente 10 30 K, donde las supercuerdas se producen copiosamente. A la temperatura de Planck (10 32 K), la gravedad se convierte en una fuerza significativa entre las partículas individuales. Ninguna teoría actual puede describir estos estados y no se pueden producir con ningún experimento previsible. Sin embargo, estos estados son importantes en cosmología porque el universo puede haber pasado por estos estados en el Big Bang .
La singularidad gravitacional predicha por la relatividad general que existe en el centro de un agujero negro noes una fase de la materia; no es un objeto material en absoluto (aunque la energía de masa de la materia contribuyó a su creación), sino una propiedad del espacio-tiempo en una ubicación. Se podría argumentar, por supuesto, que todas las partículas son propiedades del espacio-tiempo en una ubicación, [14] dejando una nota de controversia sobre el tema.
Otros estados propuestos
Supersólido
Un supersólido es un material ordenado espacialmente (es decir, un sólido o cristal) con propiedades superfluidas. Similar a un superfluido, un supersólido es capaz de moverse sin fricción pero conserva una forma rígida. Aunque un supersólido es un sólido, exhibe tantas propiedades características diferentes de otros sólidos que muchos sostienen que es otro estado de la materia. [15]
Líquido
En un líquido de cuerdas, los átomos tienen una disposición aparentemente inestable, como un líquido, pero siguen siendo consistentes en el patrón general, como un sólido. Cuando se encuentran en un estado sólido normal, los átomos de la materia se alinean en un patrón de cuadrícula, de modo que el giro de cualquier electrón es lo opuesto al giro de todos los electrones que lo tocan. Pero en un líquido de red de cuerdas, los átomos están dispuestos en algún patrón que requiere que algunos electrones tengan vecinos con el mismo giro. Esto da lugar a propiedades curiosas, además de apoyar algunas propuestas inusuales sobre las condiciones fundamentales del universo mismo.
Superglass
Una superglass es una fase de la materia caracterizada, al mismo tiempo, por la superfluidez y una estructura amorfa congelada.










No hay comentarios:
Publicar un comentario