Los bolafifilos (también conocidos como surfactantes bolaform , bolafilos o surfactantes tipo alfa-omega ) son moléculas anfifílicas que tienen grupos hidrófilos en ambos extremos de una cadena de hidrocarburos hidrófobossuficientemente larga . En comparación con los anfifilos de cabeza simple , la introducción de un segundo grupo de cabezas generalmente induce una mayor solubilidad en agua, un aumento en la concentración crítica de micelas(cmc), y una disminución en el número de agregación. Las morfologías agregadas de las bolaanfifilas incluyen esferas, cilindros, discos y vesículas. También se sabe que los bolafifilos forman estructuras helicoidales que pueden formar auto-ensamblajes microtubulares monocapa.
La ecuación de Butler-Volmer (llamada así en honor a John Alfred Valentine Butler [1] y Max Volmer ), también conocida como Erdey-Grúz –Volmer , es una de las relaciones más fundamentales en la cinética electroquímica. Describe cómo la corriente eléctrica en un electrodo depende del potencial del electrodo, considerando que tanto una reacción catódica como anódica ocurren en el mismo electrodo : [2]
o en una forma más compacta:
dónde:
- : densidad de corriente del electrodo , A / m 2(definida como j = I / S )
- : densidad de corriente de intercambio , A / m 2
- : potencial de electrodo , V
- : potencial de equilibrio, V
- : temperatura absoluta , K
- : número de electrones involucrados en la reacción del electrodo
- : Constante de faraday
- : constante de gas universal
- : denominado coeficiente de transferencia de carga catódica , adimensional.
- : denominado coeficiente de transferencia de carga anódica, adimensional.
- : sobrepotencial de activación (definido como).
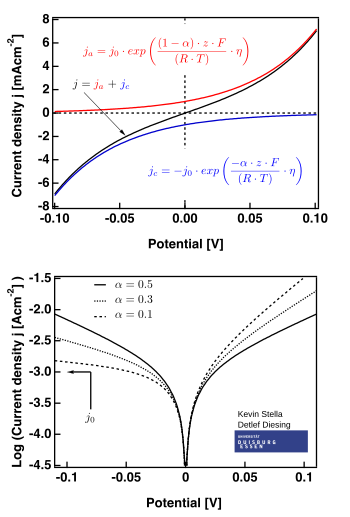
La figura de la derecha muestra las parcelas válidas para .
De control de transferencia de masa [ editar ]
La forma anterior de la ecuación de Butler-Volmer es válida cuando la reacción del electrodo está controlada por la transferencia de carga eléctrica en el electrodo (y no por la transferencia de masa hacia o desde la superficie del electrodo desde o hacia el electrolito a granel). Sin embargo, la utilidad de la ecuación de Butler-Volmer en electroquímica es amplia, y a menudo se considera que es "central en la cinética fenomenológica de los electrodos". [3]
En la región de la corriente limitante , cuando el proceso del electrodo está controlado por transferencia de masa, el valor de la densidad de corriente es:
dónde:
- D eff es el coeficiente de difusión efectivo (teniendo en cuenta la tortuosidad , si corresponde);
- δ es el espesor de la capa de difusión;
- c * es la concentración de las especies electroactivas (limitantes) en la mayor parte del electrolito.
La forma más general de la ecuación de Butler-Volmer, aplicable a las condiciones influenciadas por la transferencia de masa, se puede escribir como: [4]
dónde:
- j es la densidad de corriente, A / m 2 ,
- c o y c r se refieren a la concentración de la especie a oxidar y reducir, respectivamente,
- c (0, t) es la concentración dependiente del tiempo en la distancia cero de la superficie.
La forma anterior se simplifica a la convencional (que se muestra en la parte superior del artículo) cuando la concentración de la especie electroactiva en la superficie es igual a la del volumen.
Los casos limitantes [ editar ]
- la región de sobrepotencial bajo (llamada "resistencia de polarización", es decir, cuando E ≈ E eq ), donde la ecuación de Butler-Volmer se simplifica a:
- ;
- la región de alto sobrepotencial, donde la ecuación de Butler-Volmer se simplifica a la ecuación de Tafel :
- para una reacción catódica, cuando E << E eq , o
- para una reacción anódica, cuando E >> E eq
dónde y son constantes (para una reacción y temperatura dadas) y se llaman constantes de la ecuación de Tafel. Los valores teóricos de las constantes de la ecuación de Tafel son diferentes para los procesos anódico y catódico. Sin embargo, la pendiente de Tafel Puede ser definido como:
dónde es la corriente faradaica, expresada como , siendo y Las corrientes parciales catódicas y anódicas, respectivamente.
Los sensores de capacitancia (o sensores dieléctricos) usan la capacitancia para medir la permitividad dieléctrica de un medio circundante. La configuración es como la sonda de neutrones donde se instala un tubo de acceso de PVC en el suelo; las sondas también pueden ser modulares (como un peine) y conectarse a un registrador. El cabezal sensor consta de un circuito oscilador, la frecuencia está determinada por un electrodo anular, un condensador de efecto marginal., y la constante dieléctrica del suelo. Cada sensor de condensador consta de dos anillos metálicos montados en la placa de circuito a cierta distancia de la parte superior del tubo de acceso. Estos anillos son un par de electrodos, que forman las placas del capacitor con el suelo actuando como dieléctrico en el medio. Las placas están conectadas a un oscilador, que consiste en un inductor y un condensador. El campo eléctrico oscilante se genera entre los dos anillos y se extiende hacia el medio del suelo a través de la pared del tubo de acceso. El condensador y el oscilador forman un circuito, y los cambios en la constante dieléctrica de los medios circundantes se detectan mediante cambios en la frecuencia de operación. Los sensores de capacitancia están diseñados para oscilar en exceso de 100 MHz dentro del tubo de acceso en aire libre.
Aplicaciones [ editar ]
- Una aplicación para este tipo de dispositivo es medir el contenido de agua del suelo , donde el volumen de agua en el volumen total del suelo influye más en la permitividad dieléctrica del suelo porque el dieléctrico del agua (80) es mucho mayor que los otros constituyentes de El suelo (suelo mineral: 4, materia orgánica: 4, aire: 1). Cuando la cantidad de agua cambia en el suelo, una sonda medirá un cambio en la capacitancia debido al cambio en la permitividad dieléctrica que se puede correlacionar directamente con un cambio en el contenido de agua. Los sensores de capacitancia ahora se utilizan ampliamente en la programación de riegoen la agricultura en todo el mundo. [ cita requerida ]
- Control de curado de materiales compuestos : los sensores dieléctricos o de capacitancia se utilizan para medir la respuesta eléctrica de las resinas termoestables y las matrices de los materiales compuestos a una profundidad específica sobre la superficie del sensor. El modelo clave involucrado en el uso de estos sensores es el modelo de campo eléctrico. La correspondencia entre las propiedades eléctricas del material dentro del campo y la medición (es decir, la capacitancia) es fundamental para interpretar las lecturas del sensor dieléctrico. [ cita requerida ]
- Medición del aclaramiento de la punta en pruebas de turbomáquinas. [1]
- Los sensores de capacitancia también se pueden usar para medir el nivel de algunos materiales sólidos en estructuras tales como tolvas o silos.
la afinidad química es la propiedad electrónica por la cual especies químicasdiferentes son capaces de formar compuestos químicos . [1] La afinidad química también puede referirse a la tendencia de un átomo o compuesto a combinarse por reacción química con átomos o compuestos de composición diferente.
Historia [ editar ]
Teorías tempranas [ editar ]
La idea de afinidad es extremadamente antigua. Se han hecho muchos intentos para identificar sus orígenes. [2]Sin embargo, la mayoría de estos intentos, excepto de manera general, terminan en futilidad ya que las "afinidades" se encuentran en la base de toda la magia , por lo tanto, anteriores a la ciencia . [3] Sin embargo, la química física fue una de las primeras ramas de la ciencia en estudiar y formular una "teoría de la afinidad". El nombre affinitas fue utilizado por primera vez en el sentido de la relación química por el filósofo alemán Albertus Magnus cerca del año 1250. Más tarde, aquellos como Robert Boyle , John Mayow , Johann Glauber ,Isaac Newton y Georg Stahl expusieron ideas sobre la afinidad electiva en los intentos de explicar cómo se desarrolla el calor durante las reacciones de combustión . [4]
El término afinidad se ha usado figurativamente desde c. 1600 en discusiones sobre relaciones estructurales en química, filología , etc., y la referencia a la "atracción natural" es de 1616. "Afinidad química", históricamente, se ha referido a la " fuerza " que causa reacciones químicas . [5] así como, más generalmente, y más temprano, la "tendencia a combinar" de cualquier par de sustancias. La definición general, utilizada generalmente a lo largo de la historia, es que la afinidad química es aquella en la que las sustancias entran o resisten la descomposición. [2]
El término moderno afinidad química es una variación un tanto modificada de su precursor del siglo dieciocho "afinidad electiva" o atracciones electivas, un término que fue utilizado por el profesor de química del siglo XVIII William Cullen. [6] Si Cullen acuñó la frase no está claro, pero su uso parece ser anterior a la mayoría de los demás, aunque se extendió rápidamente por toda Europa, y fue utilizado en particular por el químico sueco Torbern Olof Bergman en todo su libro De attractionibus electivis (1775) . La mayoría de los químicos utilizaron las teorías de afinidad de una forma u otra desde alrededor de mediados del siglo XVIII hasta el siglo XIX para explicar y organizar las diferentes combinaciones en las cuales las sustancias podían ingresar y de las cuales se podían recuperar.[7] [8] Antoine Lavoisier , en su célebre Traité Élémentaire de Chimie (Elementos de química) de1789, se refiere al trabajo de Bergman y discute el concepto de afinidades o atracciones electivas.
Según el historiador de química Henry Leicester, el influyente libro de texto de 1923 Termodinámica y la energía libre de las reacciones químicas de Gilbert N. Lewis y Merle Randall llevó a la sustitución del término "afinidad" por el término " energía libre " en gran parte del inglés. mundo de habla
Representaciones visuales [ editar ]
El concepto de afinidad estaba muy relacionado con la representación visual de sustancias en una tabla. La primera tabla de afinidad , basada en reacciones de desplazamiento , fue publicada en 1718 por el químico francés Étienne François Geoffroy . El nombre de Geoffroy es más conocido en relación con estas tablas de "afinidades" ( tables des rapports ), que se presentaron por primera vez a la Academia de Ciencias de Francia en 1718 y 1720, como se muestra a continuación:
Durante el siglo XVIII, se propusieron muchas versiones de la tabla, con importantes químicos como Torbern Bergman en Suecia y Joseph Black en Escocia, que se adaptaron para adaptarse a nuevos descubrimientos químicos. Todas las tablas fueron esencialmente listas, preparadas mediante el cotejo de observaciones sobre las acciones de sustancias una sobre otra, que muestran los diversos grados de afinidad exhibidos por cuerpos análogos para diferentes reactivos .
Fundamentalmente, la tabla era la herramienta gráfica central utilizada para enseñar química a los estudiantes y su disposición visual a menudo se combinaba con diagramas de otros tipos. Joseph Black, por ejemplo, usó la tabla en combinación con diagramas quiasticos y de anillos para visualizar los principios centrales de la afinidad química. [11] Las tablas de afinidad se utilizaron en toda Europa hasta principios del siglo XIX cuando fueron desplazadas por los conceptos de afinidad introducidos por Claude Berthollet .
Las concepciones modernas [ editar ]
En física química y química física , la afinidad química es la propiedad electrónica por la cual especies químicasdiferentes son capaces de formar compuestos químicos . [1] La afinidad química también puede referirse a la tendencia de un átomo o compuesto a combinarse por reacción química con átomos o compuestos de composición diferente.
En términos modernos, relacionamos la afinidad con el fenómeno por el cual ciertos átomos o moléculas tienen la tendencia a agregarse o unirse. Por ejemplo, en el libro de 1919, el médico George W. Carey de Chemistry of Human Life afirma que "la salud depende de una cantidad adecuada de fosfato de hierro Fe 3 (PO 4 ) 2 en la sangre, ya que las moléculas de esta sal tienen afinidad química por Oxigeno y llevarlo a todas partes del organismo ". En este contexto anticuado, la afinidad química se encuentra a veces como sinónimo del término "atracción magnética". Muchos escritos, hasta aproximadamente 1925, también se refieren a una "ley de afinidad química".
Ilya Prigogine resumió el concepto de afinidad y dijo: "Todas las reacciones químicas llevan al sistema a un estado de equilibrio en el que las afinidades de las reacciones se desvanecen".
Termodinámica [ editar ]
La presente IUPAC definición es que la afinidad A es el negativo derivada parcial de energía libre de Gibbs G con respecto a la extensión de la reacción ξ en constante presión y temperatura . [12] Es decir,
En 1923, el matemático y físico belga Théophile de Donder derivó una relación entre la afinidad y la energía libre de Gibbs de una reacción química . A través de una serie de derivaciones, de Donder demostró que si consideramos una mezcla de especies químicas con la posibilidad de una reacción química, se puede demostrar que la siguiente relación es válida:
Con los escritos de Théophile de Donder como precedente, Ilya Prigogine y Defay in Chemical Thermodynamics(1954) definieron la afinidad química como la tasa de cambio del calor de reacción Q ' no compensado como la variable de progreso de la reacción o la extensión de la reacción ξ crece infinitesimalmente:
Esta definición es útil para cuantificar los factores responsables tanto del estado de los sistemas de equilibrio (donde A = 0 ) como de los cambios del estado de los sistemas de no equilibrio (donde A ≠ 0 ).
![{\ displaystyle j = j_ {0} \ cdot \ left \ {\ exp \ left [{\ frac {\ alpha _ {\ rm {a}} zF} {RT}} (E-E _ {\ rm {eq} }) \ right] - \ exp \ left [- {\ frac {\ alpha _ {\ rm {c}} zF} {RT}} (E-E _ {\ rm {eq}}) \ right] \ right \ }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f04ada917b1e46ab7d26da3300b2f080d9fd591a)
![{\ displaystyle j = j_ {0} \ cdot \ left \ {\ exp \ left [{\ frac {\ alpha _ {a} zF \ eta} {RT}} \ right] - \ exp \ left [- {\ frac {\ alpha _ {c} zF \ eta} {RT}} \ right] \ right \}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/90c978bf8f380997d326539e24955e0ba8bd3123)














![{\ displaystyle j = j_ {0} \ left \ {{\ frac {c _ {\ rm {o}} (0, t)} {c _ {\ rm {o}} ^ {*}}} \ exp \ left [{\ frac {\ alpha _ {\ rm {a}} zF \ eta} {RT}} \ right] - {\ frac {c _ {\ rm {r}} (0, t)} {c _ {\ rm {r}} ^ {*}}} \ exp \ left [- {\ frac {\ alpha _ {\ rm {c}} zF \ eta} {RT}} \ right] \ right \}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2ba8cdc412ace94d2b8bd614a0c34bf817cca666)














No hay comentarios:
Publicar un comentario