Las proteínas complejas de antena bacteriana son los componentes principales que absorben la luz en las bacterias fotosintéticas . [1] También conocido como complejo / sistema de captación de luz , el complejo de antenas bacterianas es responsable de la transferencia de energía solar al centro de reacción fotosintética . [2]
Las bacterias fotosintéticas Inall tienen características similares. Consisten en pigmentos que absorben la luz que están asociados no covalentemente con proteínas integrales en el caso de las bacterias fotosintéticas de color púrpura y las cianobacterias, o están presentes en los clorosomas en el caso de las bacterias fotosintéticas de color verde. [3] [4] Los pigmentos que absorben la luz en los clorosomas no se asocian con proteínas integrales para el ensamblaje. [3] Las bacterias fotosintéticas verdes y púrpuras utilizan diferentes moléculas de bacterioclorofila, mientras que las cianobacterias contienen clorofila, los pigmentos que absorben la luz que se encuentran en las plantas. [4] [3] [2] Bacterias fotosintéticas de color púrpura , particularmente acidopilia de Rhodopseudomonosde bacterias púrpuras sin azufre, ha sido uno de los principales grupos de organismos utilizados para estudiar complejos de antenas bacterianas, por lo que se sabe mucho sobre los componentes fotosintéticos de este grupo.

En las bacterias fotosintéticas púrpuras [ editar ]
En las bacterias púrpura fotosintéticas, generalmente hay dos complejos de antenas que generalmente están compuestos por dos tipos de polipéptidos (cadenas alfa y beta). [6] [7] [2] Estas proteínas están dispuestas en forma de anillo creando un cilindro que se extiende por la membrana; Las proteínas se unen a dos o tres tipos de moléculas de bacterioclorofila (BChl) y diferentes tipos de carotenoides según la especie. [6] [7] LH2 es el complejo de antena externa que se extiende por la membrana. Es periférico a LH1, un complejo de antenas (también conocido como complejo de antenas centrales) que está directamente asociado con el centro de reacción. [2] [5] [8]A diferencia de los complejos de LH1, la cantidad de complejos de LH2 presentes varía con las condiciones de crecimiento y la intensidad de la luz. [2]
Tanto la cadena alfa como la beta de los complejos de antenas son pequeñas proteínas de 42 a 68 residuos que comparten una organización de tres dominios. Se componen de un dominio citoplásmico hidrófilo N-terminal seguido de una región transmembrana y un dominio periplásmico hidrófilo C-terminal . En la región transmembrana de ambas cadenas hay una histidina conservada que probablemente esté involucrada en la unión del átomo de magnesio de un grupo de bacterioclorofila. Las cadenas beta contienen una histidina conservada adicional que se encuentra en la extremidad C-terminal del dominio citoplásmico y que también se cree que está involucrada en la unión de bacterioclorofila.
El ambiente químico particular de las moléculas de Bchl influye en la longitud de onda de la luz que son capaces de absorber. [2] [8] Los complejos de LH2 de R. acidophils tienen moléculas de BChl a que absorben a 850 nm y 800 nm respectivamente. [2] [8] Las moléculas de BChl a que absorben a 850 nm están presentes en un ambiente hidrofóbico. [2] [8] Estos pigmentos están en contacto con una serie de residuos hidrófobos no polares. [8] BChl unas moléculas que absorben a 800 nm están presentes en un entorno relativamente polar. [2] [8]El término N formulado del polipéptido alfa, una histidina cercana y una molécula de agua son responsables de esto.
La bacteriorrodopsina es una proteína utilizada por Archaea , especialmente por halobacterias , una clase de Euryarchaeota . [1] Actúa como una bomba de protones ; es decir, captura la energía de la luz y la utiliza para mover protones a través de la membrana fuera de la célula. [2] El gradiente de protones resultante se convierte posteriormente en energía química.
Estructura [ editar ]
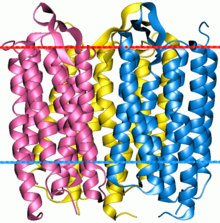
La bacteriorrodopsina es una proteína de membrana integral que generalmente se encuentra en parches cristalinos bidimensionales conocidos como " membrana púrpura ", que pueden ocupar hasta casi el 50% del área de la superficie de la célula arqueal. El elemento de repetición de la red hexagonal está compuesto por tres cadenas de proteínas idénticas, cada una girada 120 grados con respecto a las otras. Cada cadena tiene siete hélices alfa transmembrana y contiene una molécula de retina profundamente enterrada en su interior, la estructura típica de las proteínas de retinilideno .
Función [ editar ]
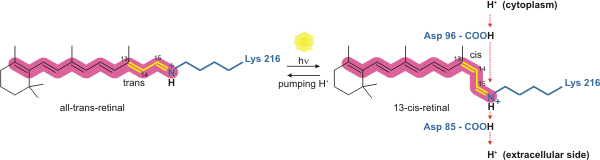
Bacteriorhodopsin es una bomba de protones impulsada por la luz. Es la molécula retiniana que cambia su conformación al absorber un fotón , lo que resulta en un cambio conformacional de la proteína circundante y la acción de bombeo de protones. [4] Está covalentemente unido a Lys216 en el cromóforo por la base de Schiff.acción. Después de la fotoisomerización de la molécula retiniana, Asp85 se convierte en un aceptor de protones del protón donante de la molécula retiniana. Esto libera un protón de un "sitio de retención" en el lado extracelular (EC) de la membrana. La reprotonación de la molécula retiniana por Asp96 restaura su forma isomerizada original. Esto da lugar a un segundo protón que se libera al lado de la CE. Asp85 libera su protón en el "sitio de retención", donde puede comenzar un nuevo ciclo.
La molécula de bacteriorrodopsina es de color púrpura y es más eficiente para absorber la luz verde (longitud de onda 500-650 nm , con el máximo de absorción a 568 nm). La bacteriorrodopsina tiene un amplio espectro de excitación. Para una longitud de onda de detección entre 700 y 800 nm, tiene una emisión detectada apreciable para longitudes de onda de excitación entre 470 nm y 650 nm (con un pico a 570 nm). [7] Cuando se bombea a 633 nm, el espectro de emisión tiene una intensidad apreciable entre 650 nm y 850 nm. [8]
La bacteriorrodopsina pertenece a las rodopsinas microbianas . Tienen similitudes con las rodopsinas de vertebrados , los pigmentos que detectan la luz en la retina . Las rodopsinas también contienen retina; sin embargo, las funciones de la rodopsina y la bacteriorrodopsina son diferentes, y existe una similitud limitada en sus secuencias de aminoácidos . Tanto la rodopsina como la bacteriorrodopsina pertenecen a la familia de proteínas del receptor 7TM , pero la rodopsina es un receptor acoplado a la proteína G y la bacteriorrodopsina no. En el primer uso de la cristalografía electrónica para obtener una estructura proteica de nivel atómico., la estructura de la bacteriorrodopsina se resolvió en 1990 [9] . Luego se usó como plantilla para construir modelos de receptores acoplados a proteínas G antes de que también estuvieran disponibles estructuras cristalográficas para estas proteínas . Se ha estudiado en exceso tanto en mica [10] [11] como en sustratos de vidrio utilizando microscopía de fuerza atómica y cristalografía de femtosegundos [12] .
Muchas proteínas tienen homología con la bacteriorrodopsina, incluida la bomba de cloruro impulsada por la luz, la halorodopsina (por la que también se conoce la estructura cristalina), y algunos canales directamente activados por la luz como la canalropsopsina .
Todos los demás sistemas fototróficos en bacterias, algas y plantas usan clorofilas o bacterioclorofilas en lugar de bacteriorrodopsinas. Estos también producen un gradiente de protones, pero de una manera bastante diferente y más indirecta que involucra una cadena de transferencia de electrones que consiste en varias otras proteínas. Además, las clorofilas son ayudadas a capturar la energía luminosa mediante otros pigmentos conocidos como "antenas"; Estos no están presentes en los sistemas basados en bacteriorrodopsina. Es posible que la fototrofia evolucionara independientemente al menos dos veces, una en bacterias y una en arqueas.




No hay comentarios:
Publicar un comentario