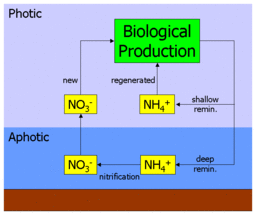
nueva producción está respaldada por entradas de nutrientes de fuera de la zona eufótica , especialmente el surgimiento de nutrientes de aguas profundas, pero también de fuentes terrestres y atmosféricas (como opuesto a la producción regenerada, que se apoya en el reciclaje de nutrientes en la zona eufótica). ). La nueva producción depende de los procesos de mezcla y advección vertical asociados con la circulación . [1]
La producción nueva y regenerada [ editar ]
El nitrógeno biodisponible se produce en el océano en varias formas, incluidas formas iónicas simples como nitrato (NO 3 - ), nitrito (NO 2 - ) y amonio (NH 4 + ), y formas orgánicas más complejas como la urea ((NH2 ) 2 CO). Estas formas son utilizadas por el fitoplancton autótrofo para sintetizar moléculas orgánicas como los aminoácidos (los componentes básicos de las proteínas ). El pastoreo de fitoplancton por zooplancton y organismos más grandes transfiere este nitrógeno orgánico a la cadena alimentaria y a toda la red alimentaria marina .
Cuando las moléculas orgánicas nitrogenadas son metabolizadas en última instancia por los organismos, se devuelven a la columna de agua como amonio (o moléculas más complejas que luego se metabolizan a amonio). Esto se conoce como regeneración, ya que el amonio puede ser utilizado por el fitoplancton y nuevamente ingresa a la red alimenticia. La producción primaria alimentada por amonio de esta manera se denomina producción regenerada.
Sin embargo, el amonio también se puede oxidar a nitrato (a través de nitrito), mediante el proceso de nitrificación. Esto se realiza por diferentes bacterias en dos etapas:
NH 3 + O 2 → NO 2 - + 3H + + 2e -
NO 2 - + H 2 O → NO 3 - + 2H + + 2e -
Fundamentalmente, se cree que este proceso solo ocurre en ausencia de luz (o como alguna otra función de profundidad). En el océano, esto conduce a una separación vertical de la nitrificación de la producción primaria, y la confina a la zona afótica . Esto conduce a la situación por la cual cualquier nitrato en la columna de agua debe provenir de la zona afótica y debe provenir de material orgánico transportado allí al hundirse. La producción primaria alimentada por nitrato es, por lo tanto, haciendo uso de una fuente de nutrientes "fresca" en lugar de una regenerada. La producción por nitrato se denomina así nueva producción. [2]
En resumen, la producción basada en nitrato consiste en utilizar moléculas de nutrientes recién llegadas desde fuera de la capa productiva, lo que se denomina nueva producción. La tasa de utilización de nitratos sigue siendo una buena medida de la nueva producción. Mientras que si la materia orgánica se come, respira y el nitrógeno se excreta como amoníaco, su posterior absorción y reincorporación a la materia orgánica por el fitoplancton se denomina producción reciclada (o regenerada). La tasa de utilización de amoníaco es, en el mismo sentido, una medida de producción reciclada. [3]
El uso de 15 compuestos de N permite medir las fracciones de nitrógeno nuevo y nitrógeno regenerado asociado con la producción primaria en el mar.
La acidificación del océano es la disminución en curso en el pH de la Tierra 's océanos , causada por la absorción de dióxido de carbono ( CO
2 ) de la atmósfera . [2] El agua de mar es ligeramente básica (es decir, pH> 7), y la acidificación del océano implica un cambio hacia condiciones de pH neutro en lugar de una transición a condiciones ácidas (pH <7 font="" nbsp="">[3] Se calcula que entre el 30 y el 40% del dióxido de carbono de la actividad humana liberada en la atmósfera se disuelve en océanos, ríos y lagos. [4] [5] Para lograr el equilibrio químico.Algunos de ellos reaccionan con el agua para formar ácido carbónico . Algunas de las moléculas deácido carbónico resultantes se disocian en un ion bicarbonato y un ion hidrógeno, aumentando así la acidez del océano ( concentración de ion H + ). Entre 1751 y 1996, se estima que el pH de la superficie del océano ha disminuido de aproximadamente 8.25 a 8.14, [6] lo que representa un aumento de casi el 30% en la concentración de iones de H + en los océanos del mundo. [7] [8] Los Modelos del Sistema Terrestre proyectan que, alrededor de 2008, la acidez del océano superó los análogos históricos [9] y, en combinación con otros biogeoquímicos del océano.cambios, podrían socavar el funcionamiento de los ecosistemas marinos e interrumpir la provisión de muchos bienes y servicios asociados con el océano a partir de 2100. [10]
2 ) de la atmósfera . [2] El agua de mar es ligeramente básica (es decir, pH> 7), y la acidificación del océano implica un cambio hacia condiciones de pH neutro en lugar de una transición a condiciones ácidas (pH <7 font="" nbsp="">[3] Se calcula que entre el 30 y el 40% del dióxido de carbono de la actividad humana liberada en la atmósfera se disuelve en océanos, ríos y lagos. [4] [5] Para lograr el equilibrio químico.Algunos de ellos reaccionan con el agua para formar ácido carbónico . Algunas de las moléculas deácido carbónico resultantes se disocian en un ion bicarbonato y un ion hidrógeno, aumentando así la acidez del océano ( concentración de ion H + ). Entre 1751 y 1996, se estima que el pH de la superficie del océano ha disminuido de aproximadamente 8.25 a 8.14, [6] lo que representa un aumento de casi el 30% en la concentración de iones de H + en los océanos del mundo. [7] [8] Los Modelos del Sistema Terrestre proyectan que, alrededor de 2008, la acidez del océano superó los análogos históricos [9] y, en combinación con otros biogeoquímicos del océano.cambios, podrían socavar el funcionamiento de los ecosistemas marinos e interrumpir la provisión de muchos bienes y servicios asociados con el océano a partir de 2100. [10]
Se cree que el aumento de la acidez tiene un rango de consecuencias potencialmente dañinas para los organismos marinos, como la disminución de las tasas metabólicas y las respuestas inmunitarias en algunos organismos, y el decoloramiento de los corales . [11] Al aumentar la presencia de iones de hidrógeno libres, el ácido carbónico adicional que se forma en los océanos finalmente produce la conversión de iones de carbonato en iones de bicarbonato. La alcalinidad delocéano (aproximadamente igual a [HCO 3 - ] + 2 [CO 32− ]) no se modifica por el proceso, o puede aumentar durante largos períodos de tiempo debido a la disolución del carbonato . [12] Esta disminución neta en la cantidad de carbonato.los iones disponibles pueden dificultar la formación de carbonato de calcio biogénicoen los organismos calcificantes marinos, como el coraly algo del plancton , y tales estructuras se vuelven vulnerables a la disolución. [13] La acidificación continua de los océanos puede amenazar las futuras cadenas alimentarias relacionadas con los océanos. [14] [15] Como miembros del Panel InterAcademy , 105 academias de ciencias han emitido una declaración sobre la acidificación de los océanos recomendando que para 2050, las emisiones globales de CO 2 se reduzcan al menos en un 50% en comparación con el nivel de 1990. [dieciséis]
Si bien la acidificación continua de los océanos es de origen al menos parcialmente antropogénico , ha ocurrido anteriormente en la historia de la Tierra. [17] El ejemplo más notable es el máximo térmico del Paleoceno-Eoceno(PETM), [18] que ocurrió hace aproximadamente 56 millones de años cuando cantidades masivas de carbono entraron en el océano y la atmósfera, y llevaron a la disolución de sedimentos carbonatados en todo el océano. cuencas
La acidificación de los océanos se comparó con el cambio climático antropogénico y se denominó "gemela malvada del calentamiento global " [19] [20] [21] [22] [23] y "el otro problema del CO
2 ". [20] [22] [24] Los cuerpos de agua dulce también parecen estar acidificándose, aunque este es un fenómeno más complejo y menos obvio. [25] [26]
2 ". [20] [22] [24] Los cuerpos de agua dulce también parecen estar acidificándose, aunque este es un fenómeno más complejo y menos obvio. [25] [26]
El ciclo del carbono [ editar ]
El ciclo del carbono describe los flujos de dióxido de carbono ( CO
2 ) entre los océanos,la biosferaterrestre, lalitosfera, [27] y laatmósfera. Las actividades humanas, como lacombustióndecombustibles fósilesyloscambios en eluso del suelo, han llevado a un nuevo flujo deCO
2en la atmósfera. Alrededor del 45% ha permanecido en la atmósfera; la mayor parte del resto ha sido absorbida por los océanos, [28] y algunos son absorbidos por plantas terrestres. [29]
2 ) entre los océanos,la biosferaterrestre, lalitosfera, [27] y laatmósfera. Las actividades humanas, como lacombustióndecombustibles fósilesyloscambios en eluso del suelo, han llevado a un nuevo flujo deCO
2en la atmósfera. Alrededor del 45% ha permanecido en la atmósfera; la mayor parte del resto ha sido absorbida por los océanos, [28] y algunos son absorbidos por plantas terrestres. [29]
El ciclo del carbono implica tanto compuestos orgánicos como celulosa como compuestos de carbono inorgánico, como dióxido de carbono , ion carbonato y ion bicarbonato . Los compuestos inorgánicos son particularmente relevantes cuando se analiza la acidificación de los océanos, ya que incluyen muchas formas de CO disuelto
2 presentes en los océanos de la tierra. [31]
2 presentes en los océanos de la tierra. [31]
Cuando CO
2 se disuelve, reacciona con el agua para formar un equilibrio de especies químicas iónicas y no iónicas: dióxido de carbono libre disuelto (CO)
2 (aq)),ácido carbónico(H
2 CO
3 ),bicarbonato(HCO-
3 ) ycarbonato(CO2-
3 ). La proporción de estas especies depende de factores como latemperatura delagua demar, la presión y la salinidad (como se muestra en ungráfico de Bjerrum). Estas diferentes formas decarbono inorgánico disueltose transfieren de la superficie de un océano a su interior mediante labomba de solubilidaddel océano.
2 se disuelve, reacciona con el agua para formar un equilibrio de especies químicas iónicas y no iónicas: dióxido de carbono libre disuelto (CO)
2 (aq)),ácido carbónico(H
2 CO
3 ),bicarbonato(HCO-
3 ) ycarbonato(CO2-
3 ). La proporción de estas especies depende de factores como latemperatura delagua demar, la presión y la salinidad (como se muestra en ungráfico de Bjerrum). Estas diferentes formas decarbono inorgánico disueltose transfieren de la superficie de un océano a su interior mediante labomba de solubilidaddel océano.
La resistencia de un área del océano a la absorción de CO atmosférico.
2 se conoce como elfactor de Revelle.
2 se conoce como elfactor de Revelle.
Acidificación [ editar ]
Disolviendo CO
2 en agua de mar aumenta elion dehidrógeno(H+
) concentración en el océano, y por lo tanto disminuye el pH del océano, de la siguiente manera: [32]
2 en agua de mar aumenta elion dehidrógeno(H+
) concentración en el océano, y por lo tanto disminuye el pH del océano, de la siguiente manera: [32]
Caldeira y Wickett (2003) [2] ubicaron la velocidad y la magnitud de los cambios en la acidificación moderna de los océanos en el contexto de probables cambios históricos durante los últimos 300 millones de años.
Desde que comenzó la revolución industrial , el océano ha absorbido alrededor de un tercio del CO
2 que hemos producido desde entonces [33] y se estima que el pH de la superficie del océano ha disminuido en poco más de 0,1 unidades en laescalalogarítmicadel pH, lo que representa un aumento de aproximadamente el 29% enH+
. Se espera que disminuya en otras 0,3 a 0,5 unidades de pH [10] (una duplicación adicional para triplicar las concentraciones de ácido postindustrial de hoy ) para 2100 a medida que los océanos absorben más CO antropogénico.
2 , siendo los impactos más severos paralos arrecifes de coraly elOcéano Austral. [2] [13] [34] Se predice que estos cambios se acelerarán a medida que másCOantropogénico
2 es liberado a la atmósfera y ocupado por los océanos. El grado de cambio en la química oceánica, incluido el pH oceánico, dependerá de lasvías demitigaciónyemisiones [35] adoptadas por la sociedad. [36]
2 que hemos producido desde entonces [33] y se estima que el pH de la superficie del océano ha disminuido en poco más de 0,1 unidades en laescalalogarítmicadel pH, lo que representa un aumento de aproximadamente el 29% enH+
. Se espera que disminuya en otras 0,3 a 0,5 unidades de pH [10] (una duplicación adicional para triplicar las concentraciones de ácido postindustrial de hoy ) para 2100 a medida que los océanos absorben más CO antropogénico.
2 , siendo los impactos más severos paralos arrecifes de coraly elOcéano Austral. [2] [13] [34] Se predice que estos cambios se acelerarán a medida que másCOantropogénico
2 es liberado a la atmósfera y ocupado por los océanos. El grado de cambio en la química oceánica, incluido el pH oceánico, dependerá de lasvías demitigaciónyemisiones [35] adoptadas por la sociedad. [36]
Aunque se esperan los mayores cambios en el futuro, [13] un informe de científicos de la NOAA encontró que grandes cantidades de agua no saturada en aragonita ya están surgiendo cerca del área de la plataforma continental del Pacífico de América del Norte. [1] Las plataformas continentales desempeñan un papel importante en los ecosistemas marinos, ya que la mayoría de los organismos marinos viven o se reproducen allí, y aunque el estudio solo abordó el área desde Vancouver hasta el norte de California , los autores sugieren que otras áreas de la plataforma pueden estar experimentando efectos similares. [1]
| Hora | pH | Cambio de pH relativo a preindustrial. | Fuente | Cambio en la concentración de H + en relación a preindustrial. |
|---|---|---|---|---|
| Preindustrial (siglo XVIII) | 8.179 | campo analizado[37] [ verificación fallida ] | ||
| Pasado reciente (década de 1990) | 8.104 | −0.075 | campo [37] | + 18.9% |
| Niveles actuales | ~ 8.069 | −0.11 | campo [7] [8] [38] [39] | + 28.8% |
| 2050 (2 × CO 2 = 560 ppm) | 7.949 | −0.230 | modelo[13] [ verificación fallida ] | + 69.8% |
| 2100 (IS92a) [40] | 7.824 | −0.355 | modelo[13] [ verificación fallida ] | + 126.5% |
Puntuar [ editar ]
| " | Si continuamos emitiendo CO 2 a la misma velocidad, en 2100 la acidez del océano aumentará en aproximadamente un 150 por ciento, una tasa que no se ha experimentado durante al menos 400,000 años. | ” |
| - Programa de investigación sobre acidificación de los océanos del Reino Unido, 2015 [41] | ||
Uno de los primeros conjuntos de datos detallados para examinar cómo varió el pH a lo largo de 8 años en una ubicación costera norte templadaespecífica encontró que la acidificación tenía fuertes vínculos con la dinámica de las especies bentónicas in situ y que la variación en el pH oceánico puede hacer que las especies calcáreas tengan un desempeño más pobre que el no calórico. Especie en años con pH bajo y predice las consecuencias para los ecosistemas bentónicos cercanos a la costa . [42] [43] Thomas Lovejoy El ex asesor jefe de biodiversidad del Banco Mundial, ha sugerido que "la acidez de los océanos se duplicará con creces en los próximos 40 años. Dice que esta tasa es 100 veces más rápida que cualquier cambio en la acidez de los océanos en los últimos 20 millones de años". por lo que es poco probable que la vida marina pueda adaptarse de alguna manera a los cambios ". [44] Se prevé que, para el año 2100, si los cambios biogeoquímicos coexistentes influyen en la entrega de bienes y servicios oceánicos, entonces también podrían tener un efecto considerable en el bienestar humano para aquellos que dependen en gran medida del océano para obtener alimentos, Empleos, e ingresos. [10] [45]
Las tasas actuales de acidificación oceánica se compararon con el evento de efecto invernadero en el límite Paleoceno-Eoceno (hace aproximadamente 55 millones de años) cuando las temperaturas de los océanos en la superficie aumentaron en 5 a 6 grados Celsius . No se observó ninguna catástrofe en los ecosistemas de superficie, sin embargo, los organismos que habitan el fondo en las profundidades del océano experimentaron una gran extinción. La acidificación actual está en un camino para alcanzar niveles más altos que los observados en los últimos 65 millones de años, [46] y la tasa de aumento es aproximadamente diez veces la tasa que precedió a la extinción en masa Paleoceno-Eoceno. La acidificación actual y proyectada ha sido descrita como un evento geológico casi sin precedentes. [47]Un estudio del Consejo Nacional de Investigación publicado en abril de 2010 también concluyó que "el nivel de ácido en los océanos está aumentando a un ritmo sin precedentes". [48] [49] Un artículo de 2012 en la revista Science examinó el registro geológico en un intento de encontrar un análogo histórico de las condiciones globales actuales, así como las del futuro. Los investigadores determinaron que la tasa actual de acidificación del océano es más rápida que en cualquier otro momento en los últimos 300 millones de años. [50] [51]
Una revisión realizada por científicos del clima en el blog RealClimate , de un informe de 2005 de la Royal Society of UK destacó de manera similar la centralidad de las tasas de cambio en el actual proceso de acidificación antropogénica, escribiendo: [52]
Solo en el período de 15 años comprendido entre 1995 y 2010, la acidez aumentó un 6 por ciento en los 100 metros superiores del Océano Pacífico, desde Hawai hasta Alaska. [53] Según una declaración realizada en julio de 2012 por Jane Lubchenco , directora de la Administración Nacional Oceánica y Atmosférica de los Estados Unidos, "las aguas superficiales están cambiando mucho más rápidamente de lo que sugieren los cálculos iniciales. Es otra razón para estar muy preocupado por la cantidad de el dióxido de carbono que está en la atmósfera ahora y la cantidad adicional que continuamos emitiendo ". [19]
Un estudio de 2013 afirmó que la acidez aumentaba a una velocidad 10 veces más rápida que en cualquiera de las crisis evolutivas en la historia de la Tierra. [54] En un informe de síntesis publicado en Science en 2015, 22 científicos marinos líderes afirmaron que el CO
2 de los combustibles fósiles quemados está cambiando la química de los océanos más rápidamente que en cualquier otro momento desde la Gran Muerte, El evento de extinción conocido más grave de la Tierra, enfatizando que el aumento de temperatura máximo de 2 ° C acordado por los gobiernos refleja un recorte de emisiones demasiado pequeño para evitar "impactos dramáticos" en los océanos del mundo, con el autor principal Jean-Pierre Gattuso remarcando que "El El océano ha sido considerado mínimamente en negociaciones climáticas anteriores. Nuestro estudio proporciona argumentos convincentes para un cambio radical en la conferencia de la ONU (en París) sobre el cambio climático ". [55]
2 de los combustibles fósiles quemados está cambiando la química de los océanos más rápidamente que en cualquier otro momento desde la Gran Muerte, El evento de extinción conocido más grave de la Tierra, enfatizando que el aumento de temperatura máximo de 2 ° C acordado por los gobiernos refleja un recorte de emisiones demasiado pequeño para evitar "impactos dramáticos" en los océanos del mundo, con el autor principal Jean-Pierre Gattuso remarcando que "El El océano ha sido considerado mínimamente en negociaciones climáticas anteriores. Nuestro estudio proporciona argumentos convincentes para un cambio radical en la conferencia de la ONU (en París) sobre el cambio climático ". [55]
La velocidad a la que se producirá la acidificación del océano puede verse influida por la velocidad del calentamiento de la superficie del océano, porque los equilibrios químicos que rigen el pH del agua de mar dependen de la temperatura. [56] El mayor calentamiento del agua de mar podría llevar a un cambio más pequeño en el pH para un aumento dado de CO 2 . [56]
Calcificación [ editar ]
Descripción general [ editar ]
Los cambios en la química oceánica pueden tener efectos directos e indirectos extensos sobre los organismos y sus hábitats. Una de las repercusiones más importantes del aumento de la acidez del océano se relaciona con la producción de conchas y placas a partir de carbonato de calcio ( CaCO
3 ). [34] Este proceso se llama calcificación y es importante para la biología y la supervivencia de una amplia gama de organismos marinos. La calcificación implica laprecipitaciónde iones disueltos enCaCOsólido
3 estructuras, tales comococolitos. Una vez que se forman, dichas estructuras son vulnerables a ladisolución, amenos que el agua de mar circundante contengaconcentraciones desaturaciónde iones carbonato (CO32−).
3 ). [34] Este proceso se llama calcificación y es importante para la biología y la supervivencia de una amplia gama de organismos marinos. La calcificación implica laprecipitaciónde iones disueltos enCaCOsólido
3 estructuras, tales comococolitos. Una vez que se forman, dichas estructuras son vulnerables a ladisolución, amenos que el agua de mar circundante contengaconcentraciones desaturaciónde iones carbonato (CO32−).
Mecanismo [ editar ]
Del dióxido de carbono adicional agregado a los océanos, algunos permanecen como dióxido de carbono disuelto, mientras que el resto contribuye a producir bicarbonato adicional (y ácido carbónico adicional). Esto también aumenta la concentración de iones de hidrógeno, y el porcentaje de aumento en el hidrógeno es mayor que el porcentaje de aumento de bicarbonato, [57] creando un desequilibrio en la reacción HCO 3 - ⇌ CO 3 2− + H + . Para mantener el equilibrio químico, algunos de los iones de carbonato que ya se encuentran en el océano se combinan con algunos de los iones de hidrógeno para producir más bicarbonato. Por lo tanto, la concentración de iones carbonato en el océano se reduce, creando un desequilibrio en la reacción Ca 2+ + CO 32−⇌ CaCO 3 , y realizando la disolución del CaCO formado.
3 estructuras más probables.
3 estructuras más probables.
El aumento en las concentraciones de dióxido de carbono disuelto y bicarbonato, y la reducción de carbonato, se muestran en una gráfica de Bjerrum .
Estado de saturación [ editar ]
El estado de saturación (conocido como) del agua de mar para un mineral es una medida del potencial termodinámico para que el mineral se forme o se disuelva, y para el carbonato de calcio se describe mediante la siguiente ecuación:
Aquí Ω es el producto de las concentraciones (o actividades ) de los iones que reaccionan que forman el mineral ( Ca 2+
y CO 2-
3 ), dividido por el producto de las concentraciones de los iones cuando el mineral está en equilibrio( K
sp ), es decir, cuando el mineral no se forma ni se disuelve. [58] En el agua de mar, se forma un límite horizontal natural como resultado de la temperatura, la presión y la profundidad, y se conoce como el horizonte de saturación. [34] Por encima de este horizonte de saturación, Ω tiene un valor mayor que 1, yCaCO
3 no se disuelve fácilmente. La mayoría de los organismos calcificantes viven en tales aguas. [34] Por debajo de esta profundidad, Ω tiene un valor menor que 1, yCaCO
3 se disolverán. Sin embargo, si su tasa de producción es lo suficientemente alta como para compensar la disolución,CaCO
3 aún puede ocurrir donde Ω es menor que 1. Laprofundidad de compensación de carbonato seproduce en la profundidad en el océano donde la producción se supera con la disolución. [59]
y CO 2-
3 ), dividido por el producto de las concentraciones de los iones cuando el mineral está en equilibrio( K
sp ), es decir, cuando el mineral no se forma ni se disuelve. [58] En el agua de mar, se forma un límite horizontal natural como resultado de la temperatura, la presión y la profundidad, y se conoce como el horizonte de saturación. [34] Por encima de este horizonte de saturación, Ω tiene un valor mayor que 1, yCaCO
3 no se disuelve fácilmente. La mayoría de los organismos calcificantes viven en tales aguas. [34] Por debajo de esta profundidad, Ω tiene un valor menor que 1, yCaCO
3 se disolverán. Sin embargo, si su tasa de producción es lo suficientemente alta como para compensar la disolución,CaCO
3 aún puede ocurrir donde Ω es menor que 1. Laprofundidad de compensación de carbonato seproduce en la profundidad en el océano donde la producción se supera con la disolución. [59]
La disminución en la concentración de CO 3 2− disminuye Ω, y por lo tanto hace que CaCO
3 disoluciones más probables.
3 disoluciones más probables.
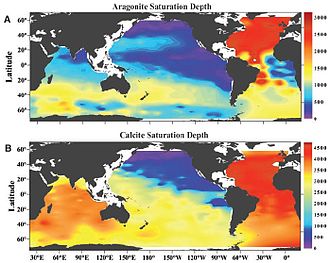
El carbonato de calcio se produce en dos polimorfos comunes (formas cristalinas): aragonita y calcita . La aragonita es mucho más soluble que la calcita, por lo que el horizonte de saturación de aragonita siempre está más cerca de la superficie que el horizonte de saturación de calcita. [34] Esto también significa que los organismos que producen aragonita pueden ser más vulnerables a los cambios en la acidez del océano que los que producen calcita. [13] Aumento de CO
2 niveles y el menor pH resultante del agua de mar disminuye el estado de saturación deCaCO
3 y eleva los horizontes de saturación de ambas formas más cerca de la superficie. [60] Se cree que esta disminución en el estado de saturación es uno de los principales factores que conducen a una disminución de la calcificación en organismos marinos, como la precipitación inorgánica deCaCO
3 es directamente proporcional a su estado de saturación.
2 niveles y el menor pH resultante del agua de mar disminuye el estado de saturación deCaCO
3 y eleva los horizontes de saturación de ambas formas más cerca de la superficie. [60] Se cree que esta disminución en el estado de saturación es uno de los principales factores que conducen a una disminución de la calcificación en organismos marinos, como la precipitación inorgánica deCaCO
3 es directamente proporcional a su estado de saturación.





![{\ displaystyle {\ Omega} = {\ frac {\ left [{\ ce {Ca ^ 2 +}} \ right] \ left [{\ ce {CO3 ^ 2 -}} \ right]} {K_ {sp} }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0422ec8bbb280ae8547a20d486b928b0c21846f4)
No hay comentarios:
Publicar un comentario