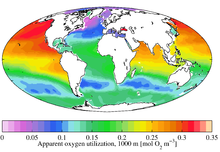
En sistemas de agua dulce o marinos , la utilización aparente de oxígeno ( AOU ) es la diferencia entre la solubilidad del gas oxígeno (es decir, la concentración en saturación) y la concentración de oxígenomedida en agua con las mismas propiedades físicas y químicas. [1] Tales diferencias ocurren típicamente cuando la actividad biológica actúa para cambiar la concentración ambiental de oxígeno. Por ejemplo, la producción primaria libera oxígeno y aumenta su concentración, mientras que la respiración lo consume y disminuye su concentración.
En consecuencia, el AOU de una muestra de agua representa la suma de la actividad biológica que la muestra ha experimentado desde que estuvo en equilibrio con la atmósfera . En sistemas de aguas poco profundas (p. Ej., Lagos ), la columna de agua completa generalmente está en contacto cercano con la atmósfera, y las concentraciones de oxígeno suelen estar cerca de la saturación, y los valores de AOU están cerca de cero. En sistemas de aguas profundas (por ejemplo, océanos), el agua puede estar fuera de contacto con la atmósfera durante períodos de tiempo extremadamente largos (años, décadas, siglos) y los valores de AOU positivos grandes son típicos. En ocasiones, cuando la producción primaria cerca de la superficie ha elevado las concentraciones de oxígeno por encima de la saturación, es posible que se obtengan valores negativos de AOU (es decir, que el oxígeno no se haya utilizado por debajo de las concentraciones de saturación).
El agua de mar artificial ( abreviado ASW ) es una mezcla de sales minerales disueltas (y algunas veces vitaminas ) que simula el agua de mar . El agua de mar artificial se usa principalmente en biología marina y en acuarios marinos y de arrecifes , y permite la preparación fácil de medios apropiados para organismos marinos (incluidas algas , bacterias , plantas y animales ). Desde una perspectiva científica , el agua de mar artificial tiene la ventaja de ser reproducible.Sobre el agua de mar natural ya que es una fórmula estandarizada. El agua de mar sintética también se conoce como agua de mar artificial y agua de océano sustituto.
Ejemplo [ editar ]
Las tablas a continuación presentan un ejemplo de una preparación de agua de mar artificial (35.00 ‰ de salinidad) ideada por Kester, Duedall, Connors y Pytkowicz (1967). [1] La receta consiste en dos listas de sales minerales, la primera de las sales anhidras que se pueden pesar, la segunda de las sales hidratadas que se deben agregar al agua de mar artificial como solución.
| sal | Peso molecular | g kg −1 solución |
|---|---|---|
| Cloruro de sodio (NaCl) | 58,44 | 23.926 |
| Sulfato de sodio (Na 2 SO 4 ) | 142.04 | 4.008 |
| Cloruro de potasio (KCl) | 74.56 | 0.677 |
| El bicarbonato de sodio (NaHCO 3 ) | 84.00 | 0.196 |
| Bromuro de potasio (KBr) | 119.01 | 0.098 |
| Ácido bórico (H 3 BO 3 ) | 61.83 | 0.026 |
| Fluoruro de sodio (NaF) | 41.99 | 0.003 |
| sal | Peso molecular | mol kg −1 solución |
|---|---|---|
| El cloruro de magnesio (MgCl 2 .6H 2 O) | 203.33 | 0.05327 |
| Cloruro de calcio (CaCl 2 .2H 2 O) | 147.03 | 0.01033 |
| Cloruro de estroncio (SrCl 2 .6H 2 O) | 266.64 | 0.00009 |
Si bien todos los compuestos enumerados en la receta anterior son sales minerales e inorgánicas , algunas recetas de agua de mar artificial, como Goldman y McCarthy (1978), [2] utilizan soluciones de trazas de vitaminaso compuestos orgánicos .
Estándar [ editar ]
La Norma Internacional para hacer agua de mar artificial se puede encontrar en ASTM International . [3] La norma actual se denomina ASTM D1141-98 (la norma original era ASTM D1141-52) y describe la práctica estándar para la preparación de agua de mar sustituta.
Usos [ editar ]
Existen diversas aplicaciones para el agua de mar sintética ASTM D1141-98, incluidos estudios de corrosión , calibración de instrumentos oceánicos y procesamiento químico. [4] Normalmente, el agua de laboratorio se usa cuando se hacen sales sintéticas.
El Transecto Meridional del Atlántico (abreviado como AMT ) es un programa oceanográfico de varias décadas que realiza investigaciones biológicas, químicas y físicas durante los viajes anuales entre el Reino Unido y los destinos en el Atlántico Sur. El programa AMT en curso se inició en 1995 para evaluar los procesos biológicos en el Océano Atlántico desde la mesoescala hasta la escala de la cuenca . Una de las primeras actividades del programa fue la calibración de mediciones y productos producidos por el sensor satelital SeaWiFS (1997-2010) para clorofila oceánica .
El programa AMT está dirigido por el Laboratorio Marino de Plymouth , con el apoyo del Centro Nacional de Oceanografía . Actualmente está financiado por el Consejo de Investigación de Medio Ambiente Natural (NERC). Desde su inicio en 1995, el programa ha realizado 26 cruceros de investigación con 256 científicos procedentes de 22 países. [1] El programa AMT ha proporcionado datos para más de 300 publicaciones arbitradas , [2] , así como 75 tesis doctorales . [1]
La ruta de crucero de regreso del programa AMT opera entre el Reino Unido en el Atlántico Norte y las Islas Falkland , Chile o Sudáfrica en el hemisferio sur, y su distancia total puede ser de hasta 13,000 kilómetros (8,100 mi). [3] La pista atraviesa varias provincias biogeoquímicas , incluidos los sistemas de crecimiento ecuatorial y templado productivo , y los giros oligotróficos del océano Atlántico norte y sur . En el muestreo de esta diversa gama de ecosistemas planctónicos. Los cruceros del programa AMT brindan un conjunto de datos consistente en una escala espacial amplia y juegan un papel importante en la comprensión del ciclo del carbono oceánico .
El bacterioplancton se refiere al componente bacteriano del plancton que se desplaza en la columna de agua. El nombre proviene de la palabra griega antigua πλανκτος ( planktos ), que significa "vagabundo" o "vagabundo", y bacteria , un término latino acuñado en el siglo XIX por Christian Gottfried Ehrenberg . Se encuentran tanto en el agua de mar y de agua dulce .
El bacterioplancton ocupa una variedad de nichos ecológicos en los ecosistemas marinos y acuáticos. Ambos son productores primarios y consumidores primarios en estos ecosistemas e impulsan el ciclo biogeoquímico global de elementos esenciales para la vida (por ejemplo, carbono y nitrógeno). Muchas especies de bacterioplancton son autótrofas y derivan energía de la fotosíntesis o la quimiosíntesis . El bacterioplancton fotosintético a menudo se clasifica como picophytoplankton , e incluye los principales grupos de cianobacteriascomo Prochlorococcus y Synechococcus . Otros bacterioplancton heterotróficos son saprotróficos., y obtener energía al consumir material orgánico producido por otros organismos. Este material se puede disolver en el medio y tomar directamente de allí, o las bacterias pueden vivir y crecer en asociación con material particulado como la nieve marina . El bacterioplancton juega un papel crítico en la fijación global de nitrógeno , nitrificación , desnitrificación , remineralización y metanogénesis .
La abundancia de bacterioplancton depende de variables ambientales como la temperatura, la disponibilidad de nutrientes y la depredación. Al igual que otros pequeños plancton, el bacterioplancton es presa del zooplancton(generalmente protozoos ), y su número también se controla a través de la infección por bacteriófagos .
Grupos principales [ editar ]
Fotosintética Bacterioplancton [ editar ]
El bacterioplancton fotosintético es responsable de una gran proporción de la producción primaria total de redes alimenticias acuáticas, que suministran compuestos orgánicos a niveles tróficos más altos. Estas bacterias se someten a fotosíntesis oxigenadas y anoxigénicas . Las diferencias entre estos procesos se pueden ver en los subproductos producidos, el donante de electrones primario y los pigmentos de captación de luz utilizados para la captura de energía.
Las cianobacterias son un gran grupo de bacterioplancton fotosintético, que a menudo crecen como células o en colonias filamentosas. [1] Estos organismos son el grupo dominante de bacterioplancton que utiliza la fotosíntesis oxigenada en los ecosistemas acuáticos. Las cianobacterias, junto con los eucariotas fotosintéticos, son responsables de aproximadamente la mitad del total de la producción primaria mundial [2],lo que los convierte en actores clave en la red alimentaria. Utilizan la fotosíntesis para generar energía en forma de compuestos orgánicos y producir oxígeno como un subproducto. [3] Los principales pigmentos de recolección de luz incluyen clorofilas , ficoerotina , ficocianina y carotenoides . [4]La mayoría de las cianobacterias que se encuentran en ambientes marinos están representadas por los géneros Synechococcus y Prochlorococcus . Synechococcus es cosmopolita, se ha reportado en aguas templadas y tropicales. [5] ElProchlorococcus es de tamaño muy pequeño y se encuentra principalmente en la zona eufótica de las aguas tropicales. [6] [7] Los factores que incluyen la luz, los nutrientes y la temperatura pueden hacer que las cianobacterias proliferen y formen floraciones dañinas. [8] Las floraciones de cianobacterias pueden causar hipoxia y producir altos niveles de toxinas, afectando a otros organismos acuáticos y causando enfermedades en los humanos.
Algunas cianobacterias son capaces de la fijación de nitrógeno . El género Anabaena utiliza células especializadas llamadas heterocistos para separar físicamente la fijación de nitrógeno y la fotosíntesis. [9]Trichodesmium es un ejemplo de cianobacterias que es capaz de fijar nitrógeno a través de una vía fotosintética alternativa. [10]
Otros bacterioplancton fotosintético, incluidas las bacterias púrpuras y verdes, se someten a la fotosíntesis anoxigénica en condiciones anaeróbicas. Los pigmentos sintetizados en estos organismos son sensibles al oxígeno. En las bacterias de color púrpura, los pigmentos principales incluyen la bacterioclorofila a y b y los carotenoides. Las bacterias verdes tienen diferentes pigmentos de recolección de luz que consisten en bacterioclorofila c, d y e. [1] Estos organismos no producen oxígeno a través de la fotosíntesis ni utilizan el agua como agente reductor. Muchos de estos organismos utilizan azufre, hidrógeno u otros compuestos como fuente de energía para impulsar la fotosíntesis. La mayoría de estos bacterioplancton se encuentran en aguas anóxicas, que incluyen ambientes estancados e hipersalinos. [11]
Bacterioplancton Heterotrófico [ editar ]
El bacterioplancton heterotrófico depende de la concentración disponible de materia orgánica disuelta en la columna de agua. Normalmente estos organismos son saprófitos, absorbiendo nutrientes de su entorno. Estos heterótrofos también desempeñan un papel clave en el bucle microbiano y en la remineralización de compuestos orgánicos como el carbono y el nitrógeno. Las pelagibacterales, también conocidas como miembros de un clade alfaproteobacterias, son los bacterioplancton más abundantes en los océanos. Los miembros de este grupo se encuentran en aguas con poca disponibilidad de nutrientes y son atacados por los protistas. [12] [13]
Los ciclos biogeoquímicos [ editar ]
Carbon [ editar ]
El carbono atmosférico es secuestrado en el océano por tres bombas principales que se conocen desde hace 30 años: la bomba de solubilidad , la bomba de carbonato y la bomba de carbono biológica (BCP). [14] La bomba de carbono biológica es una bomba de transmisión vertical impulsada principalmente por el hundimiento de partículas orgánicas ricas. El fitoplancton bacteriano cerca de la superficie incorpora CO 2 atmosférico y otros nutrientes en su biomasa durante la fotosíntesis. En el momento de su muerte, estos fitoplancton, junto con su carbono incorporado, se hunden en el fondo del océano, donde el carbono permanece por miles de años. [15]El otro secuestro de carbono mediado biológicamente en el océano ocurre a través de la bomba microbiana. La bomba microbiana es responsable de la producción de carbono orgánico disuelto recalcitrante (DOC) que tiene más de 100 años de antigüedad. [14] El plancton en el océano es incapaz de descomponer este DOC recalcitrante y, por lo tanto, permanece en los océanos durante miles de años sin ser respirado. Las dos bombas funcionan simultáneamente, y se cree que el equilibrio entre ellas varía según la disponibilidad de nutrientes. [16] En general, los océanos actúan como un sumidero de CO 2 atmosférico, pero también liberan un poco de carbono a la atmósfera. [17] Esto ocurre cuando el bacterioplancton y otros organismos en el océano consumen materia orgánica y respiran CO2 , y como resultado del equilibrio de solubilidad entre el océano y la atmósfera.
Nitrógeno [ editar ]
El ciclo del nitrógeno en los océanos está mediado por microorganismos, muchos de los cuales son bacterias, que realizan múltiples conversiones, tales como: fijación de nitrógeno , desnitrificación , asimilación y oxidación de amoníaco anaeróbico ( anammox ). Hay muchas estrategias diferentes de metabolismo del nitrógeno empleadas por el bacterioplancton. Comenzando con nitrógeno molecular en la atmósfera (N 2 ), que se fija con diazatrofos como el trichodesmio en formas utilizables como el amoníaco (NH 4 ). [18]Este amoníaco puede ser asimilado a la materia orgánica como los aminoácidos y los ácidos nucleicos, tanto por el plancton fotoautrófico como por el heterótrofo, y también puede ser nitrificado al NO 3 para la producción de energía por las bacterias nitrificantes. Finalmente, el uso de NO 3 o NO 2 como aceptadores de electrones terminales reduce el nitrógeno a N 2, que luego se libera nuevamente a la atmósfera, cerrando así el ciclo. [19] Otro proceso importante involucrado en la regeneración del N 2 atmosférico es el anammox. [19] [20]El Anammox, un proceso en el que el amoníaco se combina con nitrito para producir nitrógeno diatómico y agua, podría representar el 30-50% de la producción de N 2 en el océano. [20]
Materia orgánica disuelta [ editar ]
La materia orgánica disuelta (DOM) está disponible en muchas formas en el océano y es responsable de apoyar el crecimiento de bacterias y microorganismos en el océano. Las dos fuentes principales de esta materia orgánica disuelta son: descomposición de organismos de niveles tróficos superiores como plantas y peces, y en segundo lugar, DOM en escorrentías que atraviesan suelos con altos niveles de material orgánico. Es importante tener en cuenta que la edad y la calidad del DOM son importantes para su uso por parte de los microbios. [21] La mayoría de las DOM en los océanos es refractaria o semi-lábil y no está disponible para la biodegradación. [22]Como se mencionó anteriormente, la bomba microbiana es responsable de la producción de DOM refractario que no está disponible para la biodegradación y permanece disuelto en los océanos durante miles de años. [14]La rotación de material orgánico DOM lábil es bastante alta debido a la escasez, esto es importante para el soporte de múltiples niveles tróficos en la comunidad microbiana. [23] La captación y la respiración de DOM por los heterótrofos cierra el ciclo al producir CO 2.
Interacciones tróficas [ editar ]
Las variaciones en la abundancia de bacterioplancton son generalmente el resultado de la temperatura, el pastoreo de zooplancton y la disponibilidad de sustrato. [24] La abundancia y la productividad bacteriana están constantemente relacionadas con la abundancia y la productividad de las algas, así como con el carbono orgánico. Además, el fósforo influye directamente en la abundancia de algas y bacterias y, a su vez, las algas y las bacterias influyen directamente en la abundancia de cada uno [24] En entornos extremadamente oligotróficos, tanto el crecimiento de bacterias como de algas está limitado por el fósforo, pero como las bacterias son mejores competidoras, obtienen una mayor Parte del sustrato inorgánico y aumenta en abundancia más rápidamente que las algas.
En ambientes pelágicos marinos , los nano-flagelados heterótrofos son los consumidores más probables de la producción de células bacterianas. [25] Los flagelados cultivados en experimentos de laboratorio demuestran que están adaptados a la depredación de partículas del tamaño de una bacteria y se producen en concentraciones para controlar la biomasa bacteriana. [26] Se han encontrado estrechas fluctuaciones en el número de bacterias y flagelados en un estuario eutrófico , especialmente en el verano. [25] [27]La amplitud de estas fluctuaciones aumenta en respuesta a la eutrofización artificial con nutrientes inorgánicos y disminuye en respuesta a la depredación. Las pérdidas de bacterioplancton por pastoreo están indirectamente relacionadas con los balances de carbono y directamente relacionadas con los inhibidores procarióticos . [28] Un exceso de sustrato causaría un aumento de la biomasa flagelada, un aumento del pastoreo sobre el bacterioplancton y, por lo tanto, una disminución de la biomasa bacteriana en general. La depredación de ciliados es análoga a la depredación por flagelados en bacterias también.
Con el uso de inhibidores procarióticos de manera estacional, existe una relación positiva entre la abundancia bacteriana y las tasas de pastoreo heterotróficas de nanoplancton y se observó que solo el 40-45% de la producción de bacterioplancton se consume por Protozoa fagotrófico. [29] Además, los experimentos inhibitorios eucariotas muestran que el pastoreo de protozoos tiene un efecto positivo en la producción de bacterioplancton, lo que sugiere que la regeneración de nitrógeno por Protozoa podría ser muy importante para el crecimiento bacteriano. Los inhibidores eucariotas no demostraron ser útiles para determinar las tasas de pastoreo de protozoos en el bacterioplancton, sin embargo, pueden ayudar a comprender los mecanismos de control en la red alimentaria microbiana. [29]
Importancia ecológica [ editar ]
Bacterioplancton como las cianobacterias pueden tener brotes tóxicos en lagos eutróficos que pueden causar la muerte de muchos organismos como peces, aves, ganado, mascotas y seres humanos. [30] Algunos ejemplos de estas floraciones dañinas son la floración de Microcystis en el año 2000 en el estuario del río Swan, Australia, [31] y la Oostvaarderplassen en los Países Bajos en 2003. [32] Los efectos perjudiciales de estas flores pueden variar desde el corazón malformación en peces [33] para restringir la reproducción de copépodos. [34]
Las altas temperaturas causadas por la estacionalidad aumentan la estratificación y evitan la mezcla turbulenta vertical, lo que aumenta la competencia por la luz que favorece a las cianobacterias flotantes. [35] [36] Las temperaturas más altas también reducen la viscosidad del agua, lo que permite un movimiento más rápido, lo que también favorece las especies flotantes de cianobacterias. [30] Estas especies también son muy competitivas con la capacidad de crear una cubierta de superficie que impide que la luz alcance especies de plancton más profundas. [35] [37] [36]
Los estudios climáticos también indican que, con el aumento de las olas de calor, la probabilidad de floraciones cianobacterianas perjudiciales se convertirá en una amenaza para los sistemas de agua dulce eutróficos. [38] [39] [40] Otras implicaciones del aumento de la temperatura promedio del aire debido al cambio climático es que puede haber una expansión de la temporada de floración de cianobacterias, que se extiende desde principios de la primavera hasta más adelante en el otoño. [41]
Las estimaciones de la abundancia y densidad de bacterioplancton se pueden derivar con una variedad de métodos que incluyen recuentos directos, citometría de flujo y conclusiones extraídas de medidas metabólicas.
Además, como se discutió en la sección de ciclos biogeoquímicos, el plancton es responsable del reciclaje y movimiento de nutrientes esenciales (es decir, nitrógeno / carbono / DOM), que son bloques de construcción esenciales para muchos de los organismos que coexisten con el bacterioplancton en estos ecosistemas. Estos nutrientes reciclados pueden ser reutilizados por los productores primarios, lo que aumenta la eficiencia de la red alimentaria biológica y minimiza el desperdicio de energía.





No hay comentarios:
Publicar un comentario