La zona mínima de oxígeno ( OMZ ), a veces denominada zona de sombra , es la zona en la que la saturación de oxígeno en el agua de mar en el océano se encuentra en su nivel más bajo. Esta zona se encuentra a profundidades de aproximadamente 200 a 1,500 m (660–4,920 pies), según las circunstancias locales. Las ZMO se encuentran en todo el mundo, por lo general a lo largo de la costa occidental de los continentes, en áreas donde una interacción de procesos físicos y biológicos reduce simultáneamente la concentración de oxígeno (procesos biológicos) y restringe la mezcla de agua con las aguas circundantes (procesos físicos), creando una ”De agua donde las concentraciones de oxígeno caen del rango normal de 4 a 6 mg / l a menos de 2 mg / l.
Los procesos físicos y biológicos [ editar ]
Las aguas superficiales del océano generalmente tienen concentraciones de oxígeno cercanas al equilibrio con la atmósfera de la Tierra . En general, las aguas más frías contienen más oxígeno que las aguas más cálidas. A medida que el agua sale de la capa mixta hacia la termoclina , se expone a una lluvia de materia orgánica desde arriba. Las bacterias aeróbicas se alimentan de esta materia orgánica; El oxígeno se utiliza como parte del proceso metabólico bacteriano que reduce su concentración dentro del agua. Por lo tanto, la concentración de oxígeno en aguas profundas depende de la cantidad de oxígeno que tenía cuando estaba en la superficie menos el agotamiento de los organismos de aguas profundas.
El flujo descendente de materia orgánica disminuye considerablemente con la profundidad, con un 80–90% de consumo en los 1000 m (3,300 pies) superiores. Por lo tanto, el océano profundo tiene mayor oxígeno porque las tasas de consumo de oxígeno son bajas en comparación con el suministro de aguas profundas frías y ricas en oxígeno de las regiones polares. En las capas superficiales, el oxígeno se suministra por intercambio con la atmósfera. Las profundidades intermedias, sin embargo, tienen mayores tasas de consumo de oxígeno y menores tasas de suministro advectivo de aguas ricas en oxígeno. En gran parte del océano, los procesos de mezcla permiten el suministro de oxígeno a estas aguas (es decir, las aguas que forman parte de la circulación del giro subtropical impulsado por el viento se intercambian rápidamente con la superficie y nunca adquieren un fuerte déficit de oxígeno).
La distribución de las zonas mínimas de oxígeno en el océano abierto está controlada por la circulación oceánica a gran escala, así como por los procesos físicos y biológicos locales. Por ejemplo, el viento que sopla en paralelo a la costa causa el transporte de Ekman que brota de los nutrientes de las aguas profundas. El aumento de nutrientes apoya la proliferación de fitoplancton, el pastoreo de zooplancton y una red alimenticia productiva en general en la superficie. Los subproductos de estas floraciones y el subsiguiente pastoreo se hunden en forma de partículas y nutrientes disueltos (de fitodetritus, organismos muertos, pellets fecales, excreciones, cobertizos, escamas y otras partes). Esta "lluvia" de materia orgánica (ver la bomba biológica ) alimenta el bucle microbianoy puede provocar floraciones bacterianas en el agua debajo de la zona eufótica debido a la afluencia de nutrientes. [3] Dado que el oxígeno no se produce como un subproducto de la fotosíntesis por debajo de la zona eufótica, estos microbios agotan el oxígeno que contiene el agua al descomponer la materia orgánica que cae, creando así las condiciones de oxígeno más bajas. [2]
Los procesos físicos restringen la mezcla y aíslan esta agua con poco oxígeno del agua exterior. La mezcla vertical está restringida debido a la separación de la capa mezclada por la profundidad. La mezcla horizontal está limitada por la batimetría y los límites formados por las interacciones con los giros subtropicales y otros sistemas actuales importantes. [4] [5] [6] El agua con bajo contenido de oxígeno puede propagarse (por advección) desde áreas de alta productividad hasta estos límites físicos para crear un charco de agua estancado sin conexión directa a la superficie del océano, aunque (como en el Este del Pacífico Norte Tropical) puede haber relativamente poca materia orgánica que cae de la superficie.
La vida en la OMZ [ editar ]
A pesar de las bajas condiciones de oxígeno, los organismos han evolucionado para vivir dentro y alrededor de OMZ. Para aquellos organismos, como el calamar vampiro , se necesitan adaptaciones especiales para arreglárselas con menores cantidades de oxígeno o para extraer oxígeno del agua de manera más eficiente. Por ejemplo, el gigante mysid rojo ( Gnathophausia ingens ) continúa viviendo aeróbicamente (usando oxígeno) en OMZs. Tienen branquias muy desarrolladas con una gran área de superficie y una delgada distancia de difusión de sangre a agua que permite la eliminación efectiva del oxígeno del agua (hasta un 90% de eliminación de O 2del agua inhalada) y un sistema circulatorio eficiente con alta capacidad y alto contenido de sangre. concentración de una proteína ( hemocianina ) que se une fácilmente al oxígeno.[7] [8] [9]
Otra estrategia utilizada por algunas clases de bacterias en las zonas mínimas de oxígeno es usar nitrato en lugar de oxígeno, reduciendo así las concentraciones de este nutriente importante. Este proceso se llama desnitrificación . Las zonas mínimas de oxígeno desempeñan un papel importante en la regulación de la productividad y la estructura de la comunidad ecológica del océano global. [10] Por ejemplo, las colchonetas bacterianas gigantes que flotan en la zona mínima de oxígeno frente a la costa oeste de Sudamérica pueden jugar un papel clave en las pesquerías extremadamente ricas de la región, ya que se han encontrado allí esteras bacterianas del tamaño de Uruguay . [11] Modelos existentes del sistema terrestre.proyectar reducciones considerables de oxígeno y otras variables físico-químicas en el océano debido al cambio climático en curso, con posibles ramificaciones para los ecosistemas y las personas.
En biología acuática , la paradoja del plancton describe la situación en la que un rango limitado de recursos respalda a un rango inesperadamente amplio de especies de plancton , aparentemente burlando el principio de exclusión competitivaque sostiene que cuando dos especies compiten por el mismo recurso limitado, una será Impulsado a la extinción. La energía solar, la principal fuente de alimento del plancton, no es un recurso limitado. Nuestro sol es la fuente de energía más ilimitada en nuestro universo conocido, y el primer paso para todas y cada una de las formas de vida.
Paradoja ecológica [ editar ]
La paradoja del plancton resulta del choque entre la diversidad observada de plancton y el principio de exclusión competitiva , [1] también conocida como ley de Gause, [2] que establece que, cuando dos especies compiten por el mismo recurso limitado, en última instancia solo una. Persistirá y el otro será conducido a la extinción . La vida del fitoplancton es diversa en todos los niveles filogenéticos a pesar de la limitada gama de recursos (por ejemplo, luz, nitrato, fosfato, ácido silícico, hierro) por los que compiten entre sí.
La paradoja del plancton fue descrita originalmente en 1961 por G. Evelyn Hutchinson , quien propuso que la paradoja podría resolverse mediante factores tales como gradientes verticales de luz o turbulencia, simbiosis o comensalismo , depredación diferencial o condiciones ambientales en constante cambio. [3] Un trabajo más reciente ha propuesto que la paradoja puede resolverse mediante factores como: movimiento caótico de fluidos; [4] pastoreo selectivo por tamaño; [5] heterogeneidad espacio-temporal; [6] y las fluctuaciones ambientales. [7]De manera más general, algunos investigadores sugieren que los factores ecológicos y ambientales interactúan continuamente de modo que el hábitat planctónico nunca alcance un equilibrio por el cual se favorece a una sola especie. [8] En Mitchell et al. (2008), los investigadores encontraron que el análisis a pequeña escala de la distribución del plancton exhibía parches de agregación, del orden de 10 cm, que tenían vidas suficientes (> 10 minutos) para permitir el pastoreo, la competencia y la infección del plancton.
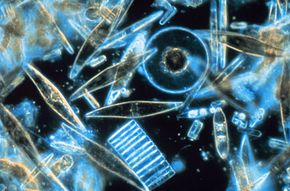
| Diatomeas | |
|---|---|
 | |
| Diatomeas marinas | |
| clasificación cientifica | |
| Dominio: | |
| (sin clasificar) | |
| Superphylum: | |
| Clase: | |
| Orden: |
Pennales
|
El orden Pennales es una subdivisión tradicional de las algas heterokontconocidas como diatomeas . [1] [2] El orden se nombra por la forma de las paredes celulares (o válvulas o frústulas) de las diatomeas de pennate , que se alargan en la vista de la válvula. Las válvulas pueden ser lineales u ovaladas, y generalmente tienen patrones ornamentales simétricos bilateralmente . Estos patrones se componen de una serie de líneas transversales (conocidas como estrías) que pueden aparecer como filas de puntos cuando se ven con un microscopio óptico. Algunas diatomeas de pennate también exhiben una fisura a lo largo de su eje longitudinal. Esto se conoce como rafe y está involucrado en los movimientos de deslizamiento realizados por las células de diatomeas; Las diatomeas móviles siempre poseen un rafe.
En términos de ciclo celular , las células vegetativas son diploides y se someten a mitosis durante la división celular normal . Periódicamente, la meiosis produce gametos haploides morfológicamente idénticos (isogametes), que se fusionan para producir un cigoto (a veces binucleado) que se convierte en una auxospora (a partir de la cual se producen células vegetativas de tamaño completo).
En algunos esquemas taxonómicos , [2] las diatomeas de pennate se dividen en dos grupos: diatomeas de pennate sin un rafe , conocidas como araphids (orden Fragilariophyceae), y las diatomeas de pennate con un rafe, conocidas como raphids (orden Bacillariophyceae).
El picoplancton fotosintético o picophytoplankton es la fracción del fitoplancton que realiza la fotosíntesiscompuesta por células entre 0.2 y 2 µm ( picoplancton ). Es especialmente importante en las regiones oligotróficascentrales de los océanos del mundo que tienen una concentración muy baja de nutrientes .
Historia [ editar ]
- 1952: Descripción de la primera especie verdaderamente picoplanctónica, Chromulina pusilla , por Butcher. [1]Esta especie cambió su nombre en 1960 a Micromonas pusilla [2] y algunos estudios han encontrado que es abundante en aguas oceánicas templadas, aunque existen muy pocos datos de cuantificación para el picofitoplancton eucariótico.
- 1979: descubrimiento de Synechococcus marino por Waterbury [3] y confirmación con microscopía electrónica por Johnson y Sieburth. [4]
- 1982: El mismo Johnson y Sieburth demuestran la importancia de los pequeños eucariotas mediante microscopía electrónica. [5]
- 1983: WK Li y Platt muestran que una gran fracción de la producción primaria marina se debe a organismos menores a 2 µm. [6]
- 1986: descubrimiento de "prochlorophytes" por Chisholm y Olson en el mar de los Sargazos, [7] nombrado en 1992 como Prochlorococcus marinus . [8]
- 1994: Descubrimiento en la laguna Thau en Francia del eucariota fotosintético más pequeño conocido hasta la fecha, Ostreococcus tauri , por los cortesanos. [9]
- 2001: a través de la secuenciación del gen de ARN ribosomal extraído de muestras marinas, varios equipos europeos descubren que el picoplancton eucariótico es muy diverso . [10] [11] Este descubrimiento siguió al primer descubrimiento de dicha diversidad eucariótica en 1998 por Rappe y sus colegas en la Universidad Estatal de Oregón, quienes fueron los primeros en aplicar la secuenciación de ARNr al plancton eucariótico en el océano abierto, donde descubrieron secuencias que parecían distantes del fitoplancton conocido [12]Las células que contenían ADN que coincidían con una de estas nuevas secuencias se visualizaron y analizaron con más detalle utilizando sondas específicas y se encontró que estaban ampliamente distribuidas. [13]
Métodos de estudio [ editar ]
Debido a su tamaño muy pequeño, el picoplancton es difícil de estudiar con métodos clásicos como la microscopía óptica. Se necesitan métodos más sofisticados.
- La microscopía de epifluorescencia permite a los investigadores detectar ciertos grupos de células que poseen pigmentos fluorescentes como el Synechococcus que posee ficoeritrina .
- La citometría de flujo mide el tamaño ("dispersión hacia delante") y la fluorescencia de 1,000 en 10,000 células por segundo. Permite determinar muy fácilmente la concentración de las diversas poblaciones de picoplancton en muestras marinas. Se pueden distinguir tres grupos de células ( Prochlorococcus , Synechococcus y picoeukaryotes). Por ejemplo, Synechococcus se caracteriza por la doble fluorescencia de sus pigmentos: naranja para ficoeritrina y rojo para clorofila . La citometría de flujo también permite a los investigadores clasificar poblaciones específicas (por ejemplo, Synechococcus ) para ponerlas en cultivo o realizar análisis más detallados.
- El análisis de pigmentos fotosintéticos como la clorofila o los carotenoides mediante cromatografía de alta precisión ( HPLC ) permite a los investigadores determinar los diversos grupos de algas presentes en una muestra.
- Técnicas de biología molecular :
- Clonación y secuenciación de genes como el ARN ribosomal , que permite a los investigadores determinar la diversidad total dentro de una muestra
- DGGE (electroforesis en gel desnaturalizante), más rápido que el enfoque anterior, permite a los investigadores tener una idea de la diversidad global dentro de una muestra
- La hibridación in situ ( FISH ) utiliza sondas fluorescentes que reconocen un taxón específico , por ejemplo, una especie , un género o una clase . [14] Esta descripción original como especie ahora se cree que está compuesta de varias especies crípticas diferentes , un hallazgo que ha sido confirmado por un proyecto de secuenciación del genoma de dos cepas liderado por investigadores del Instituto de Investigación del Acuario de la Bahía de Monterey . [15]
- La PCR cuantitativa se puede usar, como FISH, para determinar la abundancia de grupos específicos. Tiene la principal ventaja de permitir el análisis rápido de un gran número de muestras simultáneamente [16], pero requiere controles y calibraciones más sofisticados.
Composición [ editar ]
Tres grandes grupos de organismos constituyen el picoplancton fotosintético ...
- Las cianobacterias pertenecientes al género Synechococcus de un tamaño de 1 µm (micrómetro) se descubrieron por primera vez en 1979 por J. Waterbury [3] ( Woods Hole Oceanographic Institution ). Son bastante ubicuas, pero más abundantes en aguas relativamente mesotróficas .
- Las cianobacterias que pertenecen al género Prochlorococcus son particularmente notables. Con un tamaño típico de 0,6 µm, Prochlorococcus fue descubierto solo en 1988 [7] por dos investigadores estadounidenses, Sallie W. (Penny) Chisholm ( Instituto de Tecnología de Massachusetts ) y RJ Olson ( Institución Oceanográfica Woods Hole ). A pesar de su pequeño tamaño, este organismo fotosintético es sin duda el más abundante del planeta: de hecho, su densidad puede alcanzar hasta 100 millones de células por litro y se puede encontrar hasta una profundidad de 150 m en todo el cinturón intertropical. [17]
- Los eucariotas picoplanctónicos son los menos conocidos, como lo demuestra el reciente descubrimiento de grupos importantes. Andersen creó en 1993 una nueva clase de algas pardas, las Pelagophyceae . [18] Más sorprendente aún, el descubrimiento en 1994 [9] de un eucariota de tamaño muy pequeño, Ostreococcus tauri, que domina la biomasa fitoplanctónica de una laguna de agua salobre francesa (étang de Thau ), muestra que estos organismos también pueden desempeñar un papel ecológico importante. Papel en ambientes costeros. En 1999, se descubrió una nueva clase de alga, [19] las Bolidophyceae , genéticamente muy cerca de las diatomeas., pero bastante diferente morfológicamente. En la actualidad, se conocen cerca de 50 especies pertenecientes a varias clases.
-
-
Clases de algas que contienen especies de picoplancton Las clases Géneros picoplanctónicos Chlorophyceae Nannochloris Prasinophyceae Micromonas , Ostreococcus , Pycnococcus Prymnesiophyceae Imantonia Pelagophyceae Pelagomonas Bolidophyceae Bolidomonas Dictyochophyceae Florenciella
-
El uso de enfoques moleculares implementados desde la década de 1990 para las bacterias, se aplicó a los picoeukaryotes fotosintéticos solo 10 años después, alrededor del 2000. Revelaron una diversidad muy amplia [10] [11] y revelaron la importancia de los siguientes grupos en el picoplancton :
En ambientes costeros templados, el género Micromonas (Prasinophyceae) parece dominante. [14] Sin embargo, en numerosos entornos oceánicos, las especies dominantes de picoplancton eucariótico siguen siendo desconocidas. [20]
Ecología [ editar ]
- El Synechococcus cyanobacterium es generalmente abundante en ambientes mesotróficos , como cerca del afloramiento ecuatorial o en regiones costeras.
- El Prochlorococcus cyanobacterium lo reemplaza cuando las aguas se empobrecen en nutrientes (es decir, oligotróficos ). Por otro lado, en regiones templadas como el Océano Atlántico Norte, Prochlorococcus está ausente porque las aguas frías impiden su desarrollo.
- La diversidad de eucariotas se deriva de su presencia en una gran variedad de entornos. En las regiones oceánicas, a menudo se observan en profundidad, en la base de la capa bien iluminada (la capa "eufótica"). En las regiones costeras, ciertos tipos de picoeucariota como Micromonas dominan. Al igual que con el plancton más grande, su abundancia sigue un ciclo estacional con un máximo en verano.
Hace treinta años, se planteó la hipótesis de que la velocidad de división de los microorganismos en los ecosistemas oceánicos centrales era muy lenta, del orden de una semana o un mes por generación. Esta hipótesis fue apoyada por el hecho de que la biomasa (estimada, por ejemplo, por los contenidos de clorofila ) fue muy estable a lo largo del tiempo. Sin embargo, con el descubrimiento del picoplancton, se encontró que el sistema era mucho más dinámico de lo que se pensaba anteriormente. En particular, los pequeños depredadores.de un tamaño de unos pocos micrómetros que ingieren algas picoplanctónicas tan rápidamente como se produjeron se encontraron omnipresentes. Este extremadamente sofisticado sistema depredador-presa está casi siempre en equilibrio y da como resultado una biomasa de picoplancton casi constante. Esta estrecha equivalencia entre producción y consumo hace que sea extremadamente difícil medir con precisión la velocidad a la que gira el sistema.
En 1988, dos investigadores estadounidenses, Carpenter y Chang, sugirieron estimar la velocidad de la división celular del fitoplancton siguiendo el curso de la replicación del ADN mediante microscopía. Al reemplazar el microscopio por un citómetro de flujo , es posible seguir el contenido de ADN de las células de picoplancton a lo largo del tiempo. Esto permitió a los investigadores establecer que las células de picoplancton son altamente sincrónicas: replican su ADN y luego se dividen todas al mismo tiempo al final del día. Esta sincronización podría deberse a la presencia de un reloj biológico interno .
Genómica [ editar ]
En la década de 2000, la genómica permitió atravesar una etapa complementaria. La genómica consiste en determinar la secuencia completa del genoma de un organismo y en la lista de todos los genes presentes. Entonces es posible tener una idea de las capacidades metabólicas de los organismos objetivo y comprender cómo se adapta a su entorno. Hasta la fecha, se han determinado los genomas de varios tipos de Prochlorococcus [21] [22] y Synechococcus , [23] y de una cepa de Ostreococcus [24] . Los genomas completos de dos cepas de Micromonas diferentes revelaron que eran bastante diferentes (especies diferentes), y tenían similitudes con las plantas terrestres.[15] Varias otras cianobacterias y de pequeños eucariotas ( Bathycoccus ,Pelagomonas ) están bajo secuenciación. En paralelo, los análisis del genoma comienzan a realizarse directamente a partir de muestras oceánicas (ecogenómica o métagenómica), [25] lo que nos permite acceder a grandes conjuntos de genes para organismos no cultivados.
-
-
Genomas de cepas de picoplancton fotosintéticas
que se han secuenciado hasta la fechaGénero Tensión Centro de secuenciación Observación Prochlorococcus MED4 JGI SS120 Genoscopio MIT9312 JGI MIT9313 JGI NATL2A JGI CC9605 JGI Cc9901 JGI Synechococcus WH8102 JGI WH7803 Genoscopio RCC307 Génoscope CC9311 TIGR [26] Ostreococcus OTTH95 Genoscopio Micromonas RCC299 y CCMP1545 JGI
-




No hay comentarios:
Publicar un comentario