Formulación química inorgánica: combinaciones binarias del hidrógeno
1. Combinaciones binarias del hidrógeno
Son combinaciones de hidrógeno con otro elemento. Reciben el nombre de hidruros. Distinguimos dos tipos de hidruros:
1.1 Hidruros metálicos
Formados por la combinación de un metal con hidrógeno. Metal+H.
1.2 Hidruros metálicos
formados por la combinación de un no metal con hidrógeno. No metal + H ( no metal del grupo 16 y 17).
2. Hidruros metálicos
2.1 Nomenclatura tradicional
Se nombran escribiendo la palabra hidruro seguido del nombre del metal.
Ca → (valencia 2) + H → (valencia 1) = CaH2 → Hidruro de calcio
En la fórmula escribiremos en primer lugar el símbolo del elemento metálico. Si el metal presenta más de una valencia, procederemos igual que en los óxidos, vistos en la lección anterior.
Fe → valencia 2 y 3
H → valencia 1
H → valencia 1
Fe con valencia 3 → FeH3 → Hidruro Férrico
Fe con valencia 2 → FeH2 → Hidruro Ferroso
2.2 Nomenclatura de Stock
Seguiremos los mismos pasos que en los óxidos, vistos en la lección anterior.
CaH2 → Hidruro de calcio
FeH3 → Hidruro de hierro (III)
FeH2 → Hidruro de hierro (II)
2.3 Nomenclatura Sistemática
Al igual que el punto anterior seguiremos los mismos pasos que en los óxidos, visto en la lección anterior.
CaH2 → Dihidruro de calcio
FeH3 → Trihidruro de hierro
FeH2 → Dihidruro de hierro
3. Hidruros no metálicos
3.1 Nomenclatura tradicional
Se nombran escribiendo del nombre del no metal acabado en -uro seguido de hidrógeno. Se caracterizan porque el no metal actúa siempre con su menor valencia.
S → valencia 2, 4, 6
H2S → sulfuro de hidrógeno
H2S → sulfuro de hidrógeno
Cl → valencia 1, 3, 5, 7
HCl → cloruro de hidrógeno
HCl → cloruro de hidrógeno
Combinaciones binarias del hidrógeno
https://sites.google.com/site/quimicaenlinea3000/tarea
Las combinaciones del hidrógeno con metales se denominan hidruros, algunos ejemplos son:
Las combinaciones binarias del hidrógeno con oxígeno, nitrógeno, fósforo, arsénico, antimonio, carbono y silicio tienen nombres comunes:
Las combinaciones del hidrógeno con F, Cl, Br, I, S, Se y Se se denominan hidrácidos debido a que tales compuestos, al disolverse en agua, dan disoluciones ácidas.
FORMULACIÓN Y NOMENCLATURA: LAS COMBINACIONES BINARIAS DEL HIDRÓGENO
Se sabe que casi todos los elementos químicos son capaces de generar compuestos binarios con el hidrógeno, por lo que el número de estos compuestos, denominados hidruros, es tan elevado, y sus propiedades tan diferentes, que resulta casi imprescindible realizar algún tipo de clasificación que facilite su estudio, como la siguiente, basada en la distinta naturaleza del enlace que se establece entre el hidrógeno y el otro elemento:
HIDRUROS SALINOS E HIDRUROS METÁLICOS
A pesar de las diferentes propiedades de unos y otros, en cuanto a formulación y nomenclatura pueden tratarse de manera conjunta. Sea cual sea el elemento metálico, este siempre tiene una electronegatividad menor a la del hidrógeno, motivo por el cual el metal actúa con un número de oxidación positivo (I, II, III…) y el hidrógeno con su número de oxidación negativo (–I). Según esto:
Estos hidruros se nombran siguiendo la estrategia general de leer la fórmula de derecha a izquierda:
De esta manera podemos nombrar sin problemas los hidruros salinos, en los que el metal posee un número de oxidación único (I o II).
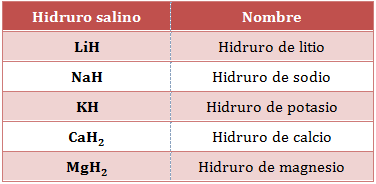
Fórmula y nombre de algunos hidruros salinos
Sin embargo, los metales pertenecientes a los bloques d y f suelen actuar conmás de un número de oxidación distinto, por lo que tiene que incluirse en el nombre información suficiente para poder distinguir los posibles hidruros:
Es importante recordar que esta información adicional solo debe incluirse cuando el metal posee más de un número de oxidación. Veamos algunos ejemplos:

Fórmula y nombre de algunos hidruros metálicos. Aquellos señalados con un asterisco no existen en la naturaleza como tales, aunque se proponen como ejemplo útil en la aplicación de las normas de formulación y nomenclatura.
Aunque aparecen como ejemplos en los libros de texto y en muchos ejercicios de formulación/nomenclatura no se conocen hidruros de los elementos de transición de los grupos 7, 8 y 9 (zona de inexistencia de hidruros, en la que se encuentran el Mn, el Fe y el Co) ni de algunos metales comunes, como Ni, Ag, Hg o Cd.
HIDRUROS MOLECULARES
Existen hidruros de todos los elementos del bloque p, metálicos o no metálicos, a excepción del bismuto y el polonio. Al formular y nombrar estos compuestos debemos tener en cuenta que en la secuencia según la cual se deben ordenar los elementos, el hidrógeno se encuentra entre los elementos del grupo 15 (la columna del nitrógeno) y los del grupo 16 (la columna del oxígeno). Por ello, la posición del hidrógeno varía de unos a otros:

En cuanto a su nomenclatura:
Unos ejemplos servirán para aclararlo:

Fórmula y nombre de algunos hidruros moleculares
¿Por qué en unos se añade prefijo multiplicador y en otros no? La clave está en las consideraciones que subyacen tras el orden de los elementos en la fórmula. En los hidruros de los grupos 13, 14 y 15 se asigna al hidrógeno el número de oxidación negativo, por ir situado el último en la fórmula. En consecuencia, el otro elemento debe actuar con un número de oxidación positivo y, dado que este puede ser distinto en cada elemento, debe especificarse de cuál se trata en cada caso. Sin embargo, en los hidruros de los grupos 16 y 17, el hidrógeno va en primer lugar y actúa con número de oxidación positivo, por lo que en este caso el otro elemento es el que actúa con un número de oxidación negativo, y resulta que este es único para cada elemento (–I para los elementos del grupo 17, los halógenos, y –II para los del 16, los calcógenos), por lo que no es necesario especificarlo de ninguna manera en el nombre.
HIDRUROS PROGENITORES E HIDRUROS DERIVADOS
Conviene mencionar que los nombres anteriores corresponden a lo que se denomina nomenclatura de composición, pues solo tiene en cuenta los elementos constituyentes y no la estructura del compuesto. En los hidruros moleculares también se puede emplear la nomenclatura de sustitución, inspirada en la nomenclatura orgánica, que permite ofrecer información sobre la estructura de compuestos derivados de hidruros, en los cuales los hidrógenos se han sustituido por otros elementos o grupos de elementos. Estos hidruros de los que derivan otros compuestos se denominan hidruros progenitores, y tienen asignados los siguientes nombres:

Nombres dados por la IUPAC a los hidruros progenitores
Con estos nombres la IUPAC pretende sustituir los nombres tradicionales que se han venido usando para algunos de estos hidruros (fosfina, arsina o estibina), salvo el de amoniaco, que sigue siendo un nombre aceptado (y ampliamente utilizado) para el NH3. Aunque podemos utilizarlos para referirnos a los respectivos hidruros, su uso está especialmente indicado para nombrar los compuestos derivados de ellos, como:
Disilano
¿Y qué ocurre con el H2O? Pues que su nombre común, científico, recomendado y usado siempre es ¡agua! No hay que darle más vueltas. Es más, si nos ponemos rigurosos ni siquiera debería seguir las normas de formulación propuestas para los hidruros, pues al tratarse de una combinación con oxígeno, debería, en todo caso, nombrarse como un óxido (óxido de hidrógeno). Pero no tiene sentido complicar las cosas, y solo habría que utilizar el nombre oxidano cuando se considere un hidruro progenitor del que derivan otros compuestos, como, por ejemplo, el dioxidano (más conocido como peróxido de hidrógeno o, con su nombre común, agua oxigenada):

Dioxidano
HIDRÁCIDOS
Cuando el hidrógeno se combina con alguno de los elementos no metálicos pertenecientes a los grupos 16 y 17 (calcógenos y halógenos) se obtienen hidruros volátiles que, al disolverse en agua, dan disoluciones de marcado carácter ácido, por lo que se conocen comúnmente como hidrácidos. La IUPAC acepta la nomenclatura tradicional para estos hidruros, especialmente cuando se encuentran en disolución:
 UNAS CONSIDERACIONES FINALES
Aunque la IUPAC denomina hidruros a todas las combinaciones binarias del hidrógeno, esto no debe asociarse a la existencia real del anión hidruro (H–) en el compuesto. En realidad, este anión solo puede considerarse que aparece en los hidruros salinos y, si acaso, en algunos hidruros metálicos (es decir, con los metales menos electronegativos). En estos hidruros el número de oxidación del hidrógeno es, efectivamente, –I.
Por otra parte, merece la pena analizar brevemente la naturaleza del enlace de algunos hidruros moleculares. En ellos, la posición del hidrógeno en la fórmula sigue un orden determinado que, aunque inspirado en el orden de electronegatividad creciente de los elementos, no coincide exactamente con este. Así, nos encontramos con situaciones como la que ocurre en el amoniaco, NH3, en el que el hidrógeno, al situarse en último lugar, parece tener una electronegatividad mayor que la del nitrógeno. Esto no es así, ya que en realidad es el nitrógeno el más electronegativo y, en consecuencia, el que tiene una mayor tendencia a atraer hacia sí los electrones, por lo que su número de oxidación sería negativo y el del hidrógeno positivo, al contrario de lo que indica su fórmula.
https://lidiaconlaquimica.wordpress.com/2016/08/04/formulacion-y-nomenclatura-las-combinaciones-binarias-del-hidrogeno/
|
No hay comentarios:
Publicar un comentario