Formulación química inorgánica: combinaciones binarias del oxígeno
1. Combinaciones binarias del oxígeno
Son combinaciones de oxígeno con otro elemento.
1.1 Según la nomenclatura tradicional
Óxidos: combinaciones de Oxígeno y un metal o de óxigeno y un no metal.
Para formularlos pondremos los símbolos de los elementos que se combinan e intercambiaremos sus valencias, simplificando siempre que sea posible.
Escribiremos siempre en primer lugar el elemento distinto al oxígeno.
Por ejemplo:
(Li → valencia 1) + (O → valencia 2) = Li2O → Óxido de Litio
(Ca → valencia 2) + (O → valencia 2) = Ca2O2→CaO→ Óxido de calcio
Se nombrarán escribiendo la palabra óxido seguido del nombre del metal.
Veamos las distintas opciones según las valencias:
a) Si el elemento que se combina con el oxígeno presenta dos valencias habrá que diferenciar las dos posibilidades.
Por ejemplo:
Fe→ valencia 2 y 3
O → valencia 2
O → valencia 2
Fe con valencia 3 → Fe2O3 → Óxido Férrico
Fe con valencia 2 → Fe2O2 → FeO → Óxido Ferroso
Escribiremos la palabra óxido seguido del nombre del metal acabado en -ico si actúa con su mayor valencia o acabado en
–oso si actúa con la menor de sus valencias.
–oso si actúa con la menor de sus valencias.
b) Si el elemento presenta tres valencias, procederemos de la siguiente manera:
Por ejemplo:
S→ valencia 2, 4 y 6
O→ valencia 2
O→ valencia 2
S con valencia 6 → S2O6 → SO3 → óxido Sulfúrico
S con valencia 4 → S2O4 → SO2 → óxido Sulfuroso
S con valencia 2 → S2O2 → SO → óxido Hiposulfuroso
Es decir, escribiremos la palabra óxido seguido del nombre del no metal acabado en -ico si actúa con su mayor valencia, en -oso si actúa con la valencia intermedia e hipo –oso si aparece la menor de todas.
c) Si el elemento presenta cuatro valencias actuaremos siguiendo este ejemplo:
Por ejemplo:
Cl→ valencias 1,3,5 y 7
O→ valencia 2
O→ valencia 2
Cl con valencia 7 → Cl2O7 → Óxido perclórico
Cl con valencia 5 → Cl2O5 → xido clórico
Cl con valencia 3 → Cl2O3 → óxido cloroso
Cl con valencia 1 → Cl2O → óxido hipocloroso
Así, escribiremos la palabra óxido seguido del nombre del no metal acabado en per -ico si actúa con su mayor valencia, -ico si actúa con la siguiente valencia, en –oso si actúa con la siguiente e hipo –oso si aparece con la menor de todas.
1.2 Nomenclatura de stock
La nomenclatura de stock nombra añadiendo a la palabra óxido el nombre del otro elemento:
Na2O → Óxido de sodio
Si el elemento tiene más de una valencia, ésta se indica en número romano entre paréntesis. Si esta es única no se indica.
Fe2O3 → Óxido de hierro (III)
FeO → Óxido de hierro (II)
SO3 → Óxido de azufre (VI)
(Observa que las fórmulas están simplificadas)
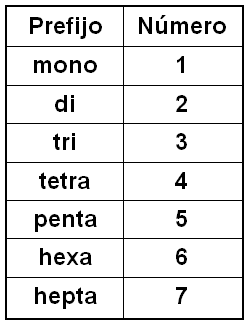
1.3 Nomenclatura sistemática
En la nomenclatura sistemática utiliza prefijos para describir la fórmula del compuesto:
Fe2O3 → Trióxido de dihierro
Formulación De Compuestos Inorgánicos Binarios
Una fórmula química es la representación simbólica de la molécula de un elemento químico. Las fórmulas están compuestas por símbolos, que representan a los elementos cuyos átomos entran a formar parte en el compuesto.El número de átomos de cada elemento se indica con subíndices.
Compuestos binarios
Son compuestos en los que intervienen dos elementos químicos diferentes. Para formular los compuestos binarios se escribe primero el metal y luego el no metal, mientras que para nombrarlos se invierten los términos.
Existen tres métodos de nomenclatura:
- Nomenclatura tradicional: requiere conocer la valencia de los elementos y la relación en que se combinan los átomos.
- Nomenclatura sistemática (IUPAC): utiliza los prefijos para indicar el número de átomos de cada elemento, sin requerir el conocimiento de las valencias.
- Nomenclatura de Stock: se indica con números romanos entre paréntesis la valencia del metal.
Combinaciones binarias del hidrógeno
El hidrógeno da lugar a las siguientes combinaciones binarias:
- Combinaciones con F, Cl, Br, I, S, Se y Te, denominadas hidrácidos.Su fórmula general es XnH. Se denominan con el nombre del elemento terminado en -uro seguido de «de hidrógeno».
Hidrácidos Compuesto Nombre sistemático Disolución acuosa HCI Cloruro de hidrógeno Ácido clorhídrico HI Yoduro de hidrógeno Ácido yodhídrico H2S Sulfuro de hidrógeno Ácido sulfhídrico - Combinaciones con otros no metales o hidruros no metálicos. Su fórmula general es XHn y tienen nombres específicos.
| Compuesto | Nombre común |
| NH3 | Amoníaco |
| PH3 | Fosfina |
| CH4 | Metano |
| Compuesto | Nombre sistemático | Nombre stock |
| NaH | Monohidruro de sodio | Hidruro de sodio |
| CaH2 | Dihidruro de calcio | Hidruro de calcio |
| CuH | Monohidruro de cobre | Hidruro de cobre (I) |
Combinaciones binarias del oxígeno
Los óxidos son la combinación de un elemento con el oxígeno. Si el elemento es un metal, son óxidos propiamente dichos. Si se trata de un no metal, reciben el nombre de anhídridos. Su fórmula general es X2On.
- Según la nomenclatura clásica, para nombrarlos se utiliza la expresión óxido seguida del nombre del elemento, al cual se le añadirá un sufijo u otro según la valencia con la que actúe.Por ejemplo, el cloro puede actuar con cuatro valencias (1, 3, 5, 7), por lo que puede formar los siguientes anhídridos:Cl2O Óxido de cloro (I)Cl2O3 Óxido de cloro (III)Cl2O5 Óxido de cloro (V)Cl2O7 Óxido de cloro (VII)Si el elemento sólo tiene dos valencias, se añade la terminación -ico cuando actúa con la mayor y -oso cuando actúa con la menor.
- Atendiendo a la nomenclatura de la IUPAC, se nombran con la expresión «óxido de» seguida del nombre del elemento. Si éste posee más de una valencia, se añadirá entre paréntesis y con números romanos el número de oxidación con el que actúa. Para el ejemplo del cloro, sería:Cl2O Óxido de dicloroCl2O3 Trióxido de dicloroCl2O5 Pentóxido de dicloroCl2O7 Heptaóxido de dicloro
| Compuesto | Nombre sistemático | Nombre stock |
| BaO | Monóxido de bario | Óxido de bario |
| Al2O3 | Trióxido de dialuminio | Óxido de aluminio |
| SO2 | Dióxido de azufre | Óxido de azufre (IV) |
| As2O3 | Trióxido de diarsénico | Óxido de arsénico (III) |
Sales binarias
Las sales binarias son la combinación de un metal con un no metal. Su fórmula general es AxBy. Para designarlas, se utiliza el nombre del no metal terminado en -uro, seguido del nombre del metal.
| Compuesto | Nombre sistemático | Nombre stock |
| NaCl | Cloruro de sodio | Cloruro de sodio |
| CaF2 | Difluoruro de calcio | Fluoruro de calcio |
http://www.hiru.eus/quimica/formulacion-de-compuestos-inorganicos-binarios
Para formularlos se escribe siempre, a la izquierda, el elemento más electropositivo, intercambiándose los números de oxidación del oxígeno (-2) y del otro elemento.
Algunos ejemplos son:
| Li2O | Óxido de litio | FeO | Óxido de hierro (II) |
| Cu2O | Óxido de cobre (I) | MgO | Óxido de magnesio |
| Cr2O3 | Óxido de cromo (III) | CaO | Óxido de calcio |
| Al2O3 | Óxido de aluminio | PbO2 | Óxido de plomo (IV) |
| SiO2 | Óxido de silicio | N2O3 | Óxido de nitrógeno (III) |
| N2O | Óxido de nitrógeno (I) | Cl2O5 | Óxido de cloro (V) |
No hay comentarios:
Publicar un comentario