Los gases y la Teoría Cinética: leyes de los gases
1. Ley de Boyle-Mariotte
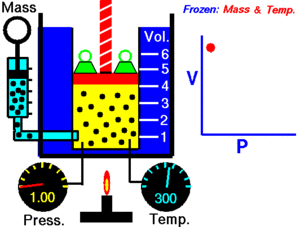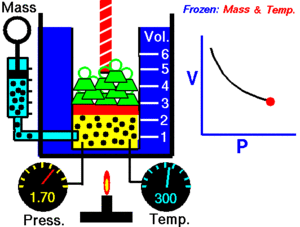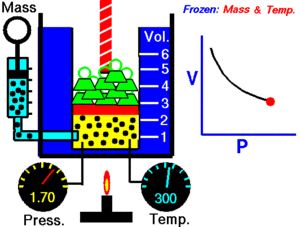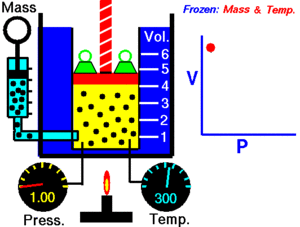
A temperatura constante, el volumen de una masa fija de gas es inversamente proporcional a la presión que éste ejerce.
Matemáticamente se puede expresar así:
PV=K
K es constante si la temperatura y la masa del gas permanecen constantes.
Autor : NASA's Glenn Research Center
Cuando aumenta la presión, el volumen baja, mientras que si la presión disminuye el volumen aumenta.
Manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
P1 x V1=P2 x V2
donde:
P1= Presión inicial
P2= Presión final
V1= Volumen inicial
V2= Volumen final
P2= Presión final
V1= Volumen inicial
V2= Volumen final
2. Ley de Gay-Lussac
Si el volumen de una cierta cantidad de gas a presión moderada se mantiene constante, el cociente entre presión y temperatura (Kelvin) permanece constante.
Para una cierta cantidad de gas, al aumentar la temperatura las moléculas del gas se mueven más rápidamente, y por lo tanto aumenta el número de choques contra las paredes por unidad de tiempo; es decir, aumenta la presión, ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Gay-Lussac descubrió que en cualquier momento del proceso, el cociente entre la presión y la temperatura absoluta tenía un valor constante.
Lo podemos expresar numéricamente:
o también:
donde:
P es la presión
T es la temperatura absoluta (es decir, medida en Kelvin)
K2 la constante de proporcionalidad
T es la temperatura absoluta (es decir, medida en Kelvin)
K2 la constante de proporcionalidad
Supongamos que tenemos un gas que se encuentra a una presión P1 y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:
donde:
P1= Presión inicial
T1 = Temperatura inicial
P2 = Presión final
T2 = Temperatura final
T1 = Temperatura inicial
P2 = Presión final
T2 = Temperatura final
3. Ley de Charles
La ley Jacques Charles dice que :
Para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura, el volumen del gas disminuye.
Para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura, el volumen del gas disminuye.
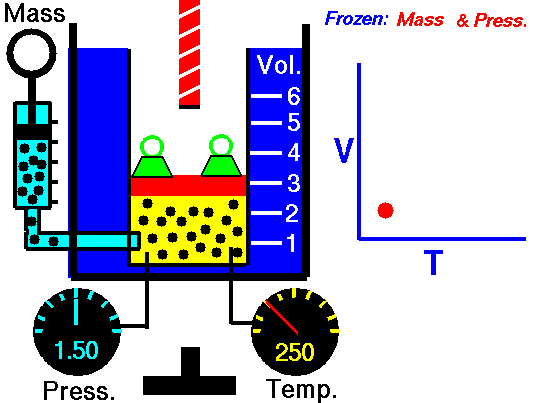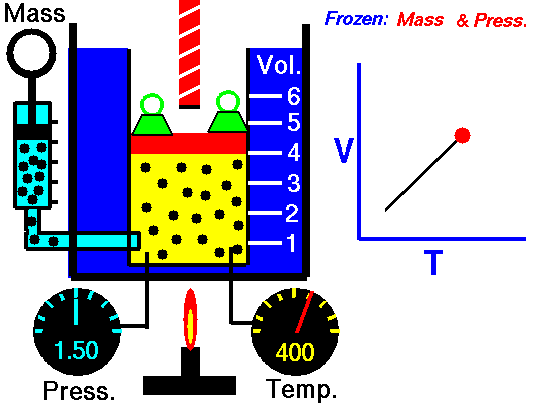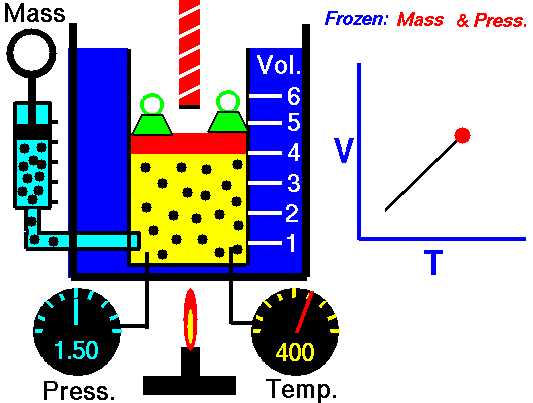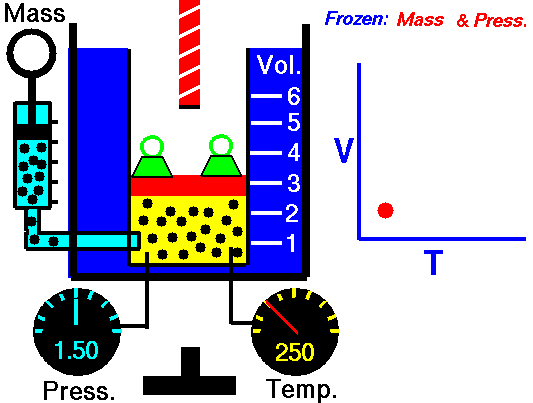
Autor : NASA's Glenn Research Center
Lo podemos expresar:
Además puede expresarse como:
donde:
V1= Volumen inicial
T1= Temperatura inicial
V2= Volumen final
T2= Temperatura final
T1= Temperatura inicial
V2= Volumen final
T2= Temperatura final
http://www.aulafacil.com
Teoría cinética de los gases
En 1738 Daniel Bernouilli dedujo la Ley de Boyle aplicando a las moléculas las leyes del movimiento de Newton, pero su trabajo fue ignorado durante más de un siglo.
Los experimentos de Joule demostrando que el calor es una forma de energía hicieron renacer las ideas sostenidas por Bernouilli y en el período entre 1848 y 1898, Joule, Clausius, Maxwell y Boltzmann desarrollaron la teoría cinético-molecular, también llamada teoría cinética de los gases, que se basa en la idea de que todos los gases se comportan de la misma manera en lo referente al movimiento molecular .
En 1905 Einstein aplicó la teoría cinética al movimiento browniano de una partícula pequeña inmersa en un fluido y sus ecuaciones fueron confirmadas por los experimentos de Perrín en 1908, convenciendo de esta forma a los energéticos de la realidad de los átomos.
1.1- ¿Qué plantea la teoría cinética molecular?
Explica el comportamiento de los gases y plantea que:
⇒ Los gases están formados por partículas (átomos o moléculas)
⇒ Las partículas de estos gases, en condiciones ambientales, se encuentran entre ellas a grandes distancias, no existiendo fuerzas de atracción ni repulsión con otras moléculas.
⇒ Las partículas están en constante movimiento, chocando entre ellas y contra las paredes del recipiente en que se encuentren. Los choques entre las moléculas son perfectamente elásticos, es decir, en cada choque se entrega la energía de una partícula a otra, y por ello pueden continuar en constante movimiento.
⇒ Un aumento de la temperatura de un gas aumenta tambien la velocidad a la que se mueven las partículas.
⇒ La presión que ejerce un gas se debe a los choques de las partículas sobre las paredes del recipiente en que se encuentra.

https://www.portaleducativo.net/octavo-basico/795/Teoria-cinetica-molecular-de-los-gases
leyes de los gases fueron desarrolladas desde finales del siglo XVII, cuando los científicos empezaron a darse cuenta de que en las relaciones entre la presión, el volumen y la temperatura de una muestra de gas, en un sistema cerrado, se podría obtener una fórmula que sería válida para todos los gases. Estos se comportan de forma similar en una amplia variedad de condiciones debido a la buena aproximación que tienen las moléculas que se encuentran más separadas, y los gases se consideran como casos especiales de la ecuación del gas ideal, con una o más de las variables constantes.
Ley de Charles
La ley de Charles, o ley de los volúmenes, fue descubierta en 1778. Se dice que, para un gas ideal a presión constante, el volumen es directamente proporcional a la temperatura absoluta (en kelvin).
Esto se puede encontrar utilizando la teoría cinética de los gases o un recipiente con calentamiento o enfriamiento [sin congelar <0 c="" con="" ejemplo="" frasco="" globo="" nico="" p="" por="" un="" variable="" volumen="">
Donde T es la temperatura absoluta del gas (en kelvin) y k2 (en m3·K−1) es la constante producida.
Ley de Gay-Lussac
Postula que las presiones ejercidas por un gas sobre las paredes del recipiente que lo contienen son proporcionales a sus temperaturas absolutas cuando el volumen es constante.
Combinación y leyes de los gases ideales
Ley de Boyle establece que el producto presión-volumen es constante:
Ley de Charles muestra que el volumen es proporcional a temperatura absoluta:
Ley de Gay-Lussac dice que la presión es proporcional a la temperatura absoluta:
Mediante la combinación de (2) o (3) podemos obtener una nueva ecuación con P, V y T.
Definiendo el producto de K2 por K3 como K4 :
Multiplicando esta ecuación por (1):
Definiendo k5 como el producto de k1 por k4 reordenando la ecuación:
Sacando raíz cuadrada:
Renombrando la raíz cuadrada de k5 como K nos queda la ecuación general de los gases:
Otras leyes de los gases
- La ley de Graham establece que la velocidad de difusión de las moléculas de gas es inversamente proporcional a la raíz cuadrada de su densidad. En combinación con la ley de Avogadro (es decir, ya que los volúmenes iguales tienen el mismo número de moléculas), es lo mismo que ser inversamente proporcional a la raíz del peso molecular.
- La ley de Dalton de las presiones parciales establece que la presión de una mezcla de gases es simplemente la suma de las presiones parciales de los componentes individuales. Ley de Dalton es el siguiente:
- ,
O
- ,
Donde PTotal es la presión total de la atmósfera, PGas es la presión de la mezcla de gases en la atmósfera, y PH20 es la presión del agua a esa temperatura.
- La ley de Henry declara que:
- volumen de un gas: Son las dimensiones del espacio que ocupa un gas. En un sistema cerrado, el gas ocupa todo el volumen del sistema. Así por ejemplo, cuando un gas es metido a un recipiente, se expande uniformemente para ocupar todo el recipiente. Cuando un gas es sacado del recipiente al ambiente tenderá a expandirse por la atmósfera.














No hay comentarios:
Publicar un comentario