Teoria y estructura del átomo
Oir Lecc.
1. Teoría atómica de Dalton
En 1803 John Dalton expone su Teoría Atómica, que se basa en los siguientes puntos:
- Los elementos químicos están formados por partículas muy pequeñas e indivisibles llamadas átomos.
- Los átomos de un mismo elemento químico son iguales entre sí.
- Los átomos de diferentes elementos químicos son distintos entre sí.
- Es imposible crear o destruir átomos.
- Los átomos pueden combinarse entre sí, dando lugar a los llamados “átomos compuestos”.
Este concepto de “átomo compuesto” sirvió para que Amadeo Avogadro presentase el concepto de molécula, entendiendo que las moléculas de un determinado compuesto o elemento químico son iguales entre sí, por lo tanto tienen la misma masa, volumen... etc.
Hoy día se define átomo como la partícula material más pequeña que sirve para identificar un elemento químico.
Los átomos se pueden unir para formar moléculas de elementos o de compuestos. En los elementos, las moléculas están formadas por átomos iguales, y en los compuestos químicos, las moléculas están formadas por átomos de distintos elementos.
Por ejemplo:
Molécula de un elemento químico: cloro + cloro formada por 2 átomos de cloro.
Molécula de un compuesto químico: cloro + sodio formada por 1 átomo de cloro y uno de sodio.
Así podemos entender a las moléculas como el resultado de una asociación de átomos.
2. Estructura atómica
Investigaciones posteriores demostraron que existían partículas más pequeñas en el interior de los átomos:
1. Electrones:
Partículas subatómicas de carga eléctrica negativa y masa despreciable (e-).
Es la primera partícula subatómica que se detecta.
Es la primera partícula subatómica que se detecta.
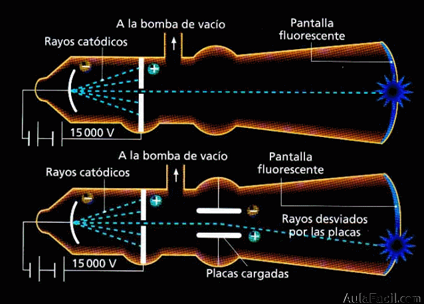
El físico J. J. Thomson En 1897, al someter a un gas a baja presión a un voltaje elevado, éste emitía unas radiaciones que se conocieron como rayos catódicos. Al estudiar las partículas que formaban estos rayos se observó que eran las mismas siempre, cualquiera que fuese el gas del interior del tubo.
Se observó que los rayos catódicos eran partículas negativas (se desviaban hacia el polo positivo de un campo eléctrico) con gran energía cinética.
Por tanto, en el interior de todos los átomos existían una o más partículas con carga negativa llamadas electrones.
2. Protones:
Partículas subatómicas de carga eléctrica positiva y masa 1800 veces superior a la del electrón (p+).
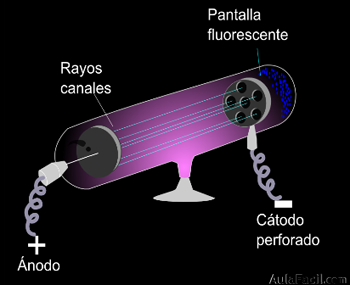
El físico alemán E. Goldstein realizó algunos experimentos con un tubo de rayos catódicos con el cátodo perforado. Observó unos rayos que atravesaban al cátodo en sentido contrario a los rayos catódicos. Recibieron el nombre de rayos canales.
El estudio de estos rayos determinó que estaban formados por partículas de carga positiva, y que tenían una masa distinta según cuál fuera el gas que estaba encerrado en el tubo.
Al experimentar con hidrógeno se consiguió aislar la partícula elemental positiva o protón, cuya carga es la misma que la del electrón pero positiva, y su masa es 1837 veces mayor.
3. Neutrones:
Partículas subatómicas de carga eléctrica nula y masa parecida a la del protón (n).
Mediante diversos experimentos se comprobó que la masa de protones y electrones no coincidía con la masa total del átomo; por tanto, el físico E.Rutherford supuso que tenía que haber otro tipo de partícula subatómica en el interior de los átomos. Estas partículas se descubrieron en 1932 por el físico J. Chadwick. Al no tener carga eléctrica recibieron el nombre de neutrones. El hecho de no tener carga eléctrica hizo muy difícil su descubrimiento.
Los neutrones son partículas sin carga y de masa algo mayor que la masa de un protón.
http://www.aulafacil.com
Átomo es la porción más pequeña de la materia.
El primero en utilizar este término fue Demócrito (filósofo griego, del año 500 a.de C.), porque creía que todos los elementos estaban formados por pequeñas partículas INDIVISIBLES. Átomo, en griego, significa INDIVISIBLE. Es la porción más pequeña de la materia. Los átomos son la unidad básica estructural de todos los materiales de ingeniería.
En la actualidad no cabe pensar en el átomo como partícula indivisible, en él existen una serie de partículas subatómicas de las que protones neutrones y electrones son las más importantes.
Los átomos están formados por un núcleo, de tamaño reducido y cargado positivamente, rodeado por una nube de electrones, que se encuentran en la corteza.
ELECTRÓN
| Es una partícula elemental con carga eléctrica negativa igual a 1,602 · 10-19 Coulomb y masa igual a 9,1093 · 10-28 g, que se encuentra formando parte de los átomos de todos los elementos. |
NEUTRÓN
| Es una partícula elemental eléctricamente neutra y masa ligeramente superior a la del protón (mneutrón=1.675 · 10-24 g), que se encuentra formando parte de los átomos de todos los elementos. |
PROTÓN
| Es una partícula elemental con carga eléctrica positiva igual a 1,602 · 10-19 Coulomb y cuya masa es 1837 veces mayor que la del electrón (mprotón=1.673 · 10-24 g). La misma se encuentra formando parte de los átomos de todos los elementos. |
La nube de carga electrónica constituye de este modo casi todo el volumen del átomo, pero, sólo representa una pequeña parte de su masa. Los electrones, particularmente la masa externa determinan la mayoría de las propiedades mecánicas, eléctrica, químicas, etc., de los átomos, y así, un conocimiento básico de estructura atómica es importante en el estudio básico de los materiales de ingeniería.
TEORÍA ATÓMICA DE DALTON
En el período 1803-1808, Jonh Dalton, utilizó los dos leyes fundamentales de las combinaciones químicas, es decir: la "Ley de conservación de la masa"(La masa total de las sustancias presentes después de una reacción química es la misma que la masa total de las sustancias antes de la reacción) y la "Ley de composición constante"(Todas las muestras de un compuesto tienen la misma composición, es decir las mismas proporciones en masa de los elementos constituyentes.)como base de una teoría atómica.
La esencia de la teoría atómica de la materia de Dalton se resume en tres postulados:
1. Cada elemento químico se compone de partículas diminutas e indestructibles denominadas átomos. Los átomos no pueden crearse ni destruirse durante una reacción química.
2. Todos los átomos de un elemento son semejantes en masa (peso) y otras propiedades, pero los átomos de un elemento son diferentes de los del resto de los elementos.
3. En cada uno de sus compuestos, los diferentes elementos se combinan en una proporción numérica sencilla: así por ejemplo, un átomo de A con un átomo de B (AB), o un átomo de A con dos átomos de B (AB2).
La teoría atómica de Dalton condujo a la "Ley de las proporciones múltiples", que establece lo siguiente:
Si dos elementos forman más de un compuesto sencillo, las masas de un elemento que se combinan con una masa fija del segundo elemento, están en una relación de números enteros sencillos.
Si dos elementos forman más de un compuesto sencillo, las masas de un elemento que se combinan con una masa fija del segundo elemento, están en una relación de números enteros sencillos.
http://www.eis.uva.es/~qgintro/atom/tutorial-02.html
¿Qué es un átomo?
 Ya en el 400 a.C el ser humano se cuestionaba sobre la estructura de la materia y sobre cuáles eran los bloques fundamentales invisibles que componían todo lo macroscópico que nos rodea. Por aquellos años, un filosofo griego, Demócrito, llego a la conclusión de que toda la materia debía de estar compuesta por partículas elementales (es decir indivisibles) que llamo átomos (“átomo” deriva de la palabra griega que significa indivisible). Si bien su brillante intuición fue abandonada por mas de 2000 años, en el 1700, los científicos comenzaron a darse cuenta de que el concepto de átomo dado por Demócrito explicaba varios fenómenos químicos.
Ya en el 400 a.C el ser humano se cuestionaba sobre la estructura de la materia y sobre cuáles eran los bloques fundamentales invisibles que componían todo lo macroscópico que nos rodea. Por aquellos años, un filosofo griego, Demócrito, llego a la conclusión de que toda la materia debía de estar compuesta por partículas elementales (es decir indivisibles) que llamo átomos (“átomo” deriva de la palabra griega que significa indivisible). Si bien su brillante intuición fue abandonada por mas de 2000 años, en el 1700, los científicos comenzaron a darse cuenta de que el concepto de átomo dado por Demócrito explicaba varios fenómenos químicos.
Los avances tecnológicos del 1800, permitieron a Dalton demostrar que lo que había planteado Demócrito, tenia fundamento científico, si bien con algunas correcciones. El factor más importante es que las afirmaciones de Dalton estaban basadas en los resultados (experimentales y reproducibles) de las medidas efectuadas por varios científicos. Si bien las tecnologías empleadas en aquella época no permitían profundizar el conocimiento de estas “misteriosas” partículas llamadas “átomos”, Dalton construyó las bases de la teoría atómica moderna.
Hoy en día sabemos que un átomo es la partícula más pequeña de un elemento que mantiene sus características químicas después de las transformaciones físicas y químicas.
También sabemos que el átomo no es indivisible, ni tampoco una partícula fundamental. La estructura atómica está construída por partículas subatómicas que para nuestros estudios de química consideraremos fundamentales (existen partículas más pequeñas que conforman las 3 que los químicos consideramos fundamentales, pero que son de interés físico)
Un átomo esta formado por un núcleo, formado por protones (partículas cargadas positivamente) y neutrones (partículas sin carga eléctrica) que dan estabilidad al núcleo reduciendo el efecto repulsivo entre los protones (cargas iguales “++” se repelen).
Alrededor del núcleo “giran” en diferentes niveles energéticos los electrones. Dado que el átomo es eléctricamente neutro, sabiendo que el protón es positivo, podemos deducir que el electrón es negativo y están presentes en igual cantidad que los protones. Es importante recordar esto, porque en la tabla periódica el numero atómico representa los números de protones, de los cuales se puede deducir el numero de electrones.
Los electrones se encuentran en zonas que se llaman orbitales, que son el lugar en donde existe mayor probabilidad de encontrar un electrón. Profundizaremos este concepto de configuración electrónica más adelante.
¿Y cómo se llegó a saber todo lo apenas mencionado? ¿Cómo se sabe que hay electrones en un átomo y que son negativos?
A inicios del 1800, diferentes experimentos evidenciaron que al hacer pasar una corriente eléctrica a través de un compuesto, este se descompone. De este resultado experimental se puede deducir que los elementos de un compuesto químico se mantienen unidos por fuerzas eléctricas.
Sucesivamente, la demostración de la existencia de los electrones fue proporcionada por los experimentos realizados con el tubo a rayos catódicos. El genial experimento consiste en un tubo de vidrio, lleno de gas mantenido a baja presión. A cada extremo del tubo fueron colocados dos electrodos: uno positivo (ánodo) detrás del cual fue instalada una pantalla fosforescente (o pantalla centellante) y uno negativo (cátodo).
Aplicando una diferencia de potencial entre los electrodos se observó que el rayo producido generaba una sombra justo detrás del ánodo. Esto demostró cual era la dirección del rayo catódico.
Se llama catódico porque las partículas desprendidas viajan desde el cátodo al ánodo. Para demostrar que este rayo de partículas era negativo, externamente al tubo se aplicaron 2 placas metálicas cargadas eléctricamente y se observó que la desviación del rayo catódico era propia de las partículas eléctricamente negativas.
Para estar más seguros se aplicó un campo magnético y los resultados estaban de acuerdo con las desviaciones propias de las cargas negativas.
Quedaba por investigar si estas partículas poseen una masa, con tal fin, se colocó en la trayectoria del rayo, una rueda de paletas. Se observó que cuando el rayo la golpeaba, esta se movía, por lo que se dedujo que el electrón, además de poseer carga eléctrica negativa, tiene una masa.
Posteriormente, analizando los resultados, Thomson determinó la relación masa/carga, pero eran necesarios otros experimentos para determinar uno de los dos factores para poder calcular el otro. Robert Milikan en el 1909 con el experimento de la gota de aceite pudo determinar la masa del electrón. La masa del electrón es de 9,109 x 10-28 gramos, es decir 1/1836 la masa del átomo de hidrógeno.
El protón fue descubierto con un procedimiento similar al del rayo catódico. En esta ocasión al cátodo se le hacían pequeños orificios. En dirección contraria a los electrones, migraban los iones del gas que rellenaba el tubo. De este experimento se concluyó que existen partículas con carga opuesta a la del electrón y con masa 1836 veces más grande respecto a la partícula negativa.
El neutrón fue descubierto en el 1932, bombardeando con partículas alfa algunas muestras de berilio. En esta experiencia se observó que se desprendían partículas de masa apenas superior a la del protón, pero sin carga eléctrica.
Explicación del experimento de las gotas de aceite.
¿Cómo fue descubierta la masa y la carga del electrón?
En un recipiente cilíndrico, se instalaron 2 placas metálicas, una en el fondo, cargada negativamente y una un poco más abajo del borde superior, cargada positivamente. Se nebuliza el aceite sobre la capa superior, que posee un orificio al centro. A través del orificio caen gotas de aceite que son bombardeadas con rayos X, cuya función es la de cargar negativamente las gotas. Sucesivamente se aplica una diferencia de potencial entre las placas y con la justa calibración, aprovechando de los fenómenos de atracción y repulsión, se logra vencer la fuerza de gravedad y se logra inmovilizar la gota que queda “suspendida” justo delante de un microscopio que permite efectuar las mediciones necesarias para calcular la carga eléctrica presente en la gota, conociendo la masa y la diferencia de potencial aplicada. Milikan notó que las cargas medidas eran múltiplo de un mismo numero, y concluyó que la carga más pequeña era la carga de un electrón. Utilizando la relación carga/masa (1,75882 x 108 C) se pudo calcular la masa del electrón.

Estructura del átomo
Thomson había propuesto una estructura donde el átomo era una masa de cargas positivas en la cual estaban distribuidos los electrones, lo más alejados posible unos de otros. A este modelo se le dió el nombre de “ budín de pasas” por su similitud con el mismo.
Esta teoría fue corregida sucesivamente por Rutherford, que realizó el famoso experimento de la lamina de oro. Disparando partículas alfa contra la lamina de oro, estas partículas aun más densas que un átomo de oro, (si la estructura propuesta por Thompson era correcta) debían ser desviadas de pequeños ángulos. Se observó sin embargo, que casi todas las partículas alfa atravesaban la lamina de oro; algunas eran desviadas de muy poco y otras, sorprendentemente volvían a la fuente.
Este fue el inicio de la moderna estructura atómica. Rutherford concluyó:
El átomo está constituido por un núcleo, denso y pequeño que contiene protones y neutrones (la existencia estaba demostrada por las partículas que rebotaban y volvían a la fuente). Alrededor del núcleo a distancia relativamente grande (se explica por qué la mayor parte de las partículas alfa atravesaban la lamina, porque el átomo esta constituido en gran parte de espacio vacío) se encuentran los electrones (que desvían de muy poco las partículas alfa).
https://iquimicas.com/clases-de-quimica-general-el-atomo-historia-definicion-estructura-y-teoria-atomica-moderna-leccion-de-quimica-n-4/






No hay comentarios:
Publicar un comentario