Modelos Atómicos: Thomson y Rutherford
1. Modelo atómico de Thomson
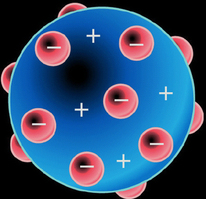
Al ser tan pequeña la masa de los electrones, el físico inglés J. J. Thomson propuso en 1904 que la mayor parte de la masa del átomo correspondería a la carga positiva, que ocuparía la mayor parte del volumen atómico. Thomson imaginó el átomo como una especie de esfera positiva continua en la que se encuentran incrustados los electrones, más o menos como las uvas pasas en un pudin.
Este modelo de "pudin de pasas" de Thomson fue bastante valorado, ya que era capaz de explicar los siguientes fenómenos:
- La electrización: el exceso o defecto de electrones que tenga un cuerpo es el responsable de su carga negativa o positiva.
- La formación de iones: un ión es un átomo que ha ganado o perdido uno o más electrones. Los electrones se pierden o se ganan con relativa facilidad, de manera que su número dentro del átomo puede variar, mientras que el número de protones es fijo siempre para cada átomo.
- Si un átomo pierde uno o más electrones adquiere carga neta positiva (catión) y si gana uno o más electrones adquiere carga neta negativa (anión).
1.1 Insuficiencia del modelo de Thomson
El átomo no es macizo ni compacto como suponía Thompson, es prácticamente hueco y el núcleo es muy pequeño comparado con el tamaño del átomo, según demostró posteriormente E. Rutherford.
2. Modelo atómico de Rutherford
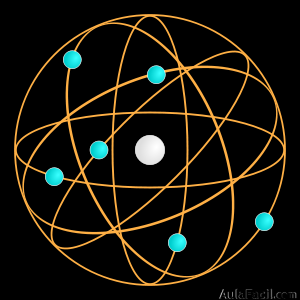
El modelo de Rutherford (1911) fue el primer modelo atómico que consideró al átomo formado por dos partes:
- El núcleo, muy pequeño, que concentra toda la carga eléctrica positiva y la mayor parte de la masa del átomo aportada por los protones y neutrones.
- La corteza, constituida por todos sus electrones, que giran a gran velocidad alrededor del núcleo.
La carga positiva de los protones es compensada con la carga negativa de los electrones, que se hallan fuera del núcleo. El núcleo contiene, por tanto, protones en un número igual al de electrones de la corteza.
Rutherford no solo dio una idea de cómo estaba organizado un átomo, sino que también calculó cuidadosamente su tamaño (un diámetro del orden de 10-10 m) y el de su núcleo (un diámetro del orden de 10-14m).
El hecho de que el núcleo tenga un diámetro unas 10.000 veces menor que el átomo supone una gran cantidad de espacio vacío en la organización atómica de la materia.
http://www.aulafacil.com
Desde la Antigüedad, el ser humano se ha cuestionado de qué estaba hecha la materia.
Unos 400 años antes de Cristo, el filósofo griego Demócrito consideró que la materia estaba constituida por pequeñísimas partículas que no podían ser divididas en otras más pequeñas. Por ello, llamó a estas partículas átomos, que en griego quiere decir "indivisible". Demócrito atribuyó a los átomos las cualidades de ser eternos, inmutables e indivisibles.
Sin embargo las ideas de Demócrito sobre la materia no fueron aceptadas por los filósofos de su época y hubieron de transcurrir cerca de 2200 años para que la idea de los átomos fuera tomada de nuevo en consideración.
| Año | Científico | Descubrimientos experimentales | Modelo atómico | ||||||
| 1808 | John Dalton |
|
| ||||||
| 1897 | J.J. Thomson |
|
| ||||||
| 1911 | E. Rutherford |
|
| ||||||
| 1913 | Niels Bohr |
|
| ||||||
Para Ernest Rutherford, el átomo era un sistema planetario de electrones girando alrededor de un núcleo atómico pesado y con carga eléctrica positiva.
El módelo atómico de Rutherford puede resumirse de la siguiente manera:
Rutherford no solo dio una idea de cómo estaba organizado un átomo, sino que también calculó cuidadosamente su tamaño (un diámetro del orden de 10-10 m) y el de su núcleo (un diámetro del orden de 10-14m). El hecho de que el núcleo tenga un diámetro unas diez mil veces menor que el átomo supone una gran cantidad de espacio vacío en la organización atómica de la materia.
Para analizar cual era la estructura del átomo, Rutherford diseñó un experimento:
El experimento consistía en bombardear una fina lámina de oro con partículas alfa (núcleos de helio). De ser correcto el modelo atómico de Thomson, el haz de partículas debería atravesar la lámina sin sufrir desviaciones significativas a su trayectoria. Rutherford observó que un alto porcentaje de partículas atravesaban la lámina sin sufrir una desviación apreciable, pero un cierto número de ellas era desviado significativamente, a veces bajo ángulos de difusión mayores de 90 grados. Tales desviaciones no podrían ocurrir si el modelo de Thomson fuese correcto.
Al ser tan pequeña la masa de los electrones, el físico inglés J.J.Thomson propuso, en 1904, que la mayor parte de la masa del átomo correspondería a la carga positiva, que ocuparía la mayor parte del volumen atómico. Thomson imaginó el átomo como una especie de esfera positiva contínua en la que se encuentran incrustados los electrones, más o menos como las uvas pasas en un pudin.
En esta escena se puede observar cómo sería un átomo con este modelo:
|
Este modelo del “pudin de pasas” de Thomson era bastante razonable y fue aceptado durante varios años, ya que explicaba varios fenómenos, por ejemplo los rayos catódicos y los canales:
El modelo atómico de Thomson es una teoría sobre la estructura atómica propuesta en 1904 por Thomson, quien descubrió el electrón1 en 1897, mucho antes del descubrimiento del protón y del neutrón. En dicho modelo, el átomo está compuesto por electrones de carga negativa en un átomo positivo, incrustados en este al igual que las pasas de un pudin. A partir de esta comparación, fue que el supuesto se denominó «Modelo del pudin de pasas».2 3 Postulaba que los electrones se distribuían uniformemente en el interior del átomo suspendidos en una nube de carga positiva. El átomo se consideraba como una esfera con carga positiva con electrones repartidos como pequeños gránulos. La herramienta principal con la que contó Thomson para su modelo atómico fue la electricidad.
El modelo atómico de Rutherford1 es un modelo atómico o teoría sobre la estructura interna del átomo propuesto por el químico y físico británico-neozelandés Ernest Rutherford2para explicar los resultados de su "experimento de la lámina de oro", realizado en 1911.
Rutherford llegó a la conclusión de que la masa del átomo se concentraba en una región pequeña de cargas positivas que impedían el paso de las partículas alfa. Sugirió un nuevo modelo en el cual el átomo poseía un núcleo o centro en el cual se concentra la masa y la carga positiva, y que en la zona extranuclear se encuentran los electrones de carga negativa.
Antes de que Rutherford propusiera su modelo atómico, los físicos aceptaban que las cargas eléctricas en el átomo tenían una distribución más o menos uniforme. Rutherford trató de ver cómo era la dispersión de las partículas alfa por parte de los átomos de una lámina de oro muy delgada. Los ángulos resultantes de la desviación de las partículas supuestamente aportarían información sobre cómo era la distribución de carga en los átomos. Era de esperar que, si las cargas estaban distribuidas uniformemente según el modelo atómico de Thomson, la mayoría de las partículas atravesarían la delgada lámina sufriendo solo ligerísimas deflexiones, siguiendo una trayectoria aproximadamente recta. Aunque esto era cierto para la mayoría de las partículas alfa, un número importante de estas sufrían deflexiones de cerca de 180º, es decir, prácticamente salían rebotadas en dirección opuesta a la incidente.
Rutherford pensó que esta fracción de partículas rebotadas en dirección opuesta podía ser explicada si se suponía la existencia de fuertes concentraciones de carga positiva en el átomo. La mecánica newtoniana en conjunción con la ley de Coulomb predice que el ángulo de deflexión de una partícula alfa relativamente liviana por parte de un átomo de oro más pesado, depende del "parámetro de impacto" o distancia entre la trayectoria de la partícula y el núcleo:3
Donde:
Dado que Rutherford observó una fracción apreciable de partículas "rebotadas" para las cuales el ángulo de deflexión es cercano a χ ≈ π, de la relación inversa a ():
se deduce que el parámetro de impacto debe ser bastante menor que el radio atómico. De hecho el parámetro de impacto necesario para obtener una fracción apreciable de partículas "rebotadas" sirvió para hacer una estimación del tamaño del núcleo atómico, que resulta ser unas cien mil veces más pequeño que el diámetro atómico. Este hecho resultó ser la capacidad uniformable sobre la carga positiva de neutrones.
|








No hay comentarios:
Publicar un comentario