| Telangiectasia Hemorrágica Hereditaria | |
|---|---|
 | |
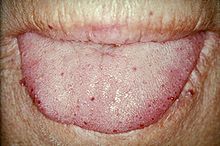
| Telangiectasias caracteristicas del labio. | |
| Especialidad | Genética Médica |
La telangiectasia hemorrágica hereditaria ( HHT ), también conocida como enfermedad de Osler-Weber-Rendu y síndrome de Osler-Weber-Rendu , es un dominante rara autosómica trastorno genético que conduce a la formación anormal de vasos sanguíneos en la piel , las membranas mucosas , y con frecuencia en órganos tales Como los pulmones , el hígado y el cerebro . [1] [2]
Puede provocar hemorragias nasales , hemorragia aguda y crónica del tracto digestivo y diversos problemas debidos a la participación de otros órganos. El tratamiento se centra en reducir el sangrado de las lesiones de los vasos sanguíneos y, a veces, en la cirugía u otras intervenciones dirigidas para eliminar las malformaciones arteriovenosas en los órganos. El sangrado crónico a menudo requiere suplementos de hierro y, a veces, transfusiones de sangre . La HHT se transmite de manera autosómica dominante y ocurre en una de cada 5,000 a 8,000 personas en América del Norte.
Signos y síntomas [ editar ]
Telangiectasias [ editar ]
La telangiectasia (pequeñas malformaciones vasculares) puede ocurrir en la piel y en los revestimientos mucosos de la nariz y el tracto gastrointestinal. El problema más común es la hemorragia nasal(epistaxis), que ocurre con frecuencia desde la infancia y afecta a alrededor del 90% al 95% de las personas con HHT. Las lesiones en la piel y en la boca sangran con menos frecuencia, pero pueden considerarse estéticamente desagradables; Afectan alrededor del 80%. [1] [2] Las lesiones cutáneas se presentan de manera característica en los labios , la nariz y los dedos , y en la piel de la cara en áreas expuestas al sol. Aparecen de repente, con el número aumentando con el tiempo. [2]
Alrededor del 20% está afectado por lesiones sintomáticas del tracto digestivo, aunque un porcentaje más alto tiene lesiones que no causan síntomas. Estas lesiones pueden sangrar de manera intermitente, lo que rara vez es lo suficientemente importante como para que se note (en forma de vómitos con sangre o heces negras ), pero eventualmente puede conducir al agotamiento del hierro en el cuerpo, lo que ocasiona anemia por deficiencia de hierro . [1] [2]
Malformación arteriovenosa [ editar ]
Las malformaciones arteriovenosas (MAV, malformaciones vasculares más grandes) ocurren en órganos más grandes, predominantemente los pulmones (50%), el hígado (30–70%) y el cerebro ( MAV cerebrales , 10%), con una proporción muy pequeña (<1 avm="" en="" font="" la="" nbsp="" tener="">médula espinal . [1] [2]
Las malformaciones vasculares en los pulmones pueden causar varios problemas. Los pulmones normalmente "filtran" las bacterias y los coágulos de sangre del torrente sanguíneo; Los AVM pasan por alto la red capilar de los pulmones y permiten que estos emigren al cerebro, donde las bacterias pueden causar un absceso cerebral y los coágulos de sangre pueden provocar un accidente cerebrovascular . [1] La HHT es la causa más común de MAV pulmonares: de todas las personas con AVM pulmonar, entre el 70 y el 80% se debe a HHT. [4] [5] El sangrado de las MAV pulmonares es relativamente inusual, pero puede causar hemoptisis(tos con sangre) o hemotórax (sangre que se acumula en la cavidad torácica). [1][2] [4] Las malformaciones vasculares grandes en el pulmón permiten que la sangre con poco oxígeno del ventrículo derecho pase por alto los alvéolos , lo que significa que esta sangre no tiene la oportunidad de absorber oxígeno fresco. Esto puede llevar a la falta de aliento . [4] [5] Las MAV grandes pueden conducir a la platipnea , dificultad para respirar que es más marcada cuando se está sentado en comparación con acostarse; esto probablemente refleja los cambios en el flujo sanguíneo asociados con el posicionamiento. [4] Las AVM muy grandes causan una marcada incapacidad para absorber el oxígeno, lo que puede ser notado por la cianosis (decoloración azulada de los labios y la piel) ylas uñas de los dedos.(a menudo se encuentra en niveles de oxígeno crónicamente bajos) y un ruido de zumbidoen la parte afectada del pulmón detectable por el estetoscopio . [4] [5]
Los síntomas producidos por las AVM en el hígado dependen del tipo de conexión anormal que se forman entre los vasos sanguíneos. Si la conexión es entre arterias y venas , una gran cantidad de sangre pasa por alto los órganos del cuerpo, por lo que el corazón compensa aumentando el gasto cardíaco . Finalmente , se desarrolla una insuficiencia cardíaca congestiva (" insuficiencia cardíaca de alto rendimiento"), con dificultad para respirar e hinchazón de las piernas, entre otros problemas. [1] [6] Si el AVM crea una conexión entre la vena porta y los vasos sanguíneos del hígado, el resultado puede ser una hipertensión portal (aumento de la presión de la vena porta), en la cual se forman vasos sanguíneos colaterales en laesófago ( várices esofágicas ), que puede sangrar violentamente; Además, el aumento de la presión puede dar lugar a la acumulación de líquido en la cavidad abdominal ( ascitis ). Si el flujo en la AVM es en la otra dirección, la sangre venosa portal fluye directamente hacia las venas en lugar de atravesar el hígado; esto puede conducir a encefalopatía hepática (confusión debida a productos de desecho del portal que irritan el cerebro). En raras ocasiones, los conductos biliares están privados de sangre, lo que ocasiona una colangitis grave (inflamación de los conductos biliares). [1] [6] Las AVM hepáticas son detectables en más del 70% de las personas con HHT, pero solo el 10% experimenta problemas como resultado. [2]
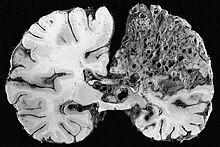
En el cerebro, las MAV ocasionalmente ejercen presión, lo que lleva a dolores de cabeza . También pueden aumentar el riesgo de convulsiones , como lo haría cualquier tejido anormal en el cerebro. Finalmente, la hemorragia de una MAV puede conducir a una hemorragia intracerebral (sangrado en el cerebro), que causa cualquiera de los síntomas de un derrame cerebral, como debilidad en una parte del cuerpo o dificultad para hablar. Si la hemorragia se produce en el espacio subaracnoideo ( hemorragia subaracnoidea ), suele haber un dolor de cabeza intenso y repentino, un nivel de conciencia disminuido y, a menudo, una parte del cuerpo. [1] [2]
Otros problemas [ editar ]
Una proporción muy pequeña (los afectados por las mutaciones de SMAD4 (MADH4), ver más abajo) tienen múltiples pólipos benignos en el intestino grueso , que pueden sangrar o transformarse en cáncer colorrectal . Una proporción similarmente pequeña experimenta hipertensión pulmonar , un estado en el cual la presión en las arterias pulmonares aumenta, ejerciendo presión en el lado derecho del corazón y causando edema periférico(hinchazón de las piernas), desmayos y ataques de dolor en el pecho . Se ha observado que el riesgo de trombosis (particularmente la trombosis venosa), en forma de trombosis venosa profunda o embolia pulmonar ) puede aumentar. Existe la sospecha de que las personas con HHT pueden tener una inmunodeficiencia leve y, por lo tanto, tienen un riesgo ligeramente mayor de infecciones. [1]
Genética [ editar ]
La HHT es un trastorno genético con un patrón de herencia autosómico dominante . Las personas con síntomas de HHT que no tienen parientes con la enfermedad pueden tener una nueva mutación. [7] Lahomocigosidad parece ser fatal en el útero. [1]
Se reconocen cinco tipos genéticos de HHT. De estos, tres se han vinculado a genes particulares , mientras que los dos restantes actualmente solo se han asociado con un locus en particular . Más del 80% de todos los casos de HHT se deben a mutaciones en ENG o ACVRL1 . [8] Se conocen un total de más de 600 mutaciones diferentes. Es probable que exista un predominio de cualquiera de los tipos en poblaciones particulares, pero los datos son contradictorios. Lasmutaciones de MADH4 , que causan poliposis colónica además de la HHT, comprenden aproximadamente el 2% de las mutaciones causantes de enfermedades. Aparte de MADH4 , no está claro si las mutaciones en ENG yACVRL1 conduce a síntomas particulares, [1] aunque algunos informes sugieren que las mutaciones ENG son más propensas a causar problemas pulmonares, mientras que las mutaciones ACVRL1 pueden causar más problemas hepáticos, [2] [5] y la hipertensión pulmonar puede ser un problema particular en personas con ACVRL1 mutaciones [8] Laspersonas con exactamente las mismas mutaciones pueden tener diferente naturaleza y gravedad de los síntomas, lo que sugiere que genes adicionales u otros factores de riesgo pueden determinar la tasa a la que se desarrollan las lesiones; Estos aún no han sido identificados. [2] [8]
| Nombre | OMIM | Gene | Lugar | Descripción |
|---|---|---|---|---|
| HHT1 | 187300 | ENG | 9 q34.1 | Los códigos ENG para endoglina, un receptor de TGF-β1 ( factor de crecimiento transformante beta 1 ) y TGF-β3 ; el vínculo genético se identificó en 1994. [9] Se observó una alta proporción de mutaciones de cambio de marco . [1] Prácticamente todas las mutaciones ocurren en la parte extracelular de la proteína (la parte que se encuentra en la superficie de la célula ). [8] |
| HHT2 | 600376 | ACVRL1 | 12 q11-q14 | ACVRL1 codifica para Alk-1 ( ACVR1 , quinasa 1 tipo receptor de activina), un receptor de TGF-β1; el vínculo genético se identificó en 1996. [10] |
| HHT3 | 601101 | Desconocido | 5 q31 | Función desconocida, vinculación identificada en 2005. [11] |
| HHT4 | 610655 | Desconocido | 7 p14. | Función desconocida, vinculación identificada en 2006. [12] |
| JPHT | 175050 | MADH4 | 18 q21.1 | MADH4 codifica para SMAD4, una proteína de señalización intracelular para los receptores de la superfamilia de TGF. Las mutaciones en este gen causan HHT y poliposis juvenil. La vinculación se identificó en 2004. [13] Mutaciones principalmente en los exones 8–11, a menudo de novo (recién adquiridas, no heredadas). [1] |
Fisiopatología [ editar ]
Se cree que las telangiectasias y las malformaciones arteriovenosas en la HHT surgen debido a cambios en la angiogénesis , el desarrollo de vasos sanguíneos a partir de los existentes. El desarrollo de un nuevo vaso sanguíneo requiere la activación y migración de varios tipos de células, principalmente endotelio , músculo liso y pericitos . El mecanismo exacto por el cual las mutaciones de HHT influyen en este proceso aún no está claro, y es probable que interrumpan el equilibrio entre las señales pro y antiangiogénicas en los vasos sanguíneos. La pared de las telangiectasias es inusualmente friable , lo que explica la tendencia de estas lesiones a sangrar. [1]
Todos los genes conocidos hasta ahora están vinculados al código HHT para proteínas en la vía de señalización de TGF-β . Este es un grupo de proteínas que participa en la transducción de señales de las hormonas de la superfamilia beta del factor de crecimiento transformante (el factor de crecimiento beta transformante , la proteína morfogenética ósea y lasclases de factor de diferenciación del crecimiento ), específicamente BMP9 / GDF2 y BMP10. Las hormonas no entran a la célula sino que se conectan a los receptores de la membrana celular; luego, estas activan otras proteínas y, finalmente, influyen en el comportamiento celular de varias maneras, como la supervivencia celular, la proliferación (que aumenta en número) y la diferenciación (cada vez más especializada). [1] Para que la señal de la hormona se transduzca adecuadamente, se necesita una combinación de proteínas: dos de cada uno de los dos tipos de receptores de membrana tipo cinasa específicos de serina / treonina y endoglina. Cuando se unen a la hormona, las proteínas receptoras de tipo II se fosforilan (transfieren fosfato ) a las proteínas receptoras de tipo I (de las cuales Alk-1 es una), que a su vez fosforilan un complejo de proteínas SMAD (principalmenteSMAD1 , SMAD5 y SMAD8 ). Estos se unen a SMAD4 y migran al núcleo celular donde actúan como factores de transcripción y participan en la transcripción de genes particulares. Además de la vía SMAD, los receptores de membrana también actúan sobre la vía MAPK , que tiene acciones adicionales sobre el comportamiento de las células. [2] Tanto Alk-1 como endoglina se expresan predominantemente en el endotelio, tal vez explicando por qué las mutaciones causantes de HHT en estas proteínas conducen predominantemente a problemas en los vasos sanguíneos. [2] [8] Ambos ENG y ACVRL1las mutaciones conducen predominantemente a la subproducción de las proteínas relacionadas, en lugar de un mal funcionamiento de las proteínas. [8]
Diagnóstico [ editar ]
Las pruebas de diagnóstico se pueden realizar por varias razones. En primer lugar, se necesitan algunas pruebas para confirmar o refutar el diagnóstico. En segundo lugar, se necesitan algunos para identificar posibles complicaciones. [7]
Telangiectasias [ editar ]
Las telangiectasias de la piel y la cavidad oral son visualmente identificables en el examen físico , y de manera similar, las lesiones en la nariz se pueden ver en la endoscopia de la nasofaringe o en la laringoscopia . La gravedad de las hemorragias nasales se puede cuantificar objetivamente mediante un cuestionario similar a una cuadrícula en el que se registra el número de episodios de hemorragia nasal y su duración. [2]
Las telangiectasias del tracto digestivo se pueden identificar en la esofagogastroduodenoscopia (endoscopia del esófago, el estómago y la primera parte del intestino delgado). Por lo general, este procedimiento solo se realizará si hay una anemia más marcada de lo esperado por la gravedad de las hemorragias nasales, o si hay evidencia de sangrado grave (vómitos con sangre, heces negras). Si el número de lesiones observadas en la endoscopia es inesperadamente bajo, el resto del intestino delgado se puede examinar con una cápsula endoscópica , en la cual el paciente ingiere un dispositivo en forma de cápsula que contiene una cámara en miniatura que transmite imágenes del tracto digestivo a un dispositivo digital portátil. grabadora. [2]
Las malformaciones arteriovenosas [ editar ]
La identificación de MAV requiere imágenes médicas detalladas de los órganos más comúnmente afectados por estas lesiones. No todas las MAV causan síntomas o están en riesgo de hacerlo, y por lo tanto existe un grado de variación entre los especialistas en cuanto a si tales investigaciones se realizarían y por qué modalidad; a menudo, las decisiones sobre este tema se toman junto con el paciente. [1]
Pueden sospecharse MAV pulmonares debido a la aparición anormal de los pulmones en una radiografía de tórax , o hipoxia (niveles bajos de oxígeno) en la oximetría de pulso o la determinación de los gases en la sangre arterial . La ecocardiografía de contraste de burbuja (eco de burbuja) se puede usar como una herramienta de detección para identificar conexiones anormales entre las arterias y las venas de los pulmones . Esto implica la inyección de solución salina agitada en una vena, seguida de imágenes del corazón basadas en ultrasonido. Normalmente, los pulmones eliminan pequeñas burbujas de aire de la circulación y, por lo tanto, solo se ven en la aurícula derecha y el ventrículo derecho.. Si hay un AVM, aparecen burbujas en la aurícula izquierda y en el ventrículo izquierdo , generalmente de 3 a 10 ciclos cardíacos después del lado derecho; esto es más lento que en los defectos cardíacos , en los cuales hay conexiones directas entre el lado derecho e izquierdo del corazón. Un mayor número de burbujas es más probable que indique la presencia de un AVM. El eco de la burbuja no es una herramienta de detección perfecta, ya que puede perder AVM más pequeños y no identifica el sitio de AVM. A menudo contrastar -Mejora de la tomografía computarizada (angiografía CT) se utiliza para identificar las lesiones pulmonares; Esta modalidad tiene una sensibilidad superior al 90%. [1] [2]Puede ser posible omitir la administración de contraste en los escáneres de tomografía computada modernos. [5] La ecocardiografía también se usa si existe una sospecha de hipertensión pulmonar o insuficiencia cardíaca de alto rendimiento debido a lesiones hepáticas grandes, a veces seguida de cateterización cardíaca para medir las presiones dentro de las distintas cámaras del corazón. [1]
Pueden sospecharse MAV hepáticas debido a pruebas anormales de la función hepática en la sangre, porque se desarrollan los síntomas de insuficiencia cardíaca o por ictericia u otros síntomas de disfunción hepática. La prueba de detección inicial más confiable es la ecografía Doppler del hígado; esto tiene una sensibilidad muy alta para identificar lesiones vasculares en el hígado. Si es necesario, se puede usar la TC con contraste para caracterizar aún más las MAV. [1] [2] [6] Es extremadamente común encontrar nódulos incidentales en las gammagrafías hepáticas, más comúnmente debido a hiperplasia nodular focal (HNF), ya que son cien veces más comunes en la HHT en comparación con la población general. FNH es considerado como inofensivo. Generalmente,Se utilizan marcadores tumorales y modalidades de imagen adicionales para diferenciar entre FNH y tumores malignos del hígado. La biopsia de hígado no se recomienda en personas con HHT, ya que el riesgo de hemorragia por AVM hepática puede ser significativo. [6] [7] Las gammagrafías hepáticas pueden ser útiles si alguien es sospechoso de HHT, pero no cumple con los criterios (ver a continuación) a menos que se puedan demostrar lesiones hepáticas. [7]
Las AVM cerebrales se pueden detectar en la angiografía por tomografía computarizada (CTA o angio TC) o en la angiografía por resonancia magnética (ARM); La CTA es mejor para mostrar los propios vasos, y la MRA proporciona más detalles sobre la relación entre una AVM y el tejido cerebral circundante. [14] En general, se recomienda la MRI. [2] [7] Se pueden encontrar varios tipos de malformaciones vasculares: AVM, micro-AVM, telangiectasias y fístulas arteriovenosas . [7] Si se contempla cirugía, embolización u otro tratamiento (ver a continuación), angiografía cerebralPuede ser necesario para obtener suficiente detalle de los buques. Este procedimiento conlleva un pequeño riesgo de accidente cerebrovascular (0,5%) y, por lo tanto, se limita a circunstancias específicas. [7] [14] Recientes lineamientos profesionales recomiendan que todos los niños con HHT sospechosos o definitivos se sometan a una IRM cerebral en una etapa temprana de la vida para identificar AVM que pueden causar complicaciones mayores. [7] Otros sugieren que la detección de MAV cerebral es probablemente innecesaria en aquellos que no experimentan ningún síntoma neurológico, ya que la mayoría de las lesiones descubiertas en las exploraciones de detección no requieren tratamiento, lo que genera problemas indeseables. [1]
Las pruebas genéticas [ editar ]
Las pruebas genéticas están disponibles para las mutaciones ENG , ACVRL1 y MADH4 . Las pruebas no siempre son necesarias para el diagnóstico, ya que los síntomas son suficientes para distinguir la enfermedad de otros diagnósticos. Hay situaciones en las que las pruebas pueden ser particularmente útiles. En primer lugar, los niños y adultos jóvenes con un padre con HHT definitivo pueden tener síntomas limitados, pero estar en riesgo de algunas de las complicaciones mencionadas anteriormente; si se conoce la mutación en el padre afectado, la ausencia de esta mutación en el niño evitaría la necesidad de pruebas de detección. Además, las pruebas genéticas pueden confirmar el diagnóstico en aquellas personas con síntomas limitados que de otra manera hubieran sido etiquetadas como "posible HHT" (ver más abajo). [7]
El diagnóstico genético en la HHT es difícil, ya que las mutaciones se producen en numerosas ubicaciones diferentes en los genes vinculados, sin que las mutaciones particulares sean muy frecuentes (a diferencia de, por ejemplo, la mutación ΔF508 en la fibrosis quística ). El análisis de secuencia de los genes involucrados es, por lo tanto, el enfoque más útil (sensibilidad del 75%), seguido de pruebas adicionales para detectar grandes deleciones y duplicaciones (10% adicional). No todas las mutaciones en estos genes se han relacionado con la enfermedad. [7]
Las mutaciones en el gen MADH4 generalmente se asocian con poliposis juvenil, y la detección de tal mutación indicaría la necesidad de examinar al paciente y a los familiares afectados para detectar pólipos y tumores del intestino grueso. [7]
Criterios [ editar ]
El diagnóstico se puede hacer según la presencia de cuatro criterios, conocidos como " criterios de Curaçao ". [15] Si se cumplen tres o cuatro, un paciente tiene "HHT definido", mientras que dos dan "HHT posible":
- Recurrente espontánea epistaxis
- Múltiples telangiectasias en lugares típicos (ver arriba)
- AVM visceral comprobada (pulmón, hígado, cerebro, columna vertebral)
- Miembro de primer grado de la familia con HHT
A pesar de la designación de "posible", una persona con una MAV visceral y antecedentes familiares pero sin hemorragias nasales o telangiectasias es extremadamente probable que tenga HHT, porque estas MAV son muy poco frecuentes en la población general. Al mismo tiempo, no se puede decir lo mismo de las hemorragias nasales y las telangiectasias escasas, que ocurren en personas sin HHT, en ausencia de MAV. El estado de diagnóstico de alguien puede cambiar en el curso de la vida, ya que los niños pequeños aún no presentan todos los síntomas; a la edad de 16 años, el trece por ciento sigue siendo indeterminado, mientras que a la edad de 60 años la gran mayoría (99%) tiene una clasificación diagnóstica definida. Por lo tanto, los hijos de pacientes con HHT establecidos pueden ser etiquetados como "HHT posible", ya que el 50% puede tener HHT en el curso de su vida. [1]
Tratamiento [ editar ]
El tratamiento de la HHT es sintomático (se trata de los síntomas en lugar de la enfermedad en sí), ya que no existe una terapia que detenga el desarrollo de telangiectasias y AVM directamente. Además, algunos tratamientos se aplican para prevenir el desarrollo de complicaciones comunes. [7] Las hemorragias nasales crónicas y el sangrado del tracto digestivo pueden provocar anemia; Si el sangrado no se puede detener completamente, la anemia requiere tratamiento con suplementos de hierro . Aquellos que no pueden tolerar las tabletas o soluciones de hierro pueden requerir la administración de hierro por vía intravenosa y transfusión de sangre si la anemia está causando síntomas graves que justifican una mejoría rápida del recuento sanguíneo. [2] [7]
La mayoría de los tratamientos utilizados en la HHT se han descrito en adultos, y la experiencia en el tratamiento de niños es más limitada. [7] Las mujeres con HHT que quedan embarazadas tienen un mayor riesgo de complicaciones y se las observa detenidamente, aunque el riesgo absoluto sigue siendo bajo (1%). [1]
Nosebleeds [ editar ]
Una hemorragia nasal aguda se puede tratar con una variedad de medidas, como el empaquetamiento de la cavidad nasal con hisopos o geles absorbentes. La eliminación de los paquetes después de la hemorragia puede llevar a la reapertura de los vasos frágiles, por lo que se recomienda un empaque lubricado o atraumático. [7] Es posible que algunos pacientes deseen aprender a empacar para tratar las hemorragias nasales sin tener que recurrir a la ayuda médica. [dieciséis]
Las hemorragias nasales frecuentes se pueden prevenir en parte manteniendo húmedas las fosas nasales y aplicando una solución salina , cremas que contengan estrógenos o ácido tranexámico ; estos tienen pocos efectos secundarios y pueden tener un pequeño grado de beneficio. [7] Se han usado varias modalidades adicionales para prevenir el sangrado recurrente si las medidas simples no tienen éxito. Las terapias médicas incluyen ácido tranexámico oral y estrógeno; la evidencia de esto es relativamente limitada, y el estrógeno es mal tolerado por los hombres y posiblemente conlleva riesgos de cáncer y enfermedades cardíacas en las mujeres después de la menopausia. [2] [7] Coagulación nasal y cauterizaciónpuede reducir el sangrado de las telangiectasias, y se recomienda antes de considerar la cirugía. Sin embargo, es altamente recomendable usar el menor calor y tiempo para prevenir perforaciones septales y traumas excesivos en la mucosa nasal que ya son susceptibles de sangrado. [ cita requerida ] La escleroterapia es otra opción para controlar el sangrado. Este proceso consiste en inyectar una pequeña cantidad de un irritante aireado (detergente como el tetradecilsulfato de sodio) directamente en las telangiectasias. El detergente hace que el recipiente se colapse y se endurezca, lo que produce un residuo de tejido cicatricial. Este es el mismo procedimiento utilizado para tratar las venas varicosas y trastornos similares. [ cita requerida ]
Puede ser posible embolizar lesiones vasculares a través de la radiología intervencionista ; esto requiere pasar un catéter a través de una arteria grande y ubicar la arteria maxilar bajo la guía de rayos X , seguido de la inyección en el vaso de partículas que ocluyen los vasos sanguíneos. El beneficio del procedimiento tiende a ser de corta duración, [7] y puede ser más apropiado en episodios de sangrado severo. [dieciséis]
Para minimizar de manera más efectiva la recurrencia y la gravedad de la epistaxis, se pueden usar otras opciones junto con las terapias enumeradas anteriormente. Las sustancias anti-VEGF administradas por vía intravenosa, como bevacizumab (nombre de marca Avastin), pazopinab y talidomida o sus derivados, interfieren con la producción de nuevos vasos sanguíneos que son débiles y, por lo tanto, propensos a sangrar. Debido a las experiencias pasadas con la prescripción de talidomida a mujeres embarazadas para aliviar los síntomas de las náuseas y los terribles defectos de nacimiento que siguieron, la talidomida es una terapia de último recurso. Además, la talidomida puede causar neuropatía. Aunque esto puede mitigarse modificando las dosis y prescribiendo sus derivados, como la lenolidomida y la pomalidomida, muchos médicos prefieren los inhibidores alternativos de VEGF.[ cita requerida ]
Si otras intervenciones han fallado, se ha informado que varias operaciones brindan beneficios. Uno es la dermoplastia septal o el procedimiento de Saunders, [17] en el que la piel se trasplanta a las fosas nasales, y el otro es el procedimiento de Young, [18] en el que las fosas nasales están completamente selladas. [7] [16]
Piel y tracto digestivo [ editar ]
Las lesiones cutáneas de HHT pueden ser desfigurantes y pueden responder al tratamiento con láser Nd: YAG de pulsos largos . [2] Las lesiones cutáneas en las yemas de los dedos a veces sangran y causan dolor. Enocasiones, se necesita un injerto de piel para tratar este problema. [2]
Con respecto a las lesiones del tracto digestivo, el sangrado leve y la anemia resultante leve se tratan con suplementos de hierro y no se administra ningún tratamiento específico. Hay datos limitados sobre el tratamiento hormonal y el ácido tranexámico para reducir el sangrado y la anemia. La anemia grave o los episodios de hemorragia grave se tratan con coagulación endoscópica con plasma de argón (APC) o tratamiento con láser de cualquier lesión identificada; Esto puede reducir la necesidad de tratamiento de apoyo. Los beneficios esperados no son tales que se recomiendan los intentos repetidos de tratar las lesiones. [7] El sangrado súbito y muy severo es inusual; si se encuentra, deben considerarse causas alternativas (como una úlcera péptica ) [7], pero en tales casos se puede usar la embolización. [1]
AVM de pulmón [ editar ]
Las lesiones pulmonares, una vez identificadas, generalmente se tratan para prevenir episodios de sangrado y, lo que es más importante, una embolia en el cerebro. Esto se hace particularmente en lesiones con un vaso sanguíneo de alimentación de 3 mm o más, ya que es más probable que causen complicaciones a largo plazo, a menos que se traten. La terapia actual más efectiva es la embolización con bobinas metálicas desmontables. El procedimiento consiste en la punción de una vena grande (generalmente bajo anestesia general ), seguida del avance de un catéter a través del ventrículo derecho hacia la arteria pulmonar , después de lo cual se inyecta un radiocontraste para visualizar las AVM ( angiografía pulmonar). Una vez que se ha identificado la lesión, se despliegan bobinas que obstruyen el flujo sanguíneo y permiten que la lesión regrese. En manos experimentadas, el procedimiento tiende a ser muy efectivo y con efectos secundarios limitados, pero las lesiones pueden recurrir y pueden requerirse más intentos. Las exploraciones de CTA se repiten para monitorear la recurrencia. [2] [4] [5] [7] La escisión quirúrgica ahora ha sido esencialmente abandonada debido al éxito de la emboloterapia. [5] [7]
Las personas con AVM pulmonares definidas o un ecocardiograma de contraste anormal sin lesiones claramente visibles se consideran en riesgo de embolias cerebrales. Por lo tanto, se les aconseja evitar el buceo , durante el cual se pueden formar pequeñas burbujas de aire en la sangre que pueden migrar al cerebro y causar un derrame cerebral. De manera similar, se recomienda la profilaxis antimicrobiana durante los procedimientos en los cuales las bacterias pueden ingresar al torrente sanguíneo, como el trabajo dental , y evitar las burbujas de aire durante la terapia intravenosa . [2] [5] [7]
AVM del hígado [ editar ]
Dado que las MAV del hígado generalmente causan una insuficiencia cardíaca de alto rendimiento, el énfasis está en el tratamiento con diuréticos para reducir el volumen de sangre circulante, la restricción de la ingesta de sal y líquidos y los agentes antiarrítmicos en caso de latidos cardíacos irregulares . Esto puede ser suficiente para tratar los síntomas de hinchazón y disnea. Si este tratamiento no es efectivo o provoca efectos secundarios o complicaciones, la única opción que queda es el trasplante de hígado . Esto se reserva para aquellos con síntomas graves, ya que conlleva una mortalidad de alrededor del 10%, pero conduce a buenos resultados si tiene éxito. [6] [7]El punto exacto en el que se ofrecerá el trasplante de hígado aún no está completamente establecido. [6] Se intentó un tratamiento de embolización, pero conduce a complicaciones graves en una proporción de pacientes y se desaconseja. [5] [6] [7]
Otras complicaciones relacionadas con el hígado (hipertensión portal, várices esofágicas, ascitis, encefalopatía hepática) se tratan con las mismas modalidades que en la cirrosis , aunque se desaconseja el uso de tratamiento de derivación portosistémica intrahepática transyugular debido a la falta de beneficio documentado.



No hay comentarios:
Publicar un comentario