| Atrofia muscular progresiva | |
|---|---|
| Otros nombres | Duchenne – atrofia muscular de Aran, otros. |
 | |
| Especialidad | Neurología |
La atrofia muscular progresiva ( PMA ) es un subtipo raro de enfermedad de la neurona motora (MND, por sus siglas en inglés) que afecta solo a las neuronas motoras inferiores . Se piensa que la PMA representa alrededor del 4% de todos los casos de MND. [1]Esto contrasta con la esclerosis lateral amiotrófica (ELA), la forma más común de MND, que afecta a las neuronas motoras superior e inferior , o esclerosis lateral primaria , otra variante rara de la MND, que afecta solo a las neuronas motoras superiores. La distinción es importante porque la PMA se asocia con un mejor pronóstico que la ELA clásica.
Signos y síntomas [ editar ]
Como resultado de la degeneración de la neurona motora inferior, los síntomas de la PMA incluyen:
Algunos pacientes tienen síntomas restringidos solo a los brazos o piernas (o, en algunos casos, solo uno de los dos). Estos casos se conocen como "Flail Arm" (FA) o "Flail Leg" (FL) y se asocian con un mejor pronóstico. [1]
Diagnóstico [ editar ]
La PMA es un diagnóstico de exclusión , no existe una prueba específica que pueda establecer de manera concluyente si un paciente tiene la condición. En su lugar, deben descartarse otras posibilidades, como la neuropatía motora multifocal o la atrofia muscular espinal . Las pruebas utilizadas en el proceso de diagnóstico incluyen RM , examen clínico y EMG . Las pruebas de EMG en pacientes que tienen AMP generalmente muestran denervación (muerte de la neurona) en la mayoría de las partes del cuerpo afectadas, y en algunas partes no afectadas también. [2]
Por lo general, lleva más tiempo diagnosticarse con PMA que con ALS, un promedio de 20 meses para PMA frente a 15 meses en ALS / MND.
El diagnóstico diferencial [ editar ]
En contraste con la esclerosis lateral amiotrófica o la esclerosis lateral primaria , la PMA se distingue por la ausencia de:
Pronóstico [ editar ]
La importancia de reconocer correctamente la atrofia muscular progresiva en oposición a la ELA es importante por varias razones.
- 1) El pronóstico es un poco mejor. Un estudio reciente encontró que la tasa de supervivencia a los 5 años en la AMP es del 33% (frente al 20% en la ELA) y la tasa de supervivencia a los 10 años del 12% (frente al 6% en la ELA). [1]
- 2) Los pacientes con PMA no sufren el cambio cognitivo identificado en ciertos grupos de pacientes con MND. [3]
- 3) Debido a que los pacientes con PMA no tienen signos de la UMN, por lo general no cumplen con la "Federación Mundial de Neurología El Escorial Criterios de Investigación" para la ALS "Definitiva" o "Probable", por lo que no son elegibles para participar en la mayoría de los ensayos de investigación clínicacomo Como ensayos de drogas o escáneres cerebrales. [1]
- 4) Debido a su rareza (incluso en comparación con ALS) y la confusión sobre la condición, es posible que algunas pólizas de seguro o pólizas locales de atención médica no reconozcan a la PMA como la enfermedad que cambia la vida. En los casos en que ser clasificado como PMA en lugar de ALS es probable que restrinja el acceso a los servicios, puede ser preferible que se diagnostique como ALS "lentamente progresiva" o ALS "con predominio de neuronas motoras inferiores ".
Un diagnóstico inicial de AMP podría ser ALS lentamente progresivo muchos años después, a veces incluso décadas después del diagnóstico inicial. La aparición de síntomas de neurona motora superior, como reflejos enérgicos, espasticidad o un signo de Babinski , indicaría una progresión a ALS; El diagnóstico correcto también se realiza ocasionalmente en la autopsia. [4] [5]
Historia [ editar ]
A pesar de ser más raro que la ALS, la PMA se describió anteriormente, cuando en 1850 el neurólogo francés François Aran describió 11 casos que denominó atrofia musculare progresiva . Neurólogo contemporáneo Guillaume-Benjamin-Amand Duchenne de Boulogne Inglés: / d ü ʃ del ɛ n / También afirmó haber descrito la condición 1 año antes, aunque nunca se encontró el informe escrito. [6] La condición se ha llamado atrofia muscular progresiva (PMA), [7] atrofia muscular espinal (SMA), [7] enfermedad de Aran-Duchenne, [6] [7]enfermedad de Duchenne-Aran,[6] Atrofia muscular de Aran-Duchenne, [7] y Atrofia muscular de Duchenne-Aran. El nombre de "atrofia muscular espinal" es ambiguo, ya que se refiere a cualquiera de varias atrofias musculares espinales , incluida la atrofia muscular espinal autosómica recesivacausada por un defecto genético en elgenSMN1 .
Enfermedad o síndrome [ editar ]
Desde su descripción inicial en 1850, ha habido un debate en la literatura científica sobre si la PMA es una enfermedad distinta con sus propias características, o si se encuentra en algún lugar de un espectro con ALS , PLS y PBP . Jean-Martin Charcot, quien describió por primera vez la ELA en 1870, consideró que la AMP era una condición separada, siendo la degeneración de las neuronas motoras inferiores la lesión más importante, mientras que en la ELA era la degeneración de la neurona motora superior la primaria, mientras que la degeneración de la neurona motora inferior era secundaria. Tales puntos de vista aún existen en términos arcaicos para la PMA, como "Atrofia muscular espinal progresiva primaria". A lo largo de finales del siglo 19, otras condiciones fueron descubiertos que previamente había sido pensado para ser PMA, tales como la parálisis pseudo-hipertrófica, hereditaria atrofia muscular , miopatía progresiva , distrofia muscular progresiva , periférica neuritis , y siringomielia . [6]
Los neurólogos Joseph Jules Dejerine y William Richard Gowers se encontraban entre los que creían que la PMA era parte de un espectro de "enfermedades de las neuronas motoras" que incluían ALS, PMA y PBP, en parte porque era casi imposible distinguir las condiciones en la autopsia. Otros investigadores han sugerido que la PMA es solo una ELA en una etapa más temprana de la progresión, porque aunque las neuronas motoras superiores no se ven afectadas en el examen clínico, de hecho hay signos patológicos detectables de daño de las neuronas motoras superiores en la autopsia. [6]
Además, no se ha vinculado ningún gen específicamente a PMA, y el trastorno no aparece en la base de datos de OMIM .
A favor de considerar la AMP como una enfermedad separada, algunos pacientes con AMP viven durante décadas después del diagnóstico, lo que sería inusual en la ALS típica. [6]
Hasta el día de hoy, la terminología en torno a estas enfermedades sigue siendo confusa porque en el Reino Unido , la enfermedad de las neuronas motoras se refiere tanto a la ELA específicamente como al espectro de ALS, PMA, PLS y PBP. En los Estados Unidos, los términos más comunes son ALS (específicamente para ALS y como término general ) o enfermedad de Lou Gehrig .
Casos notables [ editar ]
- Mike Gregory : ex capitán de la liga de rugby de Gran Bretaña y entrenador en jefe de Wigan RLFC
- Rob Rensenbrink - ex jugador de fútbol holandés y anderlecht
| Nefropatía diabética | |
|---|---|
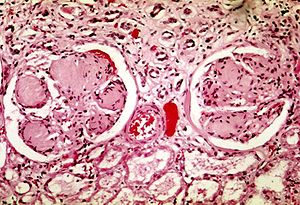 | |
| Dos glomérulos en la nefropatía diabética: las áreas acelulares de color púrpura claro dentro de los mechones capilares son los depósitos destructivos de la matriz mesangial. | |
| Especialidad | Endocrinología |
| Factores de riesgo | Presión arterial alta, glucemia inestable [1] |
| Metodo de diagnostico | Niveles anormales de albúmina urinaria [2] |
| Tratamiento | Inhibidores de la ECA [3] |
La nefropatía diabética ( DN ), también conocida como enfermedad renal diabética , [4] es la pérdida crónica de la función renal que ocurre en las personas con diabetes mellitus . La pérdida de proteínas en la orina debido al daño a los glomérulos puede llegar a ser masiva y causar una baja de albúmina sérica, con la consiguiente hinchazón generalizada del cuerpo (edema) y el síndrome nefrótico . Del mismo modo, la tasa de filtración glomerular (eGFR) estimada puede descender progresivamente desde una normal de más de 90 ml / min / 1.73m 2 a menos de 15 años, momento en el que se dice que el paciente tiene enfermedad renal en etapa terminal (ESKD). [5] Por lo general, es lentamente progresiva durante años. [6]
Las anomalías fisiopatológicas en el DN comienzan con niveles de glucosa en sangre mal controlados durante mucho tiempo. A esto le siguen múltiples cambios en las unidades de filtración de los riñones, las nefronas . (Normalmente hay alrededor de 750,000-1.5 millones de nefronas en cada riñón adulto). [7] Inicialmente, hay una constricción de las arteriolas eferentes y la dilatación de las arteriolas aferentes , con la hipertensión capilar glomerular resultante y la hiperfiltración; Esto cambia gradualmente a la hipofiltración con el tiempo. [8] Al mismo tiempo, hay cambios dentro del glomérulo en sí: incluyen un engrosamiento de la membrana basal , un ensanchamiento de las membranas de la hendidura de los podocitos, un aumento en el número de células mesangiales, y un aumento en la matriz mesangial. Esta matriz invade los capilares glomerulares y produce depósitos llamados nódulos de Kimmelstiel-Wilson. Las células y la matriz mesangiales pueden expandirse y consumir progresivamente todo el glomérulo, interrumpiendo la filtración. [9]
El estado de DN puede controlarse midiendo dos valores: la cantidad de proteína en la orina: proteinuria ; y un análisis de sangre llamado la creatinina sérica . La cantidad de proteinuria refleja el grado de daño a cualquier glomérulo en funcionamiento. El valor de la creatinina sérica se puede utilizar para calcular la tasa de filtración glomerular estimada (eGFR), que refleja el porcentaje de glomérulos que ya no filtran la sangre. [ cita requerida ]Tratamiento con un inhibidor de la enzima convertidora de angiotensina (IECA) o un bloqueador del receptor de la angiotensina (BRA), que dilata la arteriolaAl salir del glomérulo, se reduce la presión arterial dentro de los capilares glomerulares, lo que puede retardar (pero no detener) la progresión de la enfermedad. También se piensa que tres clases de medicamentos para la diabetes ( agonistas de GLP-1 , inhibidores de la DPP-4 e inhibidores de SGLT2 ) retardan la progresión de la nefropatía diabética. [10]
La nefropatía diabética es la causa más común de ESKD y es una complicación grave que afecta aproximadamente a una cuarta parte de los adultos con diabetes en los Estados Unidos. [11] [12] Las personas afectadas con enfermedad renal en etapa terminal a menudo requieren hemodiálisis y eventualmente trasplante de riñón para reemplazar la función renal fallida. [13] La nefropatía diabética se asocia con un mayor riesgo de muerte en general, en particular por enfermedades cardiovasculares .
Signos y síntomas [ editar ]
El inicio de los síntomas es de 5 a 10 años después de que comienza la enfermedad. [1] Un primer síntoma habitual es la micción frecuente en la noche: nicturia . Otros síntomas incluyen cansancio , dolores de cabeza , sensación general de enfermedad , náuseas , vómitos , micción frecuente durante el día, falta de apetito , picazón en la piel e hinchazón de las piernas . [1]
Factores de riesgo [ editar ]
La incidencia de nefropatía diabética es mayor en las personas con diabetes que tienen una o más de las siguientes afecciones: [1]
- Mal control de la glucosa en sangre.
- Presión arterial alta no controlada
- Diabetes mellitus tipo 1 , con inicio antes de los 20 años
- Cigarrillo pasado o actual.
- Antecedentes familiares de nefropatía diabética.
Fisiopatología [ editar ]
La fisiopatología del glomérulo en DN puede entenderse mejor considerando las tres células involucradas como una unidad: la célula endotelial , el podocito y la célula mesangial . Estas células están en contacto físico entre sí en varias ubicaciones dentro del glomérulo; También se comunican entre sí químicamente a distancia. Las tres células son anormales en DN. [9]
La diabetes causa una serie de cambios en el metabolismo del cuerpo y la circulación sanguínea , que probablemente se combinan para producir especies de oxígeno reactivo en exceso (moléculas químicamente reactivas que contienen oxígeno). Estos cambios dañan los glomérulos del riñón (redes de pequeños vasos sanguíneos ), lo que conduce a la característica distintiva de la albúmina en la orina (llamada albuminuria ). [15] A medida que avanza la nefropatía diabética, una estructura en los glomérulos conocida como barrera de filtración glomerular (GFB) se daña cada vez más. [11] Esta barrera se compone de tres capas, incluido el endotelio fenestrado., la membrana basal glomerular , y los podocitos epiteliales . [11] El GFB es responsable de la filtración altamente selectiva de la sangre que ingresa a los glomérulos del riñón y normalmente solo permite el paso de agua, moléculas pequeñas y proteínas muy pequeñas (la albúmina no pasa a través del GFB intacto). [11] El daño a la membrana basal glomerular permite que las proteínas en la sangre se filtren, lo que lleva a la proteinuria. La deposición de cantidades anormalmente grandes de matriz mesangial causa nódulos positivos de ácido periódico llamados nódulos de Kimmelstiel-Wilson. [dieciséis]
Nivel alto de azúcar en la sangre , que conduce a la formación de productos finales de glicación avanzada ; y las citoquinas también se han implicado como mecanismos para el desarrollo de la nefropatía diabética. [17]
Diagnóstico [ editar ]
El diagnóstico se basa en la medición de niveles anormales de albúmina urinaria en un diabético [2] junto con la exclusión de otras causas de albuminuria. Las mediciones de albúmina se definen de la siguiente manera: [18]
-
-
-
-
-
-
-
-
-
-
- Albuminuria normal : excreción urinaria de albúmina <30 24h="" font="" mg="">
- Microalbuminuria : excreción urinaria de albúmina en el rango de 30-299 mg / 24 h;
- Macroalbuminuria : excreción urinaria de albúmina ≥300 mg / 24h.
-
-
-
-
-
-
-
-
-
Se recomienda que los diabéticos tengan sus niveles de albúmina controlados anualmente, comenzando inmediatamente después del diagnóstico de diabetes tipo 2 y cinco años después del diagnóstico de diabetes tipo 1. [2] [19] Las imágenes médicas de los riñones, generalmente por ecografía , se recomiendan como parte de un diagnóstico diferencial si existe una sospecha de obstrucción del tracto urinario , infección del tracto urinario o cálculos renales o enfermedad renal poliquística . [20]
| Etapa de ERC [21] | Nivel de eGFR (mL / min / 1.73 m 2 ) |
|---|---|
| Nivel 1 | ≥ 90 |
| Etapa 2 | 60–89 |
| Etapa 3 | 30–59 |
| Etapa 4 | 15–29 |
| Etapa 5 | <15 font=""> |
Puesta en escena [ editar ]
Para determinar el grado de daño en esta (y cualquier) enfermedad renal, se determina la creatinina sérica y se utiliza para calcular la tasa de filtración glomerular estimada ( eGFR ). La eGFR normal es igual o superior a 90 ml / min / 1,73 m 2 . [22]
Tratamiento [ editar ]
Los objetivos del tratamiento son reducir la progresión del daño renal y controlar las complicaciones relacionadas. El tratamiento principal, una vez que se establece la proteinuria, son los medicamentos inhibidores de la ECA , que generalmente reducen los niveles de proteinuria y disminuyen la progresión de la nefropatía diabética. [3] Otras cuestiones que son importantes en el manejo de esta afección son el control de la presión arterial alta y los niveles de azúcar en la sangre (ver manejo de la diabetes ), así como la reducción de la ingesta de sal en la dieta. [23]
Pronóstico [ editar ]
La nefropatía diabética en la diabetes tipo 2 puede ser más difícil de predecir debido a que el inicio de la diabetes generalmente no está bien establecido. Sin intervención, 20 a 40 por ciento de los pacientes con diabetes tipo 2 / microalbuminuria, evolucionarán a macroalbuminuria. [24]
La nefropatía diabética es la causa más común de enfermedad renal en etapa terminal , [11] [12] que puede requerir hemodiálisis o incluso trasplante de riñón . [13] Se asocia con un mayor riesgo de muerte en general, especialmente por enfermedades cardiovasculares . [11] [14]
Epidemiología [ editar ]
En los EE. UU., La nefropatía diabética afectó a aproximadamente 6,9 millones de personas durante 2005–2008. [25] Se espera que la cantidad de personas con diabetes y, en consecuencia, la nefropatía diabética aumente sustancialmente para el año 2050.

No hay comentarios:
Publicar un comentario