La gravimetría es un método analítico cuantitativo, es decir, que determina la cantidad de sustancia, midiendo el peso de la misma (por acción de la gravedad).
Gravimetría por precipitación
Generalmente se trata de gravimetría por precipitación, donde una substancia muy poco soluble que está relacionada (directa o indirectamente) con el compuesto a analizar (analito) se separa de la soluciónoriginal, se filtra, se seca o calcina y en base al peso de la susbtancia que queda (residuo) se calcula la cantidad de analito buscado.
Reactivo precipitante
El reactivo o agente precipitante es una solución lo más diluida posible pero de una concentración aproximada, a la que se le debe agregar siempre un ligero exceso por dos razones:
- Para asegurarse de que la reacción ha sido total.
- Para disminuir la solubilidad del precipitado. Por efecto ion común, el precipitado es más insoluble en una solución que contenga un ion común con él, que con agua pura.
La reacción química que va a servir de base para el análisis debe dar un precipitado que debe cumplir con una serie de condiciones:
- Deberá ser cuantitativo: Estrictamente ésto pocas veces es posible, pero la diferencia entre la cantidad real obtenida y la estequeometría deberá ser menor que la sensibilidad de la balanza (no deberá ser detectable por métodos ordinarios de pesada).
- Deberá estar libre de impurezas: Estricatamente, tampoco es posible; siempre hay algún fenómeno de adsorción y/o absorción de otros iones que tienden a impurificar la muestra. Se procura limitar la impurificación a un mínimo compatible con la presición que se busca.
- Deberá ser fácil de filtrar ya sea por papel de filtro analítico cuantitativo del tamaño de poro adecuado, por crisol de Gooch (éstos para calcinar), crisol de vidrio, de cuarzo ó de porcelana sinterizados (éstos últimos exclusivamente para precipitados que van a ser secados).
- Deberá ser fácil de lavar sin que haya pérdidas por solubilidad apreciables.
Secuencia práctica de un análisis gravimétrico
- Toma de muestra y pesada por duplicado.
- Disolución.
- Toma de porción alícuota (si corresponde).
- Dilución.
- Ajuste del pH y de la temperatura previo a la precipitación.
- Adición del reactivo o agente precipitante en solución lo más diluida posible, bajo constante agitación.
- Adición de un ligero exceso, previo a comprobación.
- Agitación con varila de vidrio.
- Digestión del precipitado.
- Filtración.
- Lavado del precipitado.
- Control del líquido de lavado: La ausencia de un ion tomado como referencia nos indica el final del lavado.
- Lavado final.
- Introducción del papel de filtro con el precipitado, en el crisol de porcelana previamente tarado.
- Quemado del papel a baja temperatura, sin que arda.
- Calcinación en mufla hasta peso constante.
- Se coloca el crisol con residuo en el desecador para que tome temperatura ambiente.
- Pesado del crisol con el residuo.
- Cálculos.
- Expresión final del resultado del análisis en % p/p, %p/v, %g/l, ppm, o lo que corresponda.
Digestión del precipitado
Normalmente consiste en dejar el precipitado a baño María un par de horas; otras veces (como en el caso de determinación de fosfatos), le sigue un reposo en heladera aproximadamente de 3 ºC a 4 ºC por algunas horas más.
Durante la digestión el precipitado va purificándose. Deja en las aguas madres los iones que lo impurifican (que eran impurezas adsorbidas). A la vez que se va formando la red cristalina del precipitado, los cristales se perfeccionan, se "sueldan", y forman cristales de mayor tamaño, que presentan mejor filtrabilidad, y además, no ocluyen la trama del filtro.
Filtración
Si el producto de la precipitación va a ser calcinado se usa papel de filtro analítico cuantitativo de diámetro apropiado para cada tipo de embudo.
Lavado
El lavado tiene como objeto liberar al precipitado de las substancias que lo acompañan y que forman parte de la solución madre.
La solución de lavado consiste en una solución diluida de un electrolito que tenga un ion común con el precipitado, para minimizar pérdidas por solubilidad; otras veces se lava con agua caliente. Nunca un precipitado debe lavarse con agua fría porque se produce peptización.
Cálculos y expresión del resultado
Un método muy utilizado en gravimetría es el factor gravimétrico, principalmente cuando se realiza la misma determinación, sobre distintas muestras; que consiste en el producto entre la relación de masas moleculares de la substancia buscada y la pesada, y su relación estequiométrica.

Por ejemplo si queremos expresar el resultado como Fe3O4, y pesamos Fe2O3, pero sabemos que la relación estequiométrica es 2:3 respetivamente.

Si queremos expresar el resultado como % m/m (porcentaje masa en masa, es decir gramos de analito, por cada 100 g de muestra), debemos realizar el siguiente cálculo. 

La gravimetría consiste en la medición del campo de gravedad. Se suele emplear cuando el objeto de estudio es el campo de gravedad o las variaciones de densidad responsables de su variación.
Unidades de medida
La gravedad se suele medir en unidades de aceleración. En el sistema SI la unidad de aceleración corresponde a 1 metro por segundo al cuadrado (simbolizándose: m/s2). También puede expresarse en las unidades propias del campo gravitatorio, es decir en Newton por kilogramo (N/kg). Otra unidad empleada, sobre todo en gravimetría, es el gal que equivale a 1 centímetro por segundo al cuadrado (cm/s2).
Gravímetros
Los instrumentos empleados para realizar mediciones de la gravedad se denominan gravímetros o gradiómetros. La mayor parte de los gravímetros emplean resortes cuyo efecto se opone a la fuerza de gravedad que actúa sobre una masa. Existen dos clases de gravímetros:
- Gravímetros absolutos: permiten conocer el valor de g directamente mediante la determinación de una longitud y/o un tiempo. Los primeros instrumentos absolutos fueron de tipo pendular, actualmente son de caída libre.
- Gravímetros relativos: estos instrumentos únicamente permiten conocer la diferencia relativa de g entre dos puntos o entre dos tiempos.
Péndulos
Son los gravímetros más antiguos y pueden ser tanto relativos como absolutos.
Péndulo matemático
Un péndulo matemático es un péndulo ficticio. Está formado por una masa puntual m sujeta por un hilo de masa despreciable y longitud l, que puede oscilar sin fricción en torno a su punto de suspensión o pivote. El movimiento de la masa está restringido a describir un arco circular alrededor del punto de equilibrio. La coordenada para un punto de la trayectoria es  , donde
, donde 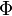 es el ángulo de deflección del hilo.
es el ángulo de deflección del hilo.
 , donde
, donde 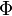 es el ángulo de deflección del hilo.
es el ángulo de deflección del hilo.
La atracción de la gravedad g ejerce una fuerza sobre la masa. Si la masa no se encuentra en equilibrio existirá una componente tangencial  dirigida hacia la posición de equilibrio. La aceleración de la masa se puede obtener derivando dos veces
dirigida hacia la posición de equilibrio. La aceleración de la masa se puede obtener derivando dos veces  . La ecuación de movimiento resulta:
. La ecuación de movimiento resulta:
 dirigida hacia la posición de equilibrio. La aceleración de la masa se puede obtener derivando dos veces
dirigida hacia la posición de equilibrio. La aceleración de la masa se puede obtener derivando dos veces  . La ecuación de movimiento resulta:
. La ecuación de movimiento resulta:
donde se utilizó la aproximación para ángulos pequeños. Esta ecuación corresponde a la de un oscilador armónico. Su solución general es  . En este caso es importante la expresión de la frecuencia
. En este caso es importante la expresión de la frecuencia  que es la base de las mediciones de gravedad:
que es la base de las mediciones de gravedad:
 . En este caso es importante la expresión de la frecuencia
. En este caso es importante la expresión de la frecuencia  que es la base de las mediciones de gravedad:
que es la base de las mediciones de gravedad:
Por lo tanto es posible conocer el valor de g simplemente conociendo la longitud del péndulo y su período de oscilación:
Una determinación de g llevada a cabo de esta forma representaría una medición absoluta.
A partir de esta expresión es posible estimar los errores absolutos y relativos al calcular g.
El error absoluto será:
El error relativo estará dado por:
Si se desea incluir en la expresión de g la deflexión inicial  , no deben ser despreciados los términos no lineales en
, no deben ser despreciados los términos no lineales en  . La forma de resolver esta última ecuación incluyendo los términos no lineales es mediante integrales elípticas. El período de oscilación resulta:
. La forma de resolver esta última ecuación incluyendo los términos no lineales es mediante integrales elípticas. El período de oscilación resulta:
 , no deben ser despreciados los términos no lineales en
, no deben ser despreciados los términos no lineales en  . La forma de resolver esta última ecuación incluyendo los términos no lineales es mediante integrales elípticas. El período de oscilación resulta:
. La forma de resolver esta última ecuación incluyendo los términos no lineales es mediante integrales elípticas. El período de oscilación resulta:
- Método por precipitación: Técnica analítica clásica que se basa en la precipitación de un compuesto de composición química conocida tal que su peso permita calcular mediante relaciones, generalmente estequiométricas, la cantidad original de analito en una muestra.En este tipo de análisis suele prepararse una solución que contiene al analito ya que éste está en solución madre, a la que posteriormente se agrega un agente precipitante, que es un compuesto que reacciona con el analito en la solución para formar un compuesto de muy baja solubilidad. Posteriormente se realiza la separación del precipitado de la solución madre empleando técnicasEn este método el analito es convertido en un precipitado poco soluble, luego se filtra, se purifica, es convertido en un producto de composición química conocida y se pesa.Para que este método pueda aplicarse se requiere que el analito cumpla ciertas propiedades:
- Baja solubilidad
- Alta pureza al precipitar
- Alta filtrabilidad
- Composición química definida al precipitar
Método por volatilización: En este método se miden los componentes de la muestra que son o pueden ser volátiles. El método será directo si evaporamos el analito y lo hacemos pasar a través de una sustancia absorbente que ha sido previamente pesada así la ganancia de peso corresponderá al analito buscado; el método será indirecto si volatilizamos el analito y pesamos el residuo posterior a la volatilización así pues la pérdida de peso sufrida corresponde al analito que ha sido volatilizado.El método por volatilización solamente puede utilizarse si el analito es la única sustancia volátil o si el absorbente es selectivo para el analito.Método por electrodeposición: Este método se basa en la deposición sobre un electrodo de un compuesto de relación conocida con el analito que se requiere cuantificar. La cuantificación se realiza mediante la diferencia de peso que se produce en los electrodos antes y después de realizar una reacción redox en la solución problema, que se moldea ocasionando la precipitación del analito o de un compuesto formado por el mismo.






No hay comentarios:
Publicar un comentario