Anticuerpos
Un anticuerpo monocatenario, fragmento Fv monocatenario o scFv es la fusión de las regiones variables de las cadenas pesada y ligera de lasinmunoglobulinas, unidas mediante un péptido conector. Éste está formado habitualmente por residuos de glicina (para aportarle flexibilidad) y de serina otreonina para darle solubilidad.
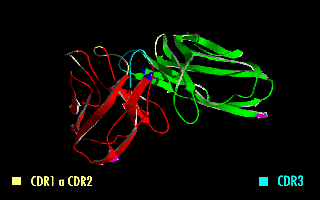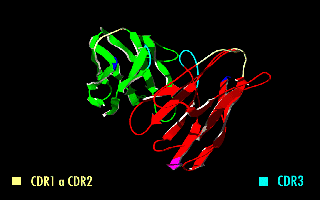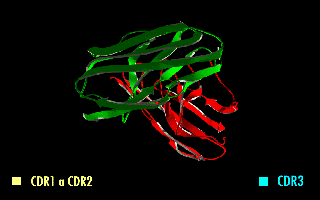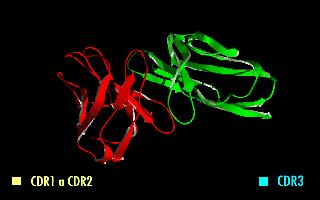
Esta molécula quimérica mantiene la especificidad de la inmunoglobulina original, a pesar de la eliminación de las regiones constantes y la introducción del péptido conector. La imagen de la derecha muestra cómo estas modificaciones dejan inalterada la estructura de la región del anticuerpo que reconoce el antígeno.
Estas moléculas se crearon originalmente para facilitar la confección debibliotecas de expresión en fago (phage display) donde es muy conveniente expresar el dominio de unión al antígeno como un único péptido. Por otra parte, los scFv se pueden crear directamente a partir de cadenas ligeras y pesadassubclonadas, derivadas de un hibridoma.
Los scFv tienen muchas aplicaciones, como la citometría de flujo, la inmunohistoquímica o como dominios de unión a antígeno dereceptores artificiales de linfocitos T.
Anticuerpos monoclonales de segunda generación
Anticuerpos quiméricos | Anticuerpos humanizados | Moléculas recombinantes derivadas de Ac | Fragmentos de Ac | Single chain Fv (scFv) | Expresión de repertorios de Ac en fago lambda | Desplegamiento de repertorios de Ac en fagos filamentosos | "Diabodies", anticuerpos biespecíficos y "triabodies" | Minibodies | Anticuerpos "camélidos" | Proteínas de fusión
Como se mencionó, los AcMo de segunda generación, o anticuerpos recombinantes (AcR), son moléculas producidas empleando técnicas de biología molecular y ADN recombinante. Dicho de otra manera, los AcR son generados a través de la inmortalización de los genes que codifican a la molécula de Ig, en lugar de inmortalizar la célula productora del Ac, como es el caso para los AcMo de primera generación.
La concepción, el diseño y la ingeniería de moléculas artificiales, basadas en Ig, se ha facilitado enormemente gracias a dos características de estas proteínas. A nivel genético, los genes estructurales que codifican las Ig se prestan para hacer el trabajo de biología molecular. Estos genes se organizan en la forma de exones discretos, los cuales corresponden a dominios completos en la proteína (Figura 2B), encontrándose separados por regiones intrónicas. Resulta así, por ejemplo, relativamente fácil manipular las secuencias intrónicas para añadir cambios que permitan la introducción en el gen de nuevas secuencias en lugares específicos, seleccionados previamente, sin implicar riesgo alguno de alterar la secuencia codificadora presente en los exones. De igual manera, a nivel proteico, la organización estructural-funcional de las Ig en la forma de estos módulos discretos, llamados dominios, en donde se encuentra almacenada la información necesaria para realizar una función específica, ha facilitado enormemente el logro de estos objetivos. Sin embargo, un elemento adicional, que no se puede dejar de mencionar y que ha tenido un impacto tremendo en el desarrollo de los AcR, lo constituyen, sin lugar a dudas, los avances ocurridos en el campo de la biología molecular, especialmente en lo relacionado con el desarrollo de métodos para la creación de moléculas de ADN recombinante basados en la reacción, en cadena, de polimerasa (PCR).
De esta forma, es hoy posible clonar una pareja de regiones VH y VL, responsables de una especificidad de interés, y ensamblarla en la forma de un anticuerpo funcional en el contexto de, prácticamente, cualquier clase o subclase de Ig humana (72). Un número considerable de sistemas de expresión están actualmente disponibles para este fin (18). Varias líneas celulares eucariotas soportan apropiadamente los procesos asociados a la expresión, síntesis, ensamblaje y modificaciones post-traducción de los AcR (103). En el ámbito de los organismos procariotas, es digno de mencionar cómo el conocimiento detallado que poseemos del genoma, arquitectura y ciclo de vida de bacteriófagos filamentosos (89, 92) y del fago lambda (11, 24) ha permitido la expresión eficiente de ADN codificante de Ac en E. coli (48, 68). Esto, a su vez, ha permitido el desplegamiento, en estos fagos, de repertorios gigantescos de Ac (88, 105) y con ello, la posibilidad de imitar artificialmente la estrategia de selección empleada por el sistema inmune humoral. En la actualidad, esta tecnología de desplegamiento de Ac en fagos filamentosos ofrece una de las vías más poderosas para la creación de Ac humanos artificiales con inmunogenicidad reducida y para la creación de repertorios de Ac en la forma de genotecas combinatorias con una talla similar o igual a la de los repertorios naturales.
Los AcR constituyen, entonces, un conjunto bastante heterogéneo de proteínas artificiales en el que se pueden distinguir dos grandes grupos. El primero incluye moléculas completas de Ac, similares a las conseguidas en forma natural, en las cuales están presentes los dos elementos estructurales, permitiendo así la funcionalidad de la molécula; esto es, las porciones Fab y Fc (Figura 2A). Los Ac quiméricos y humanizados son ejemplos representativos de este grupo. El otro grupo está formado por un conjunto más heterogéneo de proteínas noveles, basadas en la estructura de las Ig. Éstas pueden encontrarse en la forma de entidades recombinantes autónomas (fragmentos tipo Fab, Fv de cadena sencilla -scFv-, "diabodies", "triabodies", etc.), o como proteínas de fusión (moléculas en las que se combina la porción Fc o Fab con propiedades nuevas provistas por una toxina, una enzima, un receptor celular, una citoquina, etc.).
Un anticuerpo quimérico (AcQ) es una molécula artificial en la cual, las porciones constantes de las cadenas pesada y liviana provienen de una Ig humana y las regiones variables VH y VL son obtenidas de un AcMo múrido (Figura 5). El objetivo perseguido con la construcción de un AcQ es reducir la inmunogenicidad para el humano de los AcMo de ratón o rata, pero sin afectar la especificidad del Ac. Es conocido que las porciones más inmunogénicas de la molécula de Ig están asociadas a la porción constante de la molécula, en particular a la región Fc (115). Al reemplazar estas regiones por las equivalentes de origen humano se busca que la molécula resultante sea menos "extraña" para los seres humanos y así facilitar su uso in vivo para la profilaxis y tratamiento de enfermedades humanas (Figura 5). Adicionalmente, ya que la fisiología, catabolismo y las funciones efectoras de un Ac están asociadas al fragmento Fc, los AcQ debieran comportarse en forma óptima al ser administrados en humanos.
La técnica de "quimerización" fue desarrollada por Morrison y col. (73) y Boulliane (7) a mediados de los años 80. El procedimiento implica la clonación de los genes VH y VL múridos y la inserción de los genes clonados en vectores de expresión eucariota a los que, previamente, se ha incorporado los genes codificadores de la porción constante de las cadenas pesada y liviana humanas. Estos vectores son finalmente transfectados en forma estable en una línea celular seleccionada. La clonación de los genes VH y VL se realiza mediante RT-PCR (Figura 5) utilizando como molde ARN total o ARN mensajero (ARNm) obtenido de un hibridoma secretor de la especificidad de interés y oligonucleótidos complementarios a los extremos 3’ y 5’ de cada gen como iniciadores. En la actualidad, se encuentran disponibles familias de oligonucleótidos para la clonación de los genes VH y VL del ratón, del humano y otras especies. Estas familias son capaces de amplificar la mayoría, sino la totalidad, de los genes V funcionales de estas especies y, usualmente, contienen sitios de reconocimiento para enzimas de restricción, las cuales facilitan la identificación, manipulación e inserción en los vectores de expresión de los genes V amplificados por PCR (2, 12, 19, 30, 58-60, 66, 80, 93, 95, 111, Montaño y Morrison). Una serie de vectores tipo "cassette" están disponibles donde los genes V pueden ser fácilmente clonados en el contexto de cualquier isotipo de cadena liviana y pesada humana (18, Montaño y Morrison). De forma similar, avances en el campo de la tecnología de transferencia de genes también han facilitado, y hecho más eficiente, el proceso de inserción de ADN foráneo en diferentes líneas celulares eucariotas.
En los trabajos pioneros antes citados, se demostró que los AcQ, ensamblados apropiadamente, son capaces de reconocer y ligar el antígeno y median, eficientemente, funciones efectoras como activación de complemento y reconocimiento de receptores Fc (7, 73). Más aún, al compararse con los monoclonales equivalentes, se pudo documentar una reducción de la inmunogenicidad (63). A partir de allí, AcQ con una gran variedad de especificidades han sido preparados (72). Algunos ejemplos exitosos en el ámbito clínico lo constituyen los productos ReoPro o abciximab (desarrollado por las compañías Centocor y Eli Lilly), IDEC-CD28 o rituximab (desarrollado por IDEC Pharmaceuticals y Genentech), e infliximab (desarrollado por Centocor). ReoPro es el fragmento Fab de un AcQ ratón-humano con especificidad por la glicoproteína GPIIb/IIIa de plaquetas y es usado en la prevención de la isquemia cardíaca aguda que puede ocurrir luego de una angioplastia coronaria. IDEC-CD28 es un AcQ ratón-humano anti-CD20, el cual se utiliza para el tratamiento de linfomas de células B del tipo no-Hodgkin. Finalmente, Infliximab es un AcQ anti-TNFa que ha mostrado efectividad en el tratamiento de la enfermedad de Crohn (75).
En los AcQ las regiones V múridas se mantienen inalteradas de forma que la especificidad y la afinidad de la molécula resultante no se afectan. Desgraciadamente, algunas moléculas quiméricas aún son capaces de inducir una respuesta inmune humoral cuando son administradas en humanos. Esta inmunogenicidad "residual" ha sido atribuida a la presencia de epitopos foráneos presentes en las RDC y en las regiones M de los dominios V múridos del AcQ (1,10).
Un paso adelante en los esfuerzos para reducir la inmunogenicidad de los AcMo múridos, lo constituyó la creación de los Ac humanizados (AcH). La tecnología para la producción de AcH fue desarrollada en el laboratorio de G. Winter en Inglaterra poco después de la invención de los AcQ (52) y, en la actualidad, engloba un conjunto de procedimientos (47) tales como "CDR grafting" (transplante de CDR), "Ab reshaping" (106) y "Ab resurfacing/veneering" (81). El argumento que la soporta se basa en el supuesto de que el sitio de combinación al antígeno, el paratopo, se forma a partir de la combinación espacial de las asas hipervariables que corresponden a las RDC, mientras que las regiones M sólo funcionan como un andamio cuya única función es servir de soporte estructural al paratopo. Asumiendo esto como cierto en la elaboración de un AcH, las RDC de un anticuerpo múrido son transplantados en el contexto de regiones M humanas (Figura 6A), formándose así una región V híbrida ratón-humano y confiriéndole la especificidad deseada a una molécula que en el resto de su estructura es completamente humana. La ventaja de esto es que los epitopos asociados a las regiones M múridas, los cuales están presentes en los AcQ, no se encuentran en los AcH.
Para producir un AcH es necesario conocer la secuencia entera de los dominios V múridos y la localización de las secuencias de ADN correspondientes a las 3 RDC múridas. Esta información se usa para diseñar y crear genes V sintéticos en los cuales, las RDC múridas son combinadas con regiones M humanas seleccionadas, cuidadosamente, en función de su parecido con las correspondientes regiones M múridas. A continuación, los genes V "humanizados" se insertan en vectores de expresión adecuados que contienen el resto de la información estructural necesaria para la síntesis de una cadena Ig humana liviana o pesada. El resto de la técnica es similar, a lo ya descrito, para los AcQ.
Hay dos aspectos que pudieran considerarse desventajosos en la producción de un AcH. En primer lugar, la manipulación de las RDC múridas y su inserción en el contexto de regiones M humanas, por lo general, conlleva a una disminución de la afinidad del Ac. (47,115). Ello se debe a que las regiones M no son sólo andamios; ellas juegan un rol determinante en el arreglo tridimensional de las RDC (28, 54, 94). Además, en algunos casos se ha demostrado la participación directa de ciertos residuos de aminoácido de las regiones M en la combinación con el epitopo (87). El otro aspecto tiene que ver con la complejidad de la técnica. Mientras que producir un AcQ es un procedimiento relativamente expedito, la creación de un AcH es, comparativamente, más laborioso, consume un tiempo considerable y es un proceso en el cual el mantenimiento de la afinidad depende, en último término, del ensayo y error (86). En todo caso, el objetivo fundamental perseguido por la producción de un AcH (eliminaÿ la inmunogenicidad del Ac múrido) no siempre es alcanzado. Se ha reportado cierta inmunogenicidad "residual" en moléculas de Ac completamente humanizadas, ello debido, aparentemente, a epitopos asociados con el idiotipo del Ac (36).
No obstante, un número sustancial de regiones V múridas han sido humanizadas (47, 115). Entre ellas mencionaremos a los Ac daclizumab y basiliximab, dos AcH con especificidad por la cadena a del receptor de la citoquina humana IL-2. Ambos han sido probados exitosamente en la prevención del rechazo agudo de alotransplantes de riñón (25, 79). Estos Ac se encuentran actualmente en el mercado bajo los nombres Zenapax (dacliximab de Roche) y Simulect (basiliximab de Novartis Pharmaceuticals Corp). Otro ejemplo es trastuzumab (disponible comercialmente bajo el nombre de Herceptin de Genentech, USA), el cual es un AcH anti-HER2-Neu que ha mostrado efectividad en el tratamiento de cáncer de mama en los cuales se sobreexpresa la oncoproteína HER2-Neu (96).
Hasta este punto, hemos tratado la producción de moléculas completas de anticuerpos recombinantes. Adicionalmente, la biología molecular ha sido utilizada para desarrollar moléculas noveles, basadas en la estructura de Ac, ya sea como entidades recombinantes autónomas o como proteínas de fusión. A continuación, revisaremos los ejemplos más significativos de este tipo de moléculas, las maneras como ellas fueron creadas y sus aplicaciones potenciales.
Mientras la expresión de AcQ y AcH se logra más fácilmente en hospedadores eucariotas, tales como células de mamífero (74) o de plantas (65), la bacteria es el huésped preferido para la producción de fragmentos recombinantes de Ac (84). En virtud de las ventajas indiscutibles que ofrece en cuanto a manipulación, transformación, cinética de crecimiento y condiciones de fermentación, E. coli es en la actualidad el sistema de expresión más accesible y amigable para la producción de fragmentos de Ac.
Existen dos tipos de fragmentos con la capacidad de combinarse al Ag, éstos son el Fv y el Fab (Figura 2A). Versiones funcionales de Fv y Fab fueron producidos en forma recombinante, por vez primera, en E. coli en 1988 (5, 97). Estos trabajos marcaron un hito en la producción de AcR, pues en ellos se demostró que la expresión en el espacio periplásmico de la bacteria permite la obtención, en forma relativamente sencilla, de moléculas de Ac completamente funcionales y con un alto rendimiento. Hasta ese momento, la mayor parte de los intentos persiguieron la expresión intra-citoplasmática, enfrentándose al problema del microambiente intracelular de la bacteria, el cual no es apropiado para el procesamiento post-traducción [plegamiento, formación de puentes disulfuro y glicosilación asociada a residuos de asparagina ("N-lynked") o serina-treonina ("O-lynked")] de las cadenas polipeptídicas nacientes. Esto trae como consecuencia la formación de cuerpos de inclusión en el citoplasma de la bacteria que contienen la proteína en una forma no funcional y de los cuales la recuperación es bastante ineficiente. La expresión de fragmentos de Ac en el periplasma de la bacteria, por el contrario, sigue una vía de ensamblaje similar a la que ocurre durante la producción de Ac convencionales en el retículo endoplásmico de una célula B (84). Ello permite producir moléculas activas en un pequeño volumen y en un compartimiento subcelular, el cual está relativamente libre de enzimas proteolíticas activas.
1988 fue un año importante para la producción de AcR, no sólo por la aparición de los trabajos en los que se describió la expresión periplásmica como una vía eficiente para la producción de AcR en bacterias. Dos artículos fueron publicados ese mismo año en los cuales se reportó la producción en E. coli de una versión recombinante del fragmento Fv en la que los dominios VH y VL se encontraban unidos físicamente a través de un "linker" peptídico, pequeño y flexible (6, 49). Este "linker" (~ 15 aminoácidos) tiene la longitud y flexibilidad necesarias para permitir el arreglo espacial adecuado de los dominios VH y VL, generándose un Fv funcional (Figura 6B). Tales construcciones fueron denominadas Fv de cadena sencilla (del inglés single chain Fv, scFv), son más estables, en comparación con el Fv convencional, y conservan la capacidad de reconocer y ligar Ag. Posteriormente, scFv han sido expresados en otros hospedadores además de E. coli, como la levadura P. pastoris (64), hongos filamentosos (29), células de insecto (43) y células de mamífero (91), convirtiéndose en uno de los formatos preferidos para producir fragmentos recombinantes de Ac con capacidad para ligar Ag (116), para preparar proteínas de fusión en las que se desea especificidad antigénica (39) y para construir genotecas de Ac (88).
La construcción de genotecas de Ac es un aspecto que merece atención especial, pues ha permitido la generación de repertorios de Ac cuya talla y diversidad hace presumir que la totalidad del repertorio natural se encuentra contenida en ellas. La utilización del bacteriófago l y, posteriormente, de bacteriófagos filamentosos como vectores ha sido la clave en la construcción de estas gigantescas y versátiles genotecas.
En 1989 fue publicado el primer artículo donde se describe la construcción de una genoteca de ADNc conteniendo el repertorio completo de Ig del ratón (48). Para ello se utilizó como formato el fragmento Fab y un sistema de expresión que combinaba el bacteriófago lambda (l ) como vector y la bacteria E. coli como hospedador. La estrategia ideada utilizó ARNm obtenido del bazo de un ratón inmunizado. Este ARNm sirvió de materia prima para la preparación, mediante amplificación por RT-PCR, de dos genotecas separadas, una de genes codificantes de cadenas livianas y la otra compuesta por segmentos génicos codificantes de fragmentos Fd (VHCH1). Cada genoteca fue clonada por separado en vectores de fago l diferentes y luego el ADN de estos fagos fue combinado en forma aleatoria para así construir una genoteca combinatoria de fragmentos Fab compuesta por 107 clones aproximadamente, entre los cuales fue posible demostrar la presencia de numerosos clones Ag-específicos. En una forma similar, se ha logrado construir genotecas de Ac humanos de las cuales se han aislado fragmentos de Ac con especificidad por la hemaglutinina del virus influenza (14), el toxoide tetánico (76), la peroxidasa tiroidea (85) y el antígeno de grupo sanguíneo Rh(D) (112), entre otros.
Ya que posee una alta eficiencia de ensamblaje y una elevada rata de infección, el bacteriófago l ofrece ventajas para la construcción de genotecas de Ac en comparación con otros vectores tales como plásmidos convencionales. No obstante, no pasó mucho tiempo antes de encontrarse una forma más conveniente de explotar estas y otras propiedades de los fagos. Dicha forma involucra la utilización de fagos filamentosos, en lugar del fago l , en la construcción de las genotecas de Ac.
Los fragmentos de Ac, obtenidos a partir de una genoteca basada en el fago l , se encuentran en forma soluble en el medio de cultivo en el cual crecen las bacterias infectadas por el fago. Aunque la identificación y selección de fagos productores de una especificidad determinada se puede lograr mediante repetidos procesos de clonamiento y "screening", esto constituye un trabajo arduo que puede tomar un tiempo considerable.
Cuando la tecnología de desplegamiento de proteínas en la superficie de fagos filamentosos recombinantes (98) se aplicó a la expresión de fragmentos de Ac (68) ocurrió una auténtica revolución en el campo de los AcR. La expresión de sitios de combinación con el antígeno (en la forma de scFv o Fab) en la superficie de un fago filamentoso le confiere al fago recombinante la capacidad de ligar el Ag en cuestión. Esto implica que en una población heterogénea, los escasos fagos que expresen la especificidad deseada pueden ser seleccionados y aislados mediante un procedimiento sencillo de "panning" o inmunopurificación (Figura 7), utilizando el Ag de interés como elemento de captura. Como se trata de partículas virales infectivas, los fagos así obtenidos pueden utilizarse para reinfectar nuevas bacterias y producir poblaciones de fagos cada vez más clonales.
Luego de un número reducido de ciclos de inmunopurificación-infección es posible obtener una población, virtualmente clonal, de fagos expresando una única especificidad. De esta forma, es relativamente fácil pasar de una población altamente heterogénea (una genoteca que alberga el repertorio de Ig de una especie, por ejemplo) a una población virtualmente homogénea que expresa una única especificidad. En consecuencia, las genotecas de Ac basadas en fagos filamentosos son superiores a las basadas en el fago l porque ofrecen una mayor facilidad para la realización del despistaje y aislamiento de especificidades de interés. La clave del éxito está en que el sistema de expresión en fagos filamentosos permite la asociación física entre la proteína (el fenotipo) y la información genética que la codifica (el genotipo).
Los fagos utilizados en esta tecnología son los colifagos filamentosos M13, fd y f1. Éstos son virus de ADN circular de cadena sencilla, capaces de infectar bacterias E. coli macho, las cuales el episoma F¢ . Dichos fagos poseen una cubierta proteica en la que destacan dos proteínas, la pVIII y la pIII. Ambas han sido utilizadas para la expresión de fragmentos de Ac. pVIII es la subunidad estructural más importante de la cubierta (más de 2000 copias por partícula viral). Mientras tanto, pIII es bastante menos numerosa (3-5 subunidades por virión), pero es la responsable de la infectividad del fago (70). Fragmentos de Ac (tipo scFv y Fab), con una especificidad determinada, así como repertorios provenientes de distintas especies (humanos, ratón, conejo, gallina y macacos) han sido fusionados genéticamente a pVIII (16, 53, 108) y a pIII (44). La expresión asociada a pVIII conduce a partículas virales multivalentes; en contraste, la expresión ligada a pIII es usualmente monomérica, es decir, un sitio de combinación al Ag por virión. En consecuencia, el formato pIII es usualmente el que se escoge cuando se desea seleccionar fragmentos de Ac con una alta afinidad intrínseca (Figura 7).
La tecnología de desplegamiento en fagos filamentosos ha adoptado numerosas variantes. En el contexto de la producción de genotecas de Ac, merece la pena mencionar la técnica conocida como "combinatorial infection/in vivorecombination" (109), la cual ha permitido construir repertorios gigantescos (estimados en el orden de 1011 distintas especificidades) a partir de los cuales se han podido aislar fragmentos de Ac con afinidad en el rango nanomolar (34) y subnanomolar (105). Entre las especificidades de interés biomédico-clínico, que se han aislado mediante la aplicación de esta tecnología, se cuentan fragmentos de Ac con especificidad por diferentes patógenos virales como herpes simplex (tipos 1 y 2), CMV, varicella zoster, rubéola, HIV tipo 1 y RSV (113).
Como se trata de moléculas que poseen un solo sitio de combinación al Ag (monovalentes), los fragmentos Fab y scFv pudieran ser de uso limitado para ciertas aplicaciones en las cuales se requiere una afinidad elevada. Versiones multivalentes de estos fragmentos debieran presentar una afinidad funcional o avidez mayor. Además, AcR que combinen dos especificidades distintas lucen particularmente atractivos para ciertas aplicaciones como inmunodiagnóstico e inmunoterapia. Diversas estrategias han sido evaluadas para producir dímeros o polímeros de AcR. En muchas de ellas se utiliza el entrecruzamiento por medios químicos de dos fragmentos individuales, anteriomente, preparados y purificados por separado (8; 32). Esto tiene obvios problemas en cuanto a rendimiento, purificación del fragmento deseado y cantidad de tiempo y trabajo empleado.
Una estrategia más efectiva, basada en técnicas de ADN recombinante, ha sido desarrollada recientemente. Esta estrategia se basa en la construcción scFv descrita en una sección anterior, sólo que la longitud del "linker" es menor en comparación la del scFv original. Esta reducción del "linker" (a tan solo 5 aminoácidos) imposibilita la formación de un Fv funcional entre dos dominios VH y VL en una misma molécula. Ello conduce a la interacción de dos moléculas de scFv , formándose un dímero, el cual posee dos sitios de combinación con el antígeno (Figura 6B). Si la especificidad de los dominios VH y VL es la misma, el producto obtenido es un homodímero bivalente conocido como "diabody" (42) (la traducción máó apropiada de "diabody" pudiera ser "fragmento bivalente").
Ahora bien, utilizando el mismo formato, es posible producir moléculas recombinantes con dos especificidades diferentes. Por ejemplo, si se desea combinar en una misma molécula las especificidades A y B de dos anticuerpos diferentes, se diseñan dos construcciones tipo scFv. Una de ellas tendrá la forma VHA-VLB y la otra VHB-VLA (ambas pueden encontrarse en el mismo vector). En forma similar a como ocurre con los "diabodies", los polipéptidos producidos a partir de estas construcciones son incapaces de formar scFv funcionales de manera individual. No obstante, sí son capaces de aparearse apropiadamente para generar heterodímeros en donde ambas especificidades A y B son restauradas y se encuentran físicamente asociadas (41, Figura 6B). Estas moléculas artificiales han sido bautizadas con el nombre de anticuerpos biespecíficos.
Si el péptido que sirve de "linker" entre los dominios VH y VL es eliminado completamente y ambas regiones son expresadas como un polipéptido continuo, entonces, el resultado es la formación de un trímero funcional con capacidad para ligar tres determinantes antigénicos (Figura 6B). A estos fragmentos se les ha designado "triabodies" (46, 57). De manera análoga al "diabody", quizás la mejor traducción de "triabody" sea "fragmento trivalente".
Los "minibodies" constituyen un caso interesante en el que dos grupos de moléculas artificiales, completamente diferentes, han sido designados con el mismo nombre. En 1994, Tramontano y col. (102) describieron el diseño de un polipéptido artificial cuya estructura se basa en el dominio V de Ig (17), al cual bautizaron "minibody". Este péptido tiene una longitud de 61 residuos de aminoácido, adopta una conformación tipo hoja beta plegada con dos asas que corresponden a regiones hipervariables y exhibe capacidad para ligar determinantes antigénicos. Además, retiene otras características deseables del dominio V de la molécula de Ac, como tolerancia a variabilidad de la secuencia en regiones específicas de la proteína y, en consecuencia, la capacidad para "evolucionar". Genotecas de este tipo de "minibodies" han sido preparadas y se ha podido seleccionar de ellas especificidades que ligan Ag con una alta afinidad (67). Es este el caso de un minibody con especificidad por la molécula IL-6 humana (una citoquina conocida por sus propiedades proinflamatorias), el cual es capaz de inhibir la acción de IL-6 y, en consecuencia, pudiera ser de interés práctico (67).
Un tipo diferente de "minibody", a los que también se ha llamado proteínas inmunes pequeñas (SIP, "small immune proteins"), fue descrito en 1996. Esta construcción es una variante del fragmento scFv en el que un dominio CH3 está asociado físicamente, en una misma cadena polipeptídica, a un scFv a través de un "linker" que contiene residuos de cisteína en su secuencia (Figura 6B). Homodímeros bivalentes de estos polipéptidos recombinantes se han producido en células CHO y mielomatosas. Se ha comprobado, además, que presentan excelentes propiedades farmacocinéticas y para imagenología de tumores (45, 62). La reciente descripción de la tecnología "botón en ojal" ("knobs into hole", 90), la cual permite inducir la interacción entre dos cadenas polipeptídicas no relacionadas, abre la posibilidad para la preparación de heterodímeros biespecíficos de estos interesantes péptidos.
Recientemente, se descubrió en la sangre de los camellos la presencia de moléculas de Ac constituidas por dímeros de cadena H, desprovistos de cadena L (37,77). Esta y otras observaciones motivaron a un grupo de investigadores a crear AcR humanos constituidos por un único dominio VH. Para simular la estructura de los Ac de camello, se introdujeron mutaciones en los residuos 44 (Gly44Glu), 45 (Leu45Arg) y 47 (Trp47Gly) en un dominio VH humano preseleccionado. Estos cambios fueron suficientes para prevenir la interacción del VH mutado con el VL humano homólogo. A continuación, la secuencia correspondiente a la tercera asa hipervariable del dominio VHfue "randomizada" y el repertorio obtenido se expresó como una genoteca de fagos filamentosos recombinantes en E. coli. En esta forma, fue posible obtener dominios VH solubles con la capacidad para combinar Ag con una alta afinidad (20).
La tecnología de ADN recombinante ha hecho posible la concepción, diseño y elaboración de moléculas artificiales llamadas proteínas de fusión, en las cuales, motivos estructurales y/o funcionales, provenientes de dos o más proteínas naturales, son combinados. Varias características hacen a la molécula de Ac un candidato ideal para la elaboración de proteínas de fusión. En primer lugar, su diversidad y exquisita especificidad es deseable para la detección de un número virtualmente ilimitado de moléculas "target" con un riesgo marginal de reacciones cruzadas o no específicas. En segundo lugar, sus propiedades biológicas son atractivas para ciertas aplicaciones en las que se requieren moléculas recombinantes con propiedades específicas tales como vida media, talla y funciones efectoras. Finalmente, y como ya hemos mencionado, la organización modular de los anticuerpos, y los genes que los codifican, facilita grandemente el diseño y elaboración de moléculas recombinantes híbridas.
De esta manera, no sorprende que exista un importante número de proteínas de fusión donde se combinan porciones de moléculas de Ac diferentes (100; 118), o con toxinas (21, 104), interleuquinas (83), moléculas de adhesión (3), componentes de la matriz extracelular (78), hormonas (51), factores de crecimiento (69), superantígenos (110), moléculas CD (33), receptores celulares (15, 26, 27) y hasta lípidos (55). Algunos ejemplos atractivos, con potencial clínico práctico, se resumen en la tabla 1.
Proteína de fusión
|
Manipulación genética
|
Propósito
|
Ref
|
IgG polimérica
| Fusión de la pieza caudal de la cadena pesada m al extremo carboxi-terminal de la cadena pesada g | Incrementar las funciones efectoras de la IgG como activación de Complemento, aglutinación, etc. |
100
|
"T-bodies"
molécula de Ac asociada a un linfocito T
| Fusión de un scFv al dominio citosólico de una tirosina quinasa ZAP-70 (Syk) a través del dominio transmembrana de la molécula CD8 | Redirigir la especificidad de células T citotóxicas. |
25
26
|
"Ab-enzyme" (ADEPT)
| Fusión de un scFv específico por la molécula CD20 a la enzima b -glucuronidasa. | Dirigir terapia enzimática (enzimas en la forma de zimógenos) a células de linfoma que porten el antígeno CD20. |
35
|
"Ab-enzyme"
(Inmunotoxina binaria)
| Fusión de las dos subunidades de la RNAsa A humana a dos scFv diferentes. | Generar un anticuerpo biespecífico conjugado a una actividad RNAsa, para detección y destrucción de células tumorales. |
23
|
Figura 1. Anticuerpo IgG: F(ab')2, producto de la eliminación del fragmento Fc con pepsina; Fv Fragmento variable; VH, región variable de la cadena pesada; VL, región variable de la cadena ligera; CL1 región constante de la cadena ligera; CH1-3, regiones constantes de la cadena pesada. Imagen: B. Becerril.
Cada cadena está conformada por al menos dos segmentos: una región variable (VH para referirse a la cadena pesada; VL para la ligera) y una región constante. La cadena ligera sólo posee un módulo constante, mientras que la cadena pesada tiene tres. Aprovechando el conocimiento de la estructura modular de los anticuerpos y sabiendo que las regiones variables son las encargadas del reconocimiento de los antígenos, en el laboratorio podemos generar anticuerpos que sólo estén conformados por el segmento variable de cada cadena (VH+VL), unidos por un segmento conector de 15 aminoácidos (revisado en BENHAR, 2001; AZZAZY and Highsmith, 2002; BREKKE and Loset 2003). Esta estructura molecular es llamada scFv, por sus iniciales en inglés single chain Fv, que significa "fragmento variable de cadena única" (Fig. 2).
Figura 2. Fragmento variable de cadena sencilla (scFv). En amarillo se observa el péptido conector entre los dominios VH y VL. Se destacan las regiones determinantes de complementariedad (CDRs) que forman el sitio de reconocimiento al antígeno.
Tratándose de anticuerpos obtenidos en el laboratorio por técnicas de biología molecular a partir de material genético humano (Fig. 3) y usando bacterias como minúsculas "fábricas" productoras, se les denomina anticuerpos recombinantes de cadena sencilla de origen humano.
No hay comentarios:
Publicar un comentario