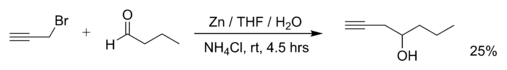
La Reacción de Barbier es una de las más reconocidas reacciones en química orgánica. Se distingue por ser singularmente simple desde el punto de vista práctico -en algunos casos- y compleja mecanísticamente -en otros-.
La reacción de Barbier es una reacción de adición nucleofílica a carbonilo, éste último como electrófilo. El agente nuclefílico es generalmente un halogenuro de alquilo, hay también muchos ejemplos con otros tipos de reactivos alquilantes halogenados. La reacción es promovida por metales como Zn -cinc o zinc-, Al -aluminio-, Indio -In-, estaño -Sn-, y/o sus sales inorgánicas.
Un ejemplo de este tipo de reacción es la que promueven los reactivos de Grignard. La reacción de Grignard es un tipo de reacción de Barbier, con la salvedad de que las condiciones y el metal que se utiliza son distintos.
Los productos de la reacción tipo Barbier son alcoholes secundarios y terciarios, sin descartar la posible reacción con formaldehído, que eventualmente podría dar en alcohol primario.
Las condiciones de trabajo son relativamente convenientes. Si bien es cierto, la reacción es bastante tolerante de la atmósfera -ambiente- de reacción y del medio de ésta última, sus rendimientos pueden variar dependiendo de los factores mismos que la componen. Esto es, si hablamos que nuestro agente alquilante es un halogenuro de alquilo, éstos son capaces de reaccionar perfectamente con un carbonilo -aldehído o cetona- vía Barbier, en agua como disolvente. Sin embargo, la reacción se ve algo perjudicada puesto que los halogenuros de alquilo, vinilo, alilo, homoalilo y propargilo son capaces de reaccionar por sustitución nucleofílica con el agua.
La reacción de Barbier es una reacción orgánica entre un alkyl halide y un grupo carbonyl como un electrophilic substrate en la presencia de magnesio, aluminio, zinc, indium, lata o sus sales. El producto de reacción es un alcohol primario, secundario o terciario. La reacción es similar a la reacción de Grignard pero la diferencia crucial es que la reacción de Barbier es una síntesis de un pote mientras que un reactivo de Grignard está preparado por separado antes de la adición del compuesto de carbonyl. Las reacciones de Barbier son reacciones de adición nucleophilic que por lo general ocurren con metales insensibles relativamente baratos y acuáticos o compuestos metálicos en contraste con reactivo de Grignard o reactivo organolithium. Por esta razón es posible en muchos casos dirigir la reacción en el agua que hace la parte del procedimiento de la química verde. La reacción de Barbier se nombra por el profesor Philippe Barbier de Victor Grignard.
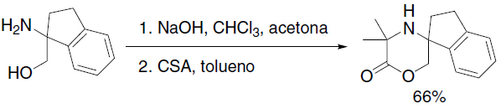
La reacción de Bargellini es un método de síntesis orgánica para obtener morfolinas y piperazinonas con alto impedimento estérico a partir de cetonas y 2-amino-2-metil-1-propanol o 1,2-diaminopropanos.1
Mecanismo
El mecanismo de reacción comienza con la desprotonación del cloroformo. El anión triclorometiluro ataca al carbonilo de la cetona, formando así el alcóxido, de una manera similar a la reacción de Grignard. El alcóxido ataca intramolecularmente al carbono trihalogenado para formar así el diclorooxirano en un mecanismo SN2 intramolecular. La amina puede atacar al oxirano debido a una formación de un carbocatión terciario en una sustitución nucleofílica SN1 con una eliminación concertada de un átomo de cloro. Así se forma un halogenuro de N-alquil-α-aminoácido. Al final, el grupo amino o hidroxilo ataca al cloruro de ácido formando el heterociclo correspondiente.2
Aplicaciones
Diversos compuestos se ha reportado como productos de la síntesis de Bargellini3 Un ejemplo es la síntesis de la 5',5'-dimetil-2,3-dihidro-6'H-espiro[indeno-1,3'-[1,4]oxazinan]-6'-ona:

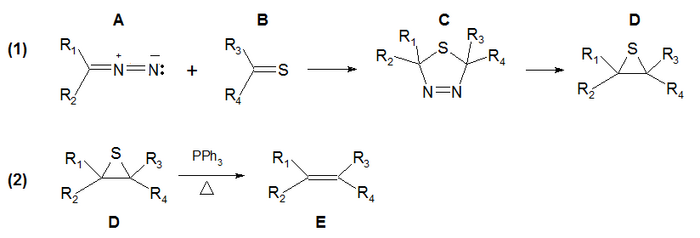
La Reacción de Barton-Kellogg o Síntesis de olefinas Barton-Kellogg es un método de síntesis que efectúa un acoplamiento (o condensación) entre undiazocompuesto (Preparado a partir de una cetona) y una tiocetona con la formación de un alqueno como producto deseado.1 2 3
Esta reacción fue descrita por Hermann Staudinger4 y por lo tanto la reacción también se conoce con el nombre de acoplamiento diazo-tiocetona tipo Staudinger.
Mecanismos de reacción
El método consiste en dos reacciones:
- (1) La cicloadición entre el diazocompuesto A y la tiocetona B para dar una tiadiazolina C, en donde se extruye el nitrógeno para dar un episulfuro D.
- (2) La eliminación del átomo de azufre del episulfuro con el uso de trifenilfosfina para dar el alqueno.
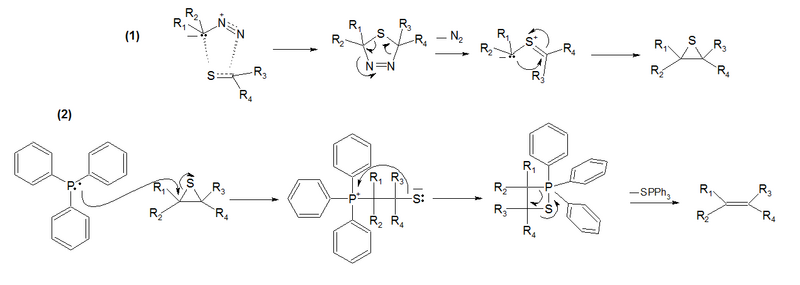
En el mecanismo de la reacción (1), el compuesto diazo se comporta como un dipolo 1,3 que reacciona con la tiocetona en una cicloadición dipolar-1,3 para dar la tiadiazolina. Este intermediario es inestable y por la extrusión de nitrógeno gaseoso se forma un iluro tiocarbonílico como intermediario para obtenerse un episulfuro estable.
En el mecanismo de la reacción (2), la trifenilfosfina abre el ciclo de tres miembros y luego forma un sulfafosfatano de una manera similar a la reacción de Wittig. En el paso final, el sulfuro de trifenilfosfina es expulsado para liberar el alqueno.
Aplicaciones
El diazocompuesto se puede obtener a partir de una cetona por reacción con hidracina para obtener la hidrazona, seguido de una oxidación. Existen muchos reactivos para esta conversión, por ejemplo plata (I) y óxido de bis(trifluoroacetoxi)yodobenceno [5]. La tiocetona necesaria para esta reacción se puede obtener de una cetona ypentasulfuro de fósforo. La desulfuración del episulfuro se puede lograr con fosfinas y también con polvo de cobre.
La principal ventaja de esta reacción sobre la reacción de McMurry es que la reacción se puede llevar a cabo con dos cetonas diferentes.



No hay comentarios:
Publicar un comentario