La corriente continua ( CC ) es el flujo unidireccional de una carga eléctrica . Una celda electroquímica es un excelente ejemplo de potencia de CC. La corriente continua puede fluir a través de un conductor como un cable, pero también puede fluir a través de semiconductores , aislantes o incluso a través de un vacío como en haces de electrones o iones . La corriente eléctrica fluye en una dirección constante, distinguiéndola de la corriente alterna (CA). Un término utilizado anteriormente para este tipo de corriente era la corriente galvánica . [1]
Las abreviaturas AC y DC a menudo se usan para significar simplemente alterna y directa , como cuando modifican corriente o voltaje . [2] [3]
La corriente continua se puede convertir de un suministro de corriente alterna mediante el uso de un rectificador , que contiene elementos electrónicos (generalmente) o elementos electromecánicos (históricamente) que permiten que la corriente fluya solo en una dirección. La corriente continua se puede convertir en corriente alterna a través de un inversor .
La corriente continua tiene muchos usos, desde la carga de baterías hasta grandes fuentes de alimentación para sistemas electrónicos, motores y más. En la fundición de aluminio y otros procesos electroquímicos se utilizan cantidades muy grandes de energía eléctrica suministrada a través de corriente continua . También se usa para algunos ferrocarriles , especialmente en áreas urbanas . La corriente continua de alto voltaje se utiliza para transmitir grandes cantidades de energía desde sitios de generación remota o para interconectar redes de energía de corriente alterna.
Historia [ editar ]
La corriente continua fue producida en 1800 por la batería del físico italiano Alessandro Volta , su pila Voltaic . [5] La naturaleza de cómo fluía la corriente aún no se entendía. El físico francés André-Marie Ampère conjeturó que la corriente viajaba en una dirección de positivo a negativo. [6] Cuando el fabricante francés de instrumentos Hippolyte Pixii construyó el primer generador eléctrico de dinamo en 1832, descubrió que a medida que el imán utilizado pasaba los lazos de alambre cada media vuelta, causaba que el flujo de electricidad se invirtiera, generando una corriente alterna . [7] A sugerencia de Ampère, Pixii luego agregó un conmutador, un tipo de "interruptor" donde los contactos en el eje funcionan con contactos de "cepillo" para producir corriente continua.
A fines de la década de 1870 y principios de la década de 1880, se comenzó a generar electricidad en las centrales eléctricas . Inicialmente, se configuraron para encender la iluminación de arco (un tipo popular de alumbrado público) que funciona con corriente continua o corriente alterna de muy alto voltaje (generalmente más de 3000 voltios). [8] Esto fue seguido por el uso generalizado de corriente continua de bajo voltaje para la iluminación eléctrica de interiores en negocios y hogares después de que el inventor Thomas Edison lanzó su " utilidad " eléctrica basada en bombillas incandescentes en 1882. Debido a las importantes ventajas de la corriente alterna sobre la directa corriente en el uso de transformadoresPara aumentar y disminuir los voltajes para permitir distancias de transmisión mucho más largas, la corriente continua fue reemplazada en las próximas décadas por corriente alterna en la entrega de energía. A mediados de la década de 1950, se desarrolló la transmisión de corriente continua de alto voltaje , y ahora es una opción en lugar de los sistemas de corriente alterna de alto voltaje de larga distancia. Para cables submarinos de larga distancia (por ejemplo, entre países, como NorNed ), esta opción de CC es la única opción técnicamente viable. Para aplicaciones que requieren corriente continua, como los sistemas de energía del tercer riel , la corriente alterna se distribuye a una subestación, que utiliza un rectificador para convertir la energía en corriente continua.
Varias definiciones [ editar ]
El término CC se usa para referirse a los sistemas de energía que usan solo una polaridad de voltaje o corriente, y para referirse al valor medio local constante, de frecuencia cero o lentamente variable de un voltaje o corriente. [9] Por ejemplo, el voltaje a través de una fuente de voltaje de CC es constante al igual que la corriente a través de una fuente de corriente de CC . La solución de CC de un circuito eléctrico es la solución donde todos los voltajes y corrientes son constantes. Se puede demostrar que cualquier forma de onda de voltaje o corriente estacionaria se puede descomponer en una suma de un componente de CC y un componente variable en el tiempo de media cero; El componente de CC se define como el valor esperado o el valor promedio del voltaje o la corriente en todo momento.
Aunque DC significa "corriente continua", DC a menudo se refiere a "polaridad constante". Según esta definición, los voltajes de CC pueden variar en el tiempo, como se ve en la salida sin formato de un rectificador o la señal de voz fluctuante en una línea telefónica.
Algunas formas de CC (como la producida por un regulador de voltaje ) casi no tienen variaciones en el voltaje , pero aún pueden tener variaciones en la potencia de salida y la corriente.
Circuitos [ editar ]
Un circuito de corriente continua es un circuito eléctrico que consiste en cualquier combinación de fuentes de voltaje constante , fuentes de corriente constante y resistencias . En este caso, los voltajes y corrientes del circuito son independientes del tiempo. Un voltaje o corriente de circuito particular no depende del valor pasado de ningún voltaje o corriente de circuito. Esto implica que el sistema de ecuaciones que representa un circuito DC no involucra integrales o derivadas con respecto al tiempo.
Si se agrega un condensador o inductor a un circuito de CC, el circuito resultante no es, estrictamente hablando, un circuito de CC. Sin embargo, la mayoría de estos circuitos tienen una solución DC. Esta solución proporciona los voltajes y corrientes del circuito cuando el circuito está en estado estable de CC . Tal circuito está representado por un sistema de ecuaciones diferenciales . La solución a estas ecuaciones generalmente contiene una parte variable o transitoria en el tiempo , así como una parte en estado constante o estable. Es esta parte de estado estacionario la que es la solución DC. Hay algunos circuitos que no tienen una solución DC. Dos ejemplos simples son una fuente de corriente constante conectada a un condensador y una fuente de voltaje constante conectada a un inductor.
En electrónica, es común referirse a un circuito alimentado por una fuente de voltaje de CC, como una batería o la salida de una fuente de alimentación de CC como un circuito de CC, aunque lo que se entiende es que el circuito está alimentado por CC.
Aplicaciones [ editar ]
Edificios domésticos y comerciales [ editar ]
La corriente continua se encuentra comúnmente en muchas aplicaciones de voltaje extra bajo y en algunas aplicaciones de bajo voltaje , especialmente cuando estas funcionan con baterías o sistemas de energía solar (ya que ambas pueden producir solo CC).
Las instalaciones de CC domésticas generalmente tienen diferentes tipos de enchufes , conectores , interruptores y accesorios de los adecuados para corriente alterna. Esto se debe principalmente a los voltajes más bajos utilizados, lo que resulta en corrientes más altas para producir la misma cantidad de energía .
Por lo general, es importante con un dispositivo de CC observar la polaridad, a menos que el dispositivo tenga un puente de diodos para corregirlo.
EMerge Alliance es la asociación industrial abierta que desarrolla estándares de distribución de energía de CC en casas híbridas y edificios comerciales .
Automotriz [ editar ]
La mayoría de las aplicaciones automotrices usan DC. Una batería automotriz proporciona energía para el arranque del motor, la iluminación y el sistema de encendido. El alternador es un dispositivo de CA que utiliza un rectificador para producir CC para cargar la batería. La mayoría de los vehículos de pasajeros en carretera utilizan sistemas de 12 V nominales . Muchos camiones pesados, equipos agrícolas o equipos de movimiento de tierras con motores Diesel utilizan sistemas de 24 voltios. En algunos vehículos más antiguos, se usaban 6 V, como en el clásico Volkswagen Beetle original . En un punto, un sistema eléctrico de 42 Vfue considerado para automóviles, pero esto encontró poco uso. Para ahorrar peso y cables, a menudo el marco de metal del vehículo está conectado a un polo de la batería y se utiliza como conductor de retorno en un circuito. A menudo, el polo negativo es la conexión de "tierra" del chasis, pero la tierra positiva se puede utilizar en algunos vehículos con ruedas o marinos.
Telecomunicaciones [ editar ]
El equipo de comunicación de central telefónica utiliza una fuente de alimentación estándar de −48 V CC. La polaridad negativa se logra conectando a tierra el terminal positivo del sistema de suministro de energía y el banco de baterías . Esto se hace para evitar depósitos de electrólisis . Las instalaciones telefónicas tienen un sistema de batería para garantizar que se mantenga la energía de las líneas de abonado durante las interrupciones de energía.
Otros dispositivos pueden alimentarse desde el sistema de CC de telecomunicaciones utilizando un convertidor CC-CC para proporcionar cualquier voltaje conveniente.
Muchos teléfonos se conectan a un par de cables trenzados, y utilizan una T de polarización para separar internamente el componente de CA del voltaje entre los dos cables (la señal de audio) del componente de CC del voltaje entre los dos cables (utilizado para alimentar el teléfono )
Transmisión de potencia de alto voltaje [ editar ]
Los sistemas de transmisión de energía eléctrica de corriente continua de alto voltaje (HVDC) usan CC para la transmisión masiva de energía eléctrica, en contraste con los sistemas de corriente alterna más comunes. Para la transmisión a larga distancia, los sistemas HVDC pueden ser menos costosos y sufrir pérdidas eléctricas más bajas.
Otro [ editar ]
Las aplicaciones que usan celdas de combustible (que mezclan hidrógeno y oxígeno junto con un catalizador para producir electricidad y agua como subproductos) también producen solo CC.
Los sistemas eléctricos de aviones ligeros son típicamente 12 V o 24 V CC similares a los automóviles.

Varias celdas y baterías (arriba a la izquierda a abajo a la derecha): dos baterías AA , una D , una de radioaficionado manual , dos de 9 voltios (PP3), dos AAA , una C , una batería de videocámara , una batería de teléfono inalámbrico
| |
| Tipo | Fuente de alimentación |
|---|---|
| Principio de funcionamiento | Reacciones electroquímicas , fuerza electromotriz |
| Primera producción | 1800 |
| Símbolo electronico | |
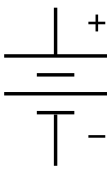 El símbolo de una batería en un diagrama de circuito . Se originó como un dibujo esquemático del primer tipo de batería, una pila voltaica . | |
Una batería es un dispositivo que consiste en una o más celdas electroquímicas con conexiones externas provistas para alimentar dispositivos eléctricos como linternas , teléfonos móviles y automóviles eléctricos . [1] Cuando una batería suministra energía eléctrica , su terminal positivo es el cátodo y su terminal negativo es el ánodo . [2] El terminal marcado como negativo es la fuente de electrones que fluirá a través de un circuito eléctrico externo al terminal positivo. Cuando una batería está conectada a una carga eléctrica externa, un redoxLa reacción convierte los reactivos de alta energía en productos de baja energía, y la diferencia de energía libre se entrega al circuito externo como energía eléctrica. [3] Históricamente, el término "batería" se refería específicamente a un dispositivo compuesto por múltiples celdas, sin embargo, el uso ha evolucionado para incluir dispositivos compuestos por una sola celda. [4]
Las baterías primarias (de un solo uso o "desechables") se usan una vez y se desechan; Los materiales del electrodo se cambian irreversiblemente durante la descarga. Ejemplos comunes son la batería alcalina utilizada para linternas y una multitud de dispositivos electrónicos portátiles. Las baterías secundarias (recargables) se pueden descargar y recargar varias veces utilizando una corriente eléctrica aplicada; La composición original de los electrodos puede restaurarse mediante corriente inversa. Los ejemplos incluyen las baterías de plomo-ácido utilizadas en vehículos y las baterías de iones de litio utilizadas para dispositivos electrónicos portátiles como computadoras portátiles y teléfonos móviles.
Las baterías vienen en muchas formas y tamaños, desde celdas en miniatura utilizadas para alimentar audífonos y relojes de pulsera hasta celdas pequeñas y delgadas utilizadas en teléfonos inteligentes , a grandes baterías de plomo ácido o baterías de iones de litio en vehículos, y en el extremo más grande, enormes baterías. tamaño de las habitaciones que proporcionan energía de reserva o de emergencia para centrales telefónicas y centros de datos informáticos .
Según una estimación de 2005, la industria mundial de baterías genera ventas por US $ 48 mil millones cada año, [5] con un crecimiento anual del 6%.
Las baterías tienen una energía específica mucho más baja (energía por unidad de masa) que los combustibles comunes como la gasolina. En los automóviles, esto se ve compensado por la mayor eficiencia de los motores eléctricos en la conversión de energía química en trabajo mecánico, en comparación con los motores de combustión.
Historia
El uso de "batería" para describir un grupo de dispositivos eléctricos data de Benjamin Franklin , quien en 1748 describió varios frascos de Leyden por analogía con una batería de cañón [6] (Benjamin Franklin tomó prestado el término "batería" del ejército, que se refiere a las armas que funcionan juntas [7] ).
El físico italiano Alessandro Volta construyó y describió la primera batería electroquímica, la pila voltaica , en 1800. [8] Esta era una pila de placas de cobre y zinc, separadas por discos de papel empapados en salmuera, que podían producir una corriente constante durante una longitud considerable. de tiempo. Volta no entendió que el voltaje se debía a reacciones químicas. Pensó que sus células eran una fuente inagotable de energía, [9] y que los efectos de corrosión asociados a los electrodos eran una mera molestia, en lugar de una consecuencia inevitable de su funcionamiento, como lo demostró Michael Faraday en 1834. [10]
Aunque las primeras baterías eran de gran valor para fines experimentales, en la práctica sus voltajes fluctuaban y no podían proporcionar una corriente grande durante un período prolongado. La célula Daniell , inventada en 1836 por el químico británico John Frederic Daniell , fue la primera fuente práctica de electricidad, se convirtió en un estándar de la industria y vio una adopción generalizada como fuente de energía para las redes de telégrafos eléctricos . [11] Consistía en una olla de cobre llena con una solución de sulfato de cobre , en la que se sumergía un recipiente de barro sin esmaltar lleno de ácido sulfúrico y un electrodo de zinc. [12]
Estas celdas húmedas usaban electrolitos líquidos, que eran propensos a fugas y derrames si no se manejaban correctamente. Muchos usaron frascos de vidrio para sujetar sus componentes, lo que los hizo frágiles y potencialmente peligrosos. Estas características hacen que las celdas húmedas no sean adecuadas para aparatos portátiles. Cerca del final del siglo XIX, la invención de las baterías de celda seca , que reemplazó el electrolito líquido con una pasta, hizo que los dispositivos eléctricos portátiles fueran prácticos. [13]
Principio de funcionamiento
Las baterías convierten la energía química directamente en energía eléctrica . En muchos casos, la energía eléctrica liberada es la diferencia en las energías cohesivas [14] o de enlace de los metales, óxidos o moléculas que experimentan la reacción electroquímica. [3] Por ejemplo, la energía puede almacenarse en Zn o Li, que son metales de alta energía porque no están estabilizados por enlaces d-electron, a diferencia de los metales de transición . Las baterías están diseñadas de tal manera que la reacción redox energéticamente favorable solo puede ocurrir si los electrones se mueven a través de la parte externa del circuito.
Una batería consta de cierto número de celdas voltaicas . Cada celda consta de dos medias celdas conectadas en serie por un electrolito conductor que contiene cationes metálicos . Una media celda incluye electrolito y el electrodo negativo, el electrodo al que migran los aniones (iones cargados negativamente); la otra media celda incluye electrolito y el electrodo positivo, al cual migran los cationes ( iones cargados positivamente ). Los cationes se reducen (se agregan electrones) en el cátodo, mientras que los átomos de metal se oxidan (se eliminan los electrones) en el ánodo. [15]Algunas células usan diferentes electrolitos para cada media celda; entonces se usa un separador para evitar la mezcla de los electrolitos mientras se permite que los iones fluyan entre medias celdas para completar el circuito eléctrico.
Cada media celda tiene una fuerza electromotriz ( fem , medida en voltios) en relación con un estándar . La fem neta de la celda es la diferencia entre las fem de sus medias celdas. [16] Por lo tanto, si los electrodos tienen emfs y , entonces la fem neta es ; en otras palabras, la fem neta es la diferencia entre los potenciales de reducción de las semirreacciones . [17]
La fuerza motriz eléctrica o a través de los terminales de una celda se conoce como voltaje terminal (diferencia) y se mide en voltios . [18] El voltaje terminal de una celda que no se está cargando o descargando se llama voltaje de circuito abierto e iguala la fem de la celda. Debido a la resistencia interna, [19] el voltaje terminal de una celda que se está descargando es menor en magnitud que el voltaje de circuito abierto y el voltaje terminal de una celda que se está cargando excede el voltaje de circuito abierto. [20] Una celda ideal tiene una resistencia interna insignificante, por lo que mantendría un voltaje terminal constante dehasta que se agote, luego cayendo a cero. Si una celda de este tipo mantuviera 1.5 voltios y produjera una carga de un culombio, entonces, al completarse la descarga, habría realizado 1.5 julios de trabajo. [18] En las celdas reales, la resistencia interna aumenta bajo descarga [19] y el voltaje de circuito abierto también disminuye bajo descarga. Si el voltaje y la resistencia se trazan contra el tiempo, los gráficos resultantes son típicamente una curva; La forma de la curva varía según la química y la disposición interna empleada.
El voltaje desarrollado a través de los terminales de una celda depende de la liberación de energía de las reacciones químicas de sus electrodos y electrolitos. Las células alcalinas y de zinc-carbono tienen diferentes químicas, pero aproximadamente la misma fem de 1.5 voltios; Del mismo modo, las células NiCd y NiMH tienen diferentes químicas, pero aproximadamente la misma fem de 1,2 voltios. [21] Los cambios de alto potencial electroquímico en las reacciones de los compuestos de litio dan a las células de litio emfs de 3 voltios o más. [22]
Categorías y tipos de baterías
Las baterías se clasifican en formas primarias y secundarias:
- Las baterías primarias están diseñadas para usarse hasta que se agoten las energías y luego se descarten. Sus reacciones químicas generalmente no son reversibles, por lo que no se pueden recargar. Cuando se agota el suministro de reactivos en la batería, la batería deja de producir corriente y es inútil. [23]
- Las baterías secundarias se pueden recargar; es decir, pueden revertir sus reacciones químicas aplicando corriente eléctrica a la célula. Esto regenera los reactivos químicos originales, por lo que pueden usarse, recargarse y usarse nuevamente varias veces. [24]
Algunos tipos de baterías primarias utilizadas, por ejemplo, para circuitos telegráficos , se restablecieron a la operación reemplazando los electrodos. [25] Las baterías secundarias no son recargables indefinidamente debido a la disipación de los materiales activos, la pérdida de electrolitos y la corrosión interna.
Primario
Las baterías primarias, o celdas primarias , pueden producir corriente inmediatamente en el ensamblaje. Estos se usan con mayor frecuencia en dispositivos portátiles que tienen un bajo consumo de corriente, se usan solo de manera intermitente o bien lejos de una fuente de energía alternativa, como en los circuitos de alarma y comunicación donde hay otra energía eléctrica disponible de manera intermitente. Las células primarias desechables no se pueden recargar de manera confiable, ya que las reacciones químicas no son fácilmente reversibles y los materiales activos pueden no volver a sus formas originales. Los fabricantes de baterías recomiendan no intentar recargar las células primarias. [26] En general, tienen mayores densidades de energía que las baterías recargables, [27]pero las baterías desechables no funcionan bien en aplicaciones de alto consumo con cargas de menos de 75 ohmios (75 Ω). Los tipos comunes de baterías desechables incluyen baterías de zinc-carbono y baterías alcalinas .
Secundario
Las baterías secundarias, también conocidas como celdas secundarias o baterías recargables , deben cargarse antes del primer uso; Por lo general, se ensamblan con materiales activos en el estado descargado. Las baterías recargables se (re) cargan aplicando corriente eléctrica, que invierte las reacciones químicas que ocurren durante la descarga / uso. Los dispositivos para suministrar la corriente adecuada se denominan cargadores.
La forma más antigua de batería recargable es la batería de plomo-ácido , que se usa ampliamente en aplicaciones automotrices y de navegación . Esta tecnología contiene electrolito líquido en un recipiente sin sellar, lo que requiere que la batería se mantenga en posición vertical y que el área esté bien ventilada para garantizar una dispersión segura del gas de hidrógeno que produce durante la sobrecarga. La batería de plomo-ácido es relativamente pesada por la cantidad de energía eléctrica que puede suministrar. Su bajo costo de fabricación y sus altos niveles de corriente de sobretensión lo hacen común donde su capacidad (más de aproximadamente 10 Ah) es más importante que los problemas de peso y manejo. Una aplicación común es la batería moderna del automóvil., que, en general, puede entregar una corriente máxima de 450 amperios .
La batería sellada de plomo-ácido regulada por válvula ( batería VRLA) es popular en la industria automotriz como reemplazo de la celda húmeda de plomo-ácido. La batería VRLA utiliza un electrolito de ácido sulfúrico inmovilizado , lo que reduce la posibilidad de fugas y prolonga la vida útil . [28] Las baterías VRLA inmovilizan el electrolito. Los dos tipos son:
- Las baterías de gel (o "celda de gel") usan un electrolito semisólido.
- Las baterías Absorbed Glass Mat (AGM) absorben el electrolito en una estera especial de fibra de vidrio.
Otras baterías recargables portátiles incluyen varios tipos de "celdas secas" selladas, que son útiles en aplicaciones como teléfonos móviles y computadoras portátiles . Las celdas de este tipo (en orden de aumento de la densidad de potencia y el costo) incluyen níquel-cadmio (NiCd), níquel-zinc (NiZn), hidruro de níquel-metal (NiMH) y celdas de iones de litio (iones de litio). El ion de litio tiene, con mucho, la mayor participación en el mercado de pilas secas recargables. NiMH ha reemplazado a NiCd en la mayoría de las aplicaciones debido a su mayor capacidad, pero NiCd sigue en uso en herramientas eléctricas , radios bidireccionales y equipos médicos .
En la década de 2000, los desarrollos incluyen baterías con componentes electrónicos integrados como USBCELL , que permite cargar una batería AA a través de un conector USB , [29] baterías de nanoball que permiten una velocidad de descarga aproximadamente 100 veces mayor que las baterías actuales, y paquetes de baterías inteligentes con estado- monitores de carga y circuitos de protección de batería que evitan daños por sobredescarga. La autodescarga baja (LSD) permite cargar las celdas secundarias antes del envío.
Tipos de células
Se han producido muchos tipos de celdas electroquímicas, con diversos procesos y diseños químicos, que incluyen celdas galvánicas , celdas electrolíticas , celdas de combustible , celdas de flujo y pilas voltaicas. [30]
Celda mojada
Una batería de celda húmeda tiene un electrolito líquido . Otros nombres son celda inundada , ya que el líquido cubre todas las partes internas, o celda ventilada , ya que los gases producidos durante la operación pueden escapar al aire. Las células húmedas fueron un precursor de las células secas y se usan comúnmente como una herramienta de aprendizaje para la electroquímica . Se pueden construir con suministros de laboratorio comunes, como vasos de precipitados , para demostrar cómo funcionan las células electroquímicas. Un tipo particular de celda húmeda conocida como celda de concentración es importante para comprender la corrosión . Las células húmedas pueden ser células primarias (no recargables) o células secundarias.(recargable) Originalmente, todas las baterías primarias prácticas, como la celda Daniell, se construyeron como celdas húmedas de tarros de vidrio con tapa abierta. Otras células húmedas primarios son la celda Leclanché , célula Grove , célula Bunsen , célula de ácido crómico , de células Clark , y de células Weston . La química celular de Leclanche se adaptó a las primeras células secas. Las celdas húmedas todavía se usan en baterías de automóviles y en la industria para energía de reserva para aparamenta , telecomunicaciones o grandes fuentes de alimentación ininterrumpida , pero en muchos lugares baterías con celdas de gelhan sido utilizados en su lugar. Estas aplicaciones comúnmente usan células de plomo-ácido o níquel-cadmio .
Pila seca
Una celda seca usa un electrolito en pasta, con solo suficiente humedad para permitir que la corriente fluya. A diferencia de una celda húmeda, una celda seca puede funcionar en cualquier orientación sin derrames, ya que no contiene líquido libre, por lo que es adecuada para equipos portátiles. En comparación, las primeras celdas húmedas eran típicamente contenedores de vidrio frágiles con varillas de plomo colgando de la parte superior abierta y necesitaban un manejo cuidadoso para evitar derrames. Las baterías de plomo-ácido no lograron la seguridad y portabilidad de la celda seca hasta el desarrollo de la batería de gel .
Una celda seca común es la batería de zinc-carbono , a veces llamada celda seca de Leclanché , con un voltaje nominal de 1.5 voltios , igual que la batería alcalina (ya que ambas usan la misma combinación de zinc y dióxido de manganeso ). Una celda seca estándar comprende un ánodo de zinc , generalmente en forma de una olla cilíndrica, con un cátodo de carbono en forma de una varilla central. El electrolito es cloruro de amonio en forma de pasta junto al ánodo de zinc. El espacio restante entre el electrolito y el cátodo de carbono lo ocupa una segunda pasta que consiste en cloruro de amonio y dióxido de manganeso, este último actúa como undespolarizador . En algunos diseños, el cloruro de amonio se reemplaza por cloruro de zinc .
Sal fundida
Las baterías de sal fundida son baterías primarias o secundarias que usan una sal fundida como electrolito. Funcionan a altas temperaturas y deben estar bien aislados para retener el calor.
reserva
Una batería de reserva se puede almacenar sin ensamblar (inactiva y sin suministro de energía) durante un largo período (quizás años). Cuando se necesita la batería, se ensambla (por ejemplo, agregando electrolito); Una vez ensamblada, la batería está cargada y lista para funcionar. Por ejemplo, una batería para una boquilla de artillería electrónica podría activarse por el impacto de disparar un arma. La aceleración rompe una cápsula de electrolito que activa la batería y alimenta los circuitos de la espoleta. Las baterías de reserva generalmente están diseñadas para una vida útil corta (segundos o minutos) después de un almacenamiento prolongado (años). Una batería activada por agua para instrumentos oceanográficos o aplicaciones militares se activa al sumergirse en agua.
Rendimiento celular
Las características de una batería pueden variar durante el ciclo de carga, el ciclo de carga y la vida útil debido a muchos factores, incluidos la química interna, el consumo de corriente y la temperatura. A bajas temperaturas, una batería no puede entregar tanta energía. Como tal, en climas fríos, algunos propietarios de automóviles instalan calentadores de batería, que son pequeñas almohadillas de calefacción eléctrica que mantienen caliente la batería del automóvil.
Capacidad y descarga
La capacidad de una batería es la cantidad de carga eléctrica que puede entregar al voltaje nominal. Cuanto más material de electrodos contenga la celda, mayor será su capacidad. Una celda pequeña tiene menos capacidad que una celda más grande con la misma química, aunque desarrollan el mismo voltaje de circuito abierto. [31] La capacidad se mide en unidades como amp-hora (A · h). La capacidad nominal de una batería generalmente se expresa como el producto de 20 horas multiplicado por la corriente que una batería nueva puede suministrar constantemente durante 20 horas a 68 ° F (20 ° C), mientras se mantiene por encima de un voltaje terminal específico por celda. Por ejemplo, una batería de 100 A · h puede suministrar 5 A durante un período de 20 horas a temperatura ambiente.. La fracción de la carga almacenada que puede entregar una batería depende de múltiples factores, incluida la química de la batería, la velocidad a la que se entrega la carga (corriente), el voltaje terminal requerido, el período de almacenamiento, la temperatura ambiente y otros factores. [31]
Cuanto mayor es la velocidad de descarga, menor es la capacidad. [32] La ley de Peukert aproxima la relación entre la corriente, el tiempo de descarga y la capacidad de una batería de plomo ácido (en un rango típico de valores actuales) :
dónde
- es la capacidad cuando se descarga a una velocidad de 1 amp.
- es la corriente extraída de la batería ( A ).
- es la cantidad de tiempo (en horas) que puede soportar una batería.
- es una constante alrededor de 1.3.
Las baterías que se almacenan durante un período prolongado o que se descargan a una pequeña fracción de la capacidad pierden capacidad debido a la presencia de reacciones secundarias generalmente irreversibles que consumen los portadores de carga sin producir corriente. Este fenómeno se conoce como autodescarga interna. Además, cuando las baterías se recargan, pueden ocurrir reacciones secundarias adicionales, reduciendo la capacidad para descargas posteriores. Después de suficientes recargas, en esencia, se pierde toda la capacidad y la batería deja de producir energía.
Las pérdidas de energía internas y las limitaciones en la tasa de iones que pasan a través del electrolito hacen que la eficiencia de la batería varíe. Por encima de un umbral mínimo, la descarga a una velocidad baja ofrece más capacidad de la batería que a una velocidad más alta. La instalación de baterías con clasificaciones A · h variables no afecta el funcionamiento del dispositivo (aunque puede afectar el intervalo de funcionamiento) clasificado para un voltaje específico a menos que se excedan los límites de carga. Las cargas de alto consumo, como las cámaras digitales, pueden reducir la capacidad total, como sucede con las baterías alcalinas. Por ejemplo, una batería con una capacidad nominal de 2 A · h para una descarga de 10 o 20 horas no mantendría una corriente de 1 A durante dos horas completas como su capacidad indicada implica.
Tasa de C
La tasa C es una medida de la velocidad a la que se carga o descarga una batería. Se define como la corriente a través de la batería dividida por el consumo de corriente teórico bajo el cual la batería entregaría su capacidad nominal nominal en una hora. [33] Tiene las unidades h −1 .
La tasa C se usa como clasificación en las baterías para indicar la corriente máxima que una batería puede suministrar de manera segura en un circuito. Los estándares para baterías recargables generalmente califican la capacidad durante un tiempo de descarga de 4 horas, 8 horas o más. Los fabricantes pueden clasificar los tipos destinados a fines especiales, como en una fuente de alimentación ininterrumpida de computadora , para períodos de descarga de mucho menos de una hora. Debido a la pérdida de resistencia interna y los procesos químicos dentro de las celdas, una batería rara vez entrega la capacidad nominal de la placa de identificación en solo una hora.
Baterías rápidas, grandes y livianas
A partir de 2012 , fosfato de hierro y litio ( LiFePO
4 ) la tecnología de bateríafue la carga / descarga más rápida, descargándose completamente en 10-20 segundos. [34]
4 ) la tecnología de bateríafue la carga / descarga más rápida, descargándose completamente en 10-20 segundos. [34]
A partir de 2017 , la batería más grande del mundo fue construida en Australia del Sur por Tesla . Puede almacenar 129 MWh. [35] En 2013 se construyó una batería en la provincia de Hebei , China, que puede almacenar 36 MWh de electricidad a un costo de $ 500 millones. [36] Otra batería grande, compuesta por celdas de Ni-Cd , estaba en Fairbanks, Alaska . Cubría 2.000 metros cuadrados (22.000 pies cuadrados), más grande que un campo de fútbol, y pesaba 1.300 toneladas. Fue fabricado por ABB para proporcionar energía de respaldo en caso de un apagón. La batería puede proporcionar 40 MW de potencia durante hasta siete minutos. [37] Las baterías de sodio y azufre se han utilizado para almacenarla energía eólica . [38] Un sistema de batería de 4.4 MWh que puede entregar 11 MW durante 25 minutos estabiliza la producción del parque eólico Auwahi en Hawai. [39]
Toda la vida
La duración de la batería (y su sinónimo duración de la batería) tiene dos significados para las baterías recargables, pero solo una para las no recargables. Para las recargables, puede significar el tiempo que un dispositivo puede funcionar con una batería completamente cargada o la cantidad de ciclos de carga / descarga posibles antes de que las celdas no funcionen satisfactoriamente. Para un no recargable, estas dos vidas son iguales ya que las células duran solo un ciclo por definición. (El término vida útil se usa para describir cuánto tiempo una batería conservará su rendimiento entre la fabricación y el uso). La capacidad disponible de todas las baterías disminuye con la disminución de la temperatura. A diferencia de la mayoría de las baterías actuales, la pila Zamboni, inventado en 1812, ofrece una vida útil muy larga sin necesidad de renovación o recarga, aunque suministra corriente solo en el rango de nanoamperios. El Oxford Electric Bell ha estado sonando casi continuamente desde 1840 con su par original de baterías, que se cree que son pilas de Zamboni. [ cita requerida ]
Autodescarga
Las baterías desechables generalmente pierden del 8 al 20 por ciento de su carga original por año cuando se almacenan a temperatura ambiente (20-30 ° C). [41] Esto se conoce como la tasa de "autodescarga" y se debe a las reacciones químicas "secundarias" que no producen corriente y que ocurren dentro de la celda, incluso cuando no se aplica carga. La tasa de reacciones secundarias se reduce para las baterías almacenadas a temperaturas más bajas, aunque algunas pueden dañarse si se congelan.
Las baterías recargables viejas se descargan más rápidamente que las baterías alcalinas desechables, especialmente las baterías a base de níquel; una batería de níquel cadmio (NiCd) recién cargada pierde el 10% de su carga en las primeras 24 horas, y luego se descarga a una tasa de aproximadamente 10% al mes. Sin embargo, las nuevas baterías de hidruro de níquel metal (NiMH) de baja autodescarga y los diseños modernos de litio muestran una tasa de autodescarga más baja (pero aún mayor que para las baterías primarias).
Corrosión
Las partes internas pueden corroerse y fallar, o los materiales activos pueden convertirse lentamente en formas inactivas.
Cambios en los componentes físicos.
El material activo en las placas de la batería cambia la composición química en cada ciclo de carga y descarga; El material activo puede perderse debido a cambios físicos de volumen, lo que limita aún más el número de veces que se puede recargar la batería. La mayoría de las baterías a base de níquel se descargan parcialmente cuando se compran, y deben cargarse antes del primer uso. [42] Las baterías de NiMH más nuevas están listas para usarse cuando se compran, y solo tienen un 15% de descarga en un año. [43]
Se produce cierto deterioro en cada ciclo de carga-descarga. La degradación generalmente ocurre porque el electrolito migra lejos de los electrodos o porque el material activo se desprende de los electrodos. Las baterías de NiMH de baja capacidad (1.700–2.000 mA · h) se pueden cargar unas 1.000 veces, mientras que las baterías de NiMH de alta capacidad (superiores a 2.500 mA · h) duran aproximadamente 500 ciclos. [44] Las baterías de NiCd tienden a estar clasificadas por 1,000 ciclos antes de que su resistencia interna aumente permanentemente más allá de los valores utilizables.
Peligros
Explosión
Esta sección necesita citas adicionales para la verificación . ( abril de 2017 ) ( Aprenda cómo y cuándo eliminar este mensaje de plantilla )
|
Una explosión de la batería generalmente es causada por un mal uso o mal funcionamiento, como intentar recargar una batería primaria (no recargable) o un cortocircuito .
Cuando una batería se recarga a una velocidad excesiva, se puede producir una mezcla de gases explosivos de hidrógeno y oxígeno más rápido de lo que puede escapar del interior de la batería (por ejemplo, a través de una ventilación incorporada), lo que conduce a la acumulación de presión y eventual explosión de La caja de la batería. En casos extremos, los productos químicos de la batería pueden rociar violentamente desde la carcasa y causar lesiones. La sobrecarga, es decir, intentar cargar una batería más allá de su capacidad eléctrica, también puede provocar una explosión de la batería, además de fugas o daños irreversibles. También puede causar daños al cargador o dispositivo en el que luego se usa la batería sobrecargada.
Las baterías de los automóviles tienen más probabilidades de explotar cuando un cortocircuito genera corrientes muy grandes. Dichas baterías producen hidrógeno , que es muy explosivo, cuando se sobrecargan (debido a la electrólisis del agua en el electrolito). Durante el uso normal, la cantidad de sobrecarga suele ser muy pequeña y genera poco hidrógeno, que se disipa rápidamente. Sin embargo, cuando "arranca" un automóvil, la alta corriente puede provocar la liberación rápida de grandes volúmenes de hidrógeno, que pueden encenderse explosivamente por una chispa cercana, por ejemplo, al desconectar un cable de puente .
La eliminación de una batería por incineración puede causar una explosión a medida que se acumula vapor dentro de la caja sellada.
Las retiradas de dispositivos que usan baterías de iones de litio se han vuelto más comunes en los últimos años. Esto es en respuesta a accidentes y fallas reportados, ocasionalmente ignición o explosión. [53] [54] Un resumen experto del problema indica que este tipo utiliza "electrolitos líquidos para transportar iones de litio entre el ánodo y el cátodo. Si una celda de batería se carga demasiado rápido, puede causar un cortocircuito y provocar explosiones. e incendios ". [55] [56]
Fuga
Muchos productos químicos de la batería son corrosivos, venenosos o ambos. Si se produce una fuga, ya sea espontáneamente o por accidente, los químicos liberados pueden ser peligrosos. Por ejemplo, las baterías desechables a menudo usan una "lata" de zinc como reactivo y como contenedor para contener los otros reactivos. Si este tipo de batería se descarga en exceso, los reactivos pueden salir a través del cartón y el plástico que forman el resto del contenedor. La fuga química activa puede dañar o desactivar el equipo que alimentan las baterías. Por esta razón, muchos fabricantes de dispositivos electrónicos recomiendan retirar las baterías de los dispositivos que no se utilizarán durante períodos prolongados de tiempo.
Materiales tóxicos
Muchos tipos de baterías emplean materiales tóxicos como plomo, mercurio y cadmio como electrodo o electrolito. Cuando cada batería llega al final de su vida útil, debe desecharse para evitar daños ambientales. [57] Las baterías son una forma de desecho electrónico (e-waste). Los servicios de reciclaje de desechos electrónicos recuperan sustancias tóxicas, que luego pueden usarse para baterías nuevas. [58] De los casi tres mil millones de baterías compradas anualmente en los Estados Unidos, alrededor de 179,000 toneladas terminan en vertederos en todo el país. [59] En los Estados Unidos, la Ley de gestión de baterías recargables que contiene mercuriode 1996 prohibió la venta de baterías que contienen mercurio, promulgó requisitos de etiquetado uniforme para las baterías recargables y exigió que las baterías recargables fueran fácilmente extraíbles. [60] California y la ciudad de Nueva York prohíben la eliminación de baterías recargables en desechos sólidos, y junto con Maine requieren el reciclaje de teléfonos celulares. [61] La industria de baterías recargables opera programas de reciclaje a nivel nacional en los Estados Unidos y Canadá, con puntos de entrega en los minoristas locales. [61]
La Directiva sobre baterías de la Unión Europea tiene requisitos similares, además de exigir un mayor reciclaje de baterías y promover la investigación sobre métodos mejorados de reciclaje de baterías . [62] De conformidad con esta directiva, todas las baterías que se vendan dentro de la UE deben estar marcadas con el "símbolo de recolección" (un contenedor con ruedas tachado). Esto debe cubrir al menos el 3% de la superficie de las baterías prismáticas y el 1.5% de la superficie de las baterías cilíndricas. Todo el embalaje debe estar marcado de la misma manera. [63]
Ingestión
Las baterías pueden ser dañinas o fatales si se ingieren . [64] Las células de botón pequeñas pueden ser tragadas, en particular por niños pequeños. Mientras está en el tracto digestivo, la descarga eléctrica de la batería puede provocar daños en los tejidos; [65] este daño ocasionalmente es grave y puede provocar la muerte. Las baterías de disco ingeridas generalmente no causan problemas a menos que se alojen en el tracto gastrointestinal . El lugar más común para alojar las baterías de disco es el esófago, lo que resulta en secuelas clínicas.. Es poco probable que las baterías que atraviesan con éxito el esófago se alojen en otro lugar. La probabilidad de que una batería de disco se aloje en el esófago es una función de la edad del paciente y el tamaño de la batería. Las baterías de disco de 16 mm se han alojado en el esófago de 2 niños menores de 1 año. [ cita requerida ] Los niños mayores no tienen problemas con baterías de menos de 21–23 mm. La necrosis por licuefacción puede ocurrir porque el hidróxido de sodio es generado por la corriente producida por la batería (generalmente en el ánodo). La perforación ha ocurrido tan rápido como 6 horas después de la ingestión.





















No hay comentarios:
Publicar un comentario