Una reacción de adición, en química orgánica, es una reacción donde una o más especies químicas se suman a otra (substrato) que posee al menos un enlace múltiple, formando un único producto, e implicando en el substrato la formación de dos nuevos enlaces y una disminución en el orden o multiplicidad de enlace.
Existen tres tipos principales de reacciones de adición:
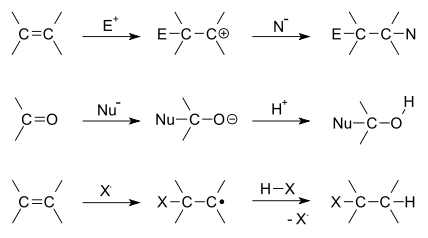
- Adiciones electrófilas (o eletrofílicas): donde el electrófilo se suele representar por un E+.
- Adiciones nucleófilas (o nucleofílicas): donde el nucleófilo se suele representar por un Nu-.
- Adiciones radicalarias: donde el electrón libre del radical generado se suele representar por un
 .
.
Las reacciones de adición están limitadas a compuestos químicos que contengan enlaces múltiples:
- Moléculas con dobles o triples enlaces carbono-carbono
- Moléculas con enlace múltiple carbono-heteroátomo como C=O, C=N o C≡N
Una reacción de adición es lo contrario a una reacción de eliminación. Por ejemplo la reacción de hidratación de un alqueno y ladeshidratación de un alcohol son una adición y eliminación respectivamente.
Reacciones de Adición
En general, reacciones de adición son todas las reacciones en las que se combinan dos moléculas para producir una sola.
El doble enlace de los alquenos está formado por un enlace  fuerte y un enlace
fuerte y un enlace  más débil; en consecuencia cabe esperar que cuando un alqueno reacciona con un compuesto de tipo X-Y se rompa el enlace
más débil; en consecuencia cabe esperar que cuando un alqueno reacciona con un compuesto de tipo X-Y se rompa el enlace  débil, formándose en su lugar dos enlaces
débil, formándose en su lugar dos enlaces  fuertes. Estas reacciones deben ser exotérmicas, puesto que se rompe un enlace débil y se forman dos nuevos enlaces más fuertes:
fuertes. Estas reacciones deben ser exotérmicas, puesto que se rompe un enlace débil y se forman dos nuevos enlaces más fuertes:
Valores estimados para  ºH de algunas reacciones de adición:
ºH de algunas reacciones de adición:
Las reacciones de adición son exotérmicas y, por tanto, son termodinámicamente favorables. Sin embargo, no se producen espontáneamente en general. El doble enlace C=C es un centro de alta densidad electrónica, puesto que hay una nube de electrones  por encima y por debajo del plano de los dos carbonos. Estos electrones
por encima y por debajo del plano de los dos carbonos. Estos electrones  están más disponibles para los reactivos electrófilos, es decir que buscan electrones y esta es la razón de que las reacciones de adición electrófila sean las más características de los alquenos.
están más disponibles para los reactivos electrófilos, es decir que buscan electrones y esta es la razón de que las reacciones de adición electrófila sean las más características de los alquenos.
También los alquenos reaccionan con facilidad con radicales libres = especies a las que le falta 1 electrón) y dan reacciones de adición radicalarias u homolíticas.
En esta lección, estudiaremos en primer lugar la hidrogenación de alquenos para pasar después al estudio de las reacciones de adición electrófila.
La reacción de Adkins-Peterson es un método de oxidación del metanol con oxígeno del aire para preparar formaldehído. Se utilizan óxidos de metales como catalizadores, tales como óxidos de hierro, trióxido de molibdeno o sus combinaciones.
La reacción fue desarrollada por Homer Burton Adkins y Wesley R. Peterson.

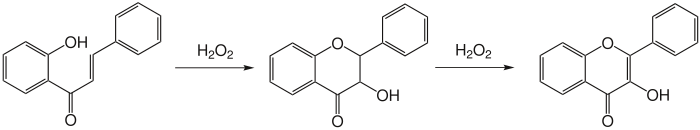
- Se han propuesto diversos mecanismos para explicar esta reacción. Lo que se sabe es que existe un mecanismo de dos etapas. En primer lugar, él se forma dihidroflavonol, que posteriormente es oxidado para formar flavonoles.Cabe mencionar que aquellos mecanismos en los cuales un epóxido funge como intermediario han sido excluidos, los cuales deberían ser obtenidos por oxidación con peróxidos de la doble ligadura, de acuerdo a la reacción de Prileschajev.3 Gormley et al. han propuesto que la reacción no procede a través de un epóxido.4El mecanismo posible tiene dos alternativas:
- Mecanismo concertado: El fenóxido nucleofílico formado en medio básico ataca a la doble ligadura y ésta al al peróxido de hidrógeno simultáneamente.
- Mecanismo en dos etapas: El fenóxido nucleofílico ataca a la doble ligadura para formar un enolato. Posteriormente éste ataca al peróxido de hidrógeno.


No hay comentarios:
Publicar un comentario