La L-aminoadipato-semialdehído deshidrogenasa-fosfopanteteinil transferasa es una enzima que en los humanos está codificada por el gen AASDHPPT . [5] [6] [7]
La proteína codificada por este gen es similar a Saccharomyces cerevisiae LYS5, que se requiere para la activación de la alfa-aminoadipato deshidrogenasa en la vía biosintética de la lisina . La alfa-aminoadipato deshidrogenasa de levadura convierte el semialdehído alfa-biosintético-aminoadipato en alfa-aminoadipato . Se ha sugerido que los defectos en el gen humano resultan en acidemia pipecólica .
| AASDHPPT | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Identificadores | |||||||||||||||||||||||||
| Alias | AASDHPPT , AASD-PPT, LYS2, LYS5, CGI-80, ACPS, aminoadipato-semialdehído deshidrogenasa-fosfopantetheinil transferasa | ||||||||||||||||||||||||
| ID externos | OMIM: 607756 MGI: 1914868 HomoloGene: 9130 GeneCards: AASDHPPT | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
El alfa-aminoadípico semialdehído sintasa es una enzima codificada por el gen AASS en humanos y está involucrada en su principal vía de degradación de lisina . Es similar a las enzimas separadas codificadas por los genes LYS1 y LYS9 en la levadura, y está relacionado, aunque no es similar en estructura, a la enzima bifuncional que se encuentra en las plantas. [5] [6] En los humanos, las mutaciones en el gen AASS y la enzima sintasa de semialdehído alfa-aminoadípica correspondiente están asociadas con la hiperlisinemia familiar . [5] [7] [8] Esta condición se hereda en un autosoma recesivopatrón y no se considera una condición particularmente negativa, por lo que es una enfermedad rara .
| AASS | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||||||||||||||||||
| Alias | AASS , LKR / SDH, LKRSDH, LORSDH, aminoadipato-semialdehído sintasa | ||||||||||||||||||||||||
| ID externos | OMIM: 605113 MGI: 1353573 HomoloGene: 4212 GeneCards: AASS | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Función [ editar ]
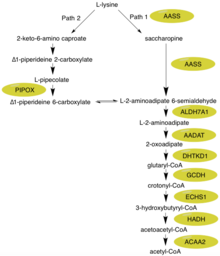
La proteína alfa-aminoadípica semialdehído sintasa cataliza los dos primeros pasos en la degradación de la lisina de los mamíferos a través de la vía de la sacarchapina dentro de las mitocondrias , que se cree que es la principal ruta metabólica para la degradación de la lisina en los eucariotas superiores . [11] [12] La vía secundaria específica en la que se enfoca esta enzima es la síntesis de glutaril-CoA a partir de L-lisina. [9] Glutaryl-CoA puede actuar como un intermediario en una ruta de conversión / degradación más expandida de L-lisina a acetil-CoA.
Dos componentes notables de la degradación de la L-lisina a través de la vía de la saccharopina son el glutamato de reacción / producto utilizado de forma intermedia y el eventual acetil-CoA sumidero de carbono . El glutamato es un compuesto importante dentro del cuerpo que actúa como un neurotransmisor relacionado con el aprendizaje y la enfermedad de Huntington. [13] [14] Se puede decir que el Acetyl-CoA tiene un nivel de importancia aún mayor, ya que actúa como uno de los componentes integrales del ciclo del ácido cítrico / Kreb, con la función principal de entregar un grupo acetil para ser oxidado para la producción de energía. [15] Por lo tanto, la función de la semialdehído sintasa alfa-aminoadípica está ligada a los niveles de dos compuestos integrales dentro del cuerpo.
Mecanismo [ editar ]
Primero, la porción N-terminal de esta enzima que contiene actividad de lisina - cetoglutarato reductasa (LOR / LKR) ( EC : 1.5.1.8) condensa lisina y 2-oxoglutarato en una molécula llamada saccharopina (Reacción 1 en la figura de la derecha) . [7] [11] Luego, la porción C-terminal de esta enzima, que contiene la actividad de la saccharopina deshidrogenasa (SHD) (EC: 1.5.1.9), cataliza la oxidación de la sacarcharopina para producir semialdehído y glutamato alfa-aminoadípico (Reacción 2 en la figura a la derecha). [7] [11] Nota: Estas reacciones son el reverso de los pasos correspondientes en las vías de biosíntesis de lisina presentes en levaduras y hongos . [16] [17] [18]
Estas reacciones se pueden visualizar también en forma de ecuación de reacción:
N (6) - (L-1,3-dicarboxipropil) -L-lisina + NADP + + H2O = L-lisina + 2-oxoglutarato + NADPH seguido de
N (6) - (L-1,3-dicarboxipropil) -L-lisina + NAD + + H2O = L-glutamato + (S) -2-amino-6-oxohexanoato + NADH. [9]
Estructura [ editar ]
La enzima humana nativa es bifuncional, al igual que el LKR / SHD que se encuentra en las plantas y, por lo tanto, se cree que tiene una estructura similar. [16] La bifuncionalidad de esta enzima proviene del hecho de que contiene dos sitios activos distintos, uno en su terminal C y otro en su terminal N. [7] La porción C-terminal de la semialdehído sintasa alfa-aminoadípica contiene la actividad SHD y la porción N-terminal contiene LKR. [19] Hasta la fecha, no se ha determinado una estructura de semialdehído sintasa alfa-aminoadípico. [20] La enzima no tiene una región enlazadora presente en las plantas entre sus terminales C y N, por lo que las teorías sugieren que la estructura real contiene una región de actividad LKR unida a una región de actividad SHD, como enMagnaporthe grisea . [19]
Relevancia de la enfermedad [ editar ]
La alfa-aminoadípica semialdehído sintasa está codificada por el gen AASS, y las mutaciones en este gen conducen a hiperlisinemia. [5] [7] Esto se caracteriza por una degradación deteriorada de la lisina que produce niveles elevados de lisina en la sangre y la orina. Estos niveles elevados de lisina no parecen tener ningún efecto negativo en el cuerpo. [8] Otros nombres para esta condición incluyen: [8]
- enfermedad por deficiencia de semialdehído alfa-aminoadípico
- hiperlysinemia familiar
- enfermedad de deficiencia de lisina alfa-cetoglutarato reductasa
- enfermedad por deficiencia de saccharopina deshidrogenasa
- saccharopinuria
La hiperlisinemia se caracteriza por niveles elevados de lisina en plasma que exceden los 600 μmol / L y pueden alcanzar hasta 2000 μmol / L. [21] [22] Estos niveles elevados de lisina no parecen tener ningún efecto negativo en el cuerpo. [8] La razón principal de esto es que pueden tener lugar varias reacciones bioquímicas alternativas. Primero, la lisina se puede usar en lugar de la ornitina en el ciclo de la urea, lo que resulta en la producción de homoarginina. [23] Además, a pesar de que la mayoría de los mamíferos usan la vía de la saccharopina para la mayor parte de la degradación de la lisina (Ruta 1), el cerebro tiene una ruta alternativa (Ruta 2) que atraviesa un intermedio de ácido L-pipecólico; ambos pueden verse en el figura. [23] Es importante tener en cuenta que la ruta 1 tiene lugar en las mitocondrias, mientras que la ruta 2 tiene lugar en el peroxisoma. [12] Al observar otras enzimas clave dentro de la vía de degradación de L-lisina, ALDH7A1 es deficiente en niños con convulsiones dependientes de piridoxina. [24] La GCDH es deficiente en la aciduria glutárica tipo 1. [25] El 2-oxoadipato intermedio se metaboliza por la 2-oxoadipato deshidrogenasa, que se asemeja al complejo de enzimas del ciclo del ácido cítrico / Kreb 2-oxoglutarato deshidrogenasa. [10]
Hasta el momento se han descrito dos tipos de hiperlisinemia familiar: el tipo I se asocia con una deficiencia combinada de las dos actividades enzimáticas, LOR y SDH, mientras que en la hiperlysinemia familiar tipo II solo se deteriora la actividad de la sacarhidropinasa deshidrogenasa. [26] [27] La hiperlisinemia tipo II también se conoce como saccharopinuria. [10]
Una condición adicional que se ha demostrado que está relacionada con la hiperlisinemia es la deficiencia de dienoil-CoA reductasa, aunque este es un descubrimiento relativamente reciente y no hay muchas publicaciones que lo respalden.









No hay comentarios:
Publicar un comentario