Ley de Graham:
La Ley de Graham es una ley de los gases que relaciona la velocidad de los gases con sus masas molares.
Graham descubrió en 1829:
- Las velocidades de efusión (salida a través de poros) y difusión (expansión hasta ocupar el volumen del recipiente) de los gases son inversamente proporcionales a la raíz cuadrada de sus masas molares:
v1 / v2 = (M2 / M1)-1/2
donde:- v1, v2 son las masas de difusión / efusión del gas
- M2 / M1 son las masas molares
ley de Graham, formulada en 1829 por el químico británico Thomas Graham, establece que las velocidades de difusión y efusión de los gases son inversamente proporcionales a las raíces cuadradas de sus respectivas masas molares.
Siendo  las velocidades y
las velocidades y  las masas molares.
las masas molares.
 las velocidades y
las velocidades y  las masas molares.
las masas molares.
Efusión es el flujo de partículas de gas a través de orificios estrechos o poros.
Se hace uso de este principio en el método de efusión de separación de isótopos.
El fenómeno de efusión está relacionado con la energía cinética de las moléculas. Gracias a su movimiento constante, las partículas de una sustancia se distribuyen uniformemente en el espacio libre. Si hay una concentración mayor de partículas en un punto habrá más choques entre sí, por lo que hará que se muevan hacia las regiones de menor número: las sustancias se efunden de una región de mayor concentración a una región de menor concentración.
Velocidad de difusión de los gases
De los 5 estados de la materia, los gases presentan la mayor facilidad de difusión de sus respectivas partículas, como ocurre en el aire, ya que sus moléculas tienen velocidades superiores. Las moléculas de diferentes gases tienen velocidades diferentes, a temperatura diferente, dependiendo únicamente de la presión...
Ley de difusión de Graham
La difusión es el proceso por el cual una sustancia se distribuye uniformemente en el espacio que la encierra o en el medio en que se encuentra. Por ejemplo: si se conectan dos tanques conteniendo el mismo gas a diferentes presiones, en corto tiempo la presión es igual en ambos tanques. También si se introduce una pequeña cantidad de gas A en un extremo de un tanque cerrado que contiene otro gas B, rápidamente el gas A se distribuirá uniformemente por todo el tanque.
La difusión es una consecuencia del movimiento continuo y elástico de las moléculas gaseosas. Gases diferentes tienen distintas velocidades de difusión. Para obtener información cuantitativa sobre las velocidades de difusión se han hecho muchas determinaciones. En una técnica el gas se deja pasar por orificios pequeños a un espacio totalmente vacío; la distribución en estas condiciones se llama efusión y la velocidad de las moléculas es igual que en la difusión. Los resultados son expresados por la ley de Graham. «La velocidad de difusión de un gas es inversamente proporcional a la raíz cuadrada de su densidad.»
En donde v1 y v2 son las velocidades de difusión de los gases que se comparan y d1 y d2 son las densidades. Las densidades se pueden relacionar con la masa y el volumen porque (d=m/v ); cuando M sea igual a la masa (peso) molecular y v al volumen molecular, se puede establecer la siguiente relación entre las velocidades de difusión de dos gases y su peso molecular:
y como los volúmenes moleculares de los gases en condiciones iguales de temperatura y presión son idénticos, es decir V1 = V2, en la ecuación anterior sus raíces cuadradas se cancelan, quedando:
Es decir: la velocidad de difusión de un gas es inversamente proporcional a la raíz cuadrada de su peso molecular.
Ejemplo 1
¿Qué gas tiene mayor velocidad de difusión, el neón o el nitrógeno?
- Respuesta
Primero se necesita conocer las densidades de los gases que intervienen. Como un mol de gas ocupa 22,4 L a T.P.E., sus densidades serán (peso molecular/volumen).
- neón = 20.18/22,4 = 0,9 g/l
- nitrógeno = 14.01/22,4 = 0.6 g/l
- sea v1 = velocidad de difusión del nitrógeno y v2 = velocidad de difusión del neón.
Debido a que la velocidad de difusión es inversamente proporcional a las densidades, tendrá mayor velocidad de difusión el menos denso.
Ejemplo 2
¿Cuál es la velocidad de difusión del oxígeno con respecto al hidrógeno?
Si la masa molar del oxígeno es 32 y la del hidrógeno es 2 (gases diatómicos):
La velocidad de efusión del hidrógeno es 4 veces mayor que la del oxígeno.
Ley de Graham: Efusión y difusión gaseosas. Velocidades Moleculares
Objetivo: Estudiar la efusión y difusión gaseosas y su relación con los movimientos moleculares.
Fundamento teórico
De acuerdo con la Teoría Cinética de los gases, (1) las moléculas de los gases están en rápido movimiento y (2) sus velocidades promedio son proporcionales a la temperatura absoluta. También supone (3) que a la misma temperatura, la energía cinética promedio de las moléculas de gases diferentes es igual. La ley de difusión de Graham se basa en estas tres suposiciones anteriores.
Donde V1, M1 y D1 representan la Velocidad de Difusión, Peso Molecular y Densidad del primer gas, y V2, M2 y D2 representan la Velocidad de Difusión, Peso Molecular y Densidad del segundo gas.
El Amoniaco, NH3, y el Ácido Clorhídrico, HCl, son gases que al ponerse en contacto reaccionan para formar otro compuesto, caracterizado por ser un sólido de color blanco.
La efusión consiste en el paso de las partículas de un gas a través de una pared (como un pequeño orificio) hacia otra región en la que no hay partículas. Ésta puede entenderse considerando la velocidad de las partículas gaseosas en una dimensión. La razón de efusión d N/(d t) es proporcional a la velocidad promedio de una partícula en esa dimensión , al área del orificio A y a la densidad de partículas presentes
, al área del orificio A y a la densidad de partículas presentes 
donde simplificando da como resultado 
La difusión es el movimiento de las partículas de un gas a través de otro gas como resultado de diferencias de concentración
Suponiendo que dos gases se encuentran en un sistema separados al principio y que además el movimiento de las partículas es en una dimensión; ¿a qué razón de cambio se aproximan las partículas gaseosas a una superficie plana de área A, perpendicular a la dirección en que éstas se desplazan? Los experimentos demuestran que la razón de flujo de las partículas gaseosas P1 a través de un plano de área a hacia el interior de una región ocupada por partículas de un gas P2 se calcula mediante la expresión
La constante D depende de la identidad del gas P1 y de la del gas en el que penetra. Existen entonces dos tipos de difusión; la autodifusión, de coeficiente D; y la difusión mutua de coeficiente D12; donde se deduce que su valor es
r1 y r2 son los radios de P1 y P2, y
Como las partículas gaseosas tienen una trayectoria libre media dada la cantidad de choques que presentan entre sí y con otras de gases diferentes y que por lo tanto la efusión y la difusión son procesos muy lentos y en realidad el transporte de moléculas gaseosas en condiciones reales es debido principalmente a la convección.
Tanto la difusión como la efusión son inversamente proporcionales a la raíz cuadrada de la masa de la partícula gaseosa (o de la masa reducida del sistema de dos componentes). Esta idea, que se expresa como
Razón de la efusión o difusión del gas 
recibe el nombre de ley de Graham.Esta ley constituye una buena generalización pero se abusa de ella porque la convección en los fluidos puede superar a la efusión y la difusión puras.
En la experiencia compararemos los valores de efusión (masa de los gases individuales) y los de difusión de un gas a través de otro (si tomamos la masa reducida respecto al aire para cada gas
Materiales:
1 vaso de precipitado de 100 ml, 2 tubos de ensayo, 1 tubo de vidrio de 1 m (aprox), 1 soporte universal, 2 tapones de caucho, Algodón, Cinta métrica, 1 calibre, 1 pipeta graduada o un gotero, Solución Concentrada de Amoniaco,(NH4OH), Solución Concentrada de Ácido Clorhídrico, (HCl)
Montaje experimental para la demostración de la Ley de Graham
Procedimiento
- Colocar en un soporte universal un tubo de vidrio cuya longitud se ha determinado con anterioridad.
- En un extremo del tubo introduzca un algodón impregnado con la Solución concentrada de Amoniaco, teniendo cuidado de no dejar que este químico entre en contacto con sus manos. Pueden usarse guantes de látex para la operación.(ver figura 1). Como una alternativa de seguridad se pueden usar Bulbos de gotero, para dentro de estos, poner un algodón impregnado con la sustancia e introducir el extremo tubo de vidrio dentro de éste, asegurando que el tubo quede sellado herméticamente.
- En el otro extremo del tubo coloque otro algodón impregnado con Ácido Clorhídrico, una vez hecho, tome este instante como tiempo Cero y anote el tiempo cuando finaliza la operación, es decir, cuando aparece el anillo de sólido blanco. Tratar de colocar simultáneamente ambos algodones.
- Observe cuidadosamente el proceso de difusión anotando el tiempo transcurrido para que los dos gases se pongan en contacto, lo cual se sabe por la aparición de un gas blanco debido a la formación de un compuesto, este tiempo se considera tiempo final.
- Mida cuidadosamente la distancia que hay desde el centro del anillo donde aparecen los humos blancos hasta cada uno de los bordes extremos del tubo, tomando las mediciones de la distancia recorrida por cada gas.
- Repetir la experiencia con un tubo de diferente
EXPERIMENTO 1
|
EXPERIMENTO 2
| |||
HCl
|
NH3
|
HCl
|
NH3
| |
| Longitud de Tubo en cm | ||||
| Distancia Recorrida en cm | ||||
| Tiempo Inicial , seg | ||||
| Tiempo final, seg | ||||
| Tiempo empleado, seg | ||||
| Velocidad de difusión (cm/seg) | ||||
Promedio de la distancia recorrida por el HCl : cm
Promedio de la distancia recorrida por el NH3 : cm
Promedio del tiempo empleado por el HCl : seg
Promedio del Tiempo empleado por el NH3 : seg
Promedio de Velocidad de difusión de HCl: (cm/seg)
Promedio de Velocidad de difusión de NH3 : (cm/seg)
Cálculo de la razón de efusión para el amoníaco y el cloruro de hidrógeno, sustituyendo m por M y k por R en J/molK, recuerde que para ello se deben conocer el área transversal del tubo
Amoníaco………………………………………………………………………………………………………………………………………………….
Cloruro de hidrógeno………………………………………………………………………………………………………………………………
Cálculo de la razón de difusión según las masas molares
Cálculo de la masa molar reducida del amoníaco (17g/mol) respecto al aire (masa molar del aire 28,9 g/mol)
Cálculo de la masa molar reducida del cloruro de hidrógeno (36,5 g/mol) respecto al aire
Calculo de la razón de difusión de ambos gases según las masas reducidas molares respecto al aire.
Análisis de las diferencias porcentuales de los valores obtenidos en forma teórica y experimental.
http://fisicoquimica56.blogspot.com.es/2012/04/ley-de-graham-efusion-y-difusion.html
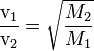


No hay comentarios:
Publicar un comentario