La reacción aldólica es una reacción química de formación de enlaces carbono-carbono en química orgánica.1 2 3 En su forma normal, la reacción aldólica involucra laadición nucleofílica del enolato de una cetona a un aldehído, para formar una β-hidroxicetona, o "aldol" (aldehído + alcohol), una unidad estructural que se encuentra en muchas moléculas presentes en moléculas de origen natural y en fármacos.4 5 6 Algunas veces, el producto de la adición aldólica pierde una molécula de aguadurante la reacción para formar una cetona α,β-insaturada, lo que se conoce como condensación aldólica. La reacción aldólica fue descubierta independientemente porCharles-Adolphe Wurtz7 8 9 y Alexander Porfyrevich Borodin en 1872.10 Borodin observó la dimerización aldólica a 3-hidroxibutanal a partir de acetaldehído bajo condiciones ácidas. La reacción aldólica se usa ampliamente en la producción a gran escala de productos químicos que servirán en sucesivos procesos como materias primas, tales como el pentaeritritol11 y en la industria farmacéutica para la síntesis de medicamentos de pureza óptica. Por ejemplo, la ruta que inicialmente empleó la empresa Pfizer para sintetizar el fármaco anticolesterolémico Lipitor (atorvastatina), aprobado en 1996, empleaba dos reacciones aldólicas, permitiendo la producción de cantidades del fármaco en la escala de los multigramos.12 13
La unidad estructural aldólica es especialmente común en los policétidos, una familia de productos naturales de los cuales derivan muchos fármacos, incluyendo el potente inmunosupresor FK506, los antibióticos tetraciclinas, y el agente antifúngico anfotericina B. La amplia investigación en la reacción aldólica ha producido métodos altamente eficientes que lo permiten, ya que de otro modo sería muy complicada síntesis total de muchos policétidos en el laboratorio.14 Esto es importante porque muchos policétidos, junto con otras moléculas biológicamente activas, están presentes en la naturaleza en cantidades no prácticas y pequeñas para investigaciones posteriores. La síntesis de muchos compuestos, otrora considerada casi imposible, puede ser efectuada casi rutinariamente a escala de laboratorio, y se acerca a la viabilidad económica a gran escala en algunos casos, tales como el agente antitumoral altamente activo discodermolida. En bioquímica, la reacción aldólica es uno de los pasos clave de la glicólisis, donde es catalizada por enzimas denominadas aldolasas.
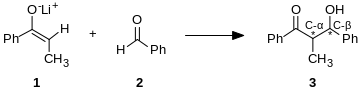
La reacción aldólica es particularmente valiosa en síntesis orgánica porque conduce a la formación de productos con dos nuevos centros estereogénicos (en el carbono-α y en el carbono-β del aducto aldólico, marcado con asteriscos en el esquema anterior). Los métodos modernos, descritos más adelante, permiten controlar la configuración relativa y absoluta de estos centros. Esto es de particular importancia cuando se sintetizan fármacos, dado que las moléculas con la misma conectividad estructural pero diferente estereoquímica suelen tener propiedades biológicas ampliamente distintas.
Se puede emplear una variedad de nucleófilos en la reacción aldólica, incluyendo el enol, enolato, éter de enol de las cetonas, aldehídos y muchos otros compuestoscarbonílicos. Generalmente, el compañero electrofílico es un aldehído, aunque existen muchas variaciones, como la reacción de Mannich. Cuando el nucleófilo y elelectrófilo son distintos (el caso más frecuente), la reacción es denominada reacción aldólica cruzada (en oposición a la que forma dímeros en una dimerización aldólica).
Puesta a punto experimental típica para una reacción aldólica. Una solución dediisopropilamida de litio (LDA) en tetrahidrofurano(THF) (en el matraz de la derecha) se agrega lentamente a una solución de propionato de tert-butilo en el matraz de la izquierda, formando su enolato de litio. Luego puede agregarse un aldehído para iniciar la reacción de adición aldólica. Ambos matraces están sumergidos en un baño refrigerantede hielo seco/acetona (-78 °C), cuya temperatura está siendo monitorizada por un termopar (el cable de la izquierda).
Mecanismos
La reacción aldólica puede proceder mediante dos mecanismos fundamentalmente distintos. En el "mecanismo enólico", los compuestos carbonílicos, tales como losaldehídos y cetonas, pueden ser convertidos a enoles o éteres de enol. Estos compuestos, al ser nucleofílicos en el carbono-α, pueden atacar a los compuestos carbonílicos protonados especialmente reactivos, tales como los aldehídos protonados. En el "mecanismo del enolato", los compuestos carbonílicos, al tener átomos de hidrógeno ácidos, pueden ser deprotonados para formar enolatos, que son mucho más nucleofílicos que los enoles o los éteres de enol y pueden atacar a los electrófilosdirectamente. El electrófilo usual es un aldehído, dado que las cetonas son mucho menos reactivas.
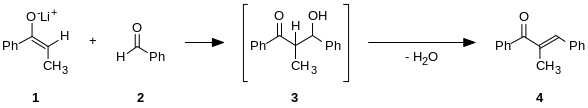
Si las condiciones son particularmente fuertes (por ejemplo, metóxido de sodio, hidróxido de sodio, reflujo), puede producirse la condensación, pero esto generalmente puede evitarse con reactivos que requieren condiciones moderadas o bajas temperaturas (por ejemplo, LDA -una base fuerte-, THF, -78 °C). Aunque la adición aldólica generalmente avanza hasta casi completarse, la reacción no es irreversible, pues el tratamiento de los aductos aldólicos con bases fuertes generalmente induce la ruptura retro-aldólica (produciendo los materiales iniciales). Las condensaciones aldólicas son irreversibles.
Mecanismo enólico
Cuando se usa un catalizador ácido, la etapa inicial en el mecanismo de reacción involucra la tautomerización del compuesto carbonílico para formar el enol. El ácido también sirve para activar el grupo carbonílico de otra molécula por protonación, haciéndolo altamente electrofílico. El enol es nucleofílico en el carbono-α, permitiéndole atacar el compuesto carbonílico protonado, conduciendo al aldol después de la deprotonación. Éste suele deshidratarse para producir el compuesto carbonílico insaturado. El esquema muestra una autocondensación catalizada por ácido típica de un aldehído.
Mecanismo del enolato
Si el catalizador es una base moderada como el ion hidróxido o un alcóxido, la reacción aldólica procede vía el ataque nucleofílico del enolato estabilizado por resonancia al grupo carbonilo de otra molécula. El producto es la sal de alcóxido del producto aldólico. A continuación se forma el aldol mismo, y puede sufrir deshidratación para producir el compuesto carbonílico insaturado. El esquema muestra un mecanismo simple para la reacción aldólica catalizada por bases de un aldehído consigo mismo.
Reacción aldólica catalizada por bases (mostrada usando −OCH3 como base)
Deshidratación catalizada por bases (algunas veces escrita en un solo paso)
Aunque sólo se requiere una cantidad catalítica de base en algunos casos, el procedimiento más usual es usar una cantidad estequiométrica de base fuerte tal como elLDA o NaHMDS. En este caso, la formación de enolato es irreversible, y el producto aldólico no se forma hasta que el alcóxido metálico del producto aldólico es protonado en un paso posterior.
Modelo de Zimmerman-Traxler
Se conocen formas más refinadas del mecanismo. En 1957, Zimmerman y Traxler propusieron que algunas reacciones aldólicas tienen estados de transición de seis miembros en conformación de silla.15 Esto es conocido como modelo de Zimmerman-Traxler. Los E-enolatos conducen a la formación de productos anti, mientras que los Z-enolatos conducen a la formación de productos syn. Los factores que controlan la selectividad son la preferencia para colocar los sustituyentes ecuatorialmente en los estados de transición de seis miembros y evitar interacciones syn-pentano respectivamente.16 E y Z se refieren a las relaciones estereoquímicascis-trans entre los átomos de oxígeno de enolato que tienen el contraión positivo, y el grupo de máxima prioridad en el carbono α. En realidad, sólo algunas especies como el litio y el boro siguen el modelo de Zimmerman-Traxler. En consecuencia, en algunos casos el resultado estereoquímico de la reacción puede ser impredecible.







No hay comentarios:
Publicar un comentario