El calor latente es la energía térmica liberada o absorbida, por un cuerpo o un sistema termodinámico , durante un proceso de temperatura constante, generalmente una transición de fase de primer orden .
El calor latente puede entenderse como energía térmica en forma oculta que se suministra o extrae para cambiar el estado de una sustancia sin cambiar su temperatura. Algunos ejemplos son el calor latente de fusión y el calor latente de vaporizacióninvolucrados en los cambios de fase , es decir, una sustancia que se condensa o vaporiza a una temperatura y presión específicas. [1] [2]
El término fue introducido alrededor de 1762 por el químico británico Joseph Black . Se deriva del latín latere ( para permanecer oculto ). Black usó el término en el contexto de calorimetría donde una transferencia de calor causó un cambio de volumen en un cuerpo mientras su temperatura era constante.
En contraste con el calor latente, el calor sensible es una transferencia de calor que resulta en un cambio de temperatura en un cuerpo.
Uso [ editar ]
Los términos "calor sensible" y "calor latente" se refieren a los tipos de transferencia de calor entre un cuerpo y sus alrededores; Dependen de las propiedades del cuerpo. El ″ calor sensible ″ se "percibe" o se siente en un proceso como un cambio en la temperatura del cuerpo. El ″ calor latente ″ se transfiere de calor en un proceso sin cambio de la temperatura del cuerpo, por ejemplo, en un cambio de fase (sólido / líquido / gas).
Tanto el calor sensible como el latente se observan en muchos procesos de transferencia de energía en la naturaleza. El calor latente se asocia con el cambio de fase del agua atmosférica o del océano, la vaporización , la condensación , la congelación o la fusión , mientras que el calor sensible es la energía transferida que es evidente en el cambio de la temperatura de la atmósfera o el océano, o hielo, sin esos cambios de fase , aunque se asocia con cambios de presión y volumen.
El uso original del término, tal como lo introdujo Black, se aplicó a sistemas que se mantuvieron intencionalmente a temperatura constante. Dicho uso se refería al calor latente de expansión y varios otros calentamientos latentes relacionados. Estos calores latentes se definen independientemente del marco conceptual de la termodinámica. [3]
Cuando un cuerpo se calienta a temperatura constante por radiación térmica en un campo de microondas, por ejemplo, puede expandirse en una cantidad descrita por su calor latente con respecto al volumen o calor latente de expansión , o aumentar su presión en una cantidad descrita por su latente Calor con respecto a la presión . [4]El calor latente es la energía liberada o absorbida por un cuerpo o un sistema termodinámico , durante un proceso de temperatura constante. Dos formas comunes de calor latente son el calor latente de fusión ( fusión ) y el calor latente de vaporización ( ebullición).). Estos nombres describen la dirección del flujo de energía cuando se cambia de una fase a otra: de sólido a líquido y de líquido a gas.
En ambos casos, el cambio es endotérmico , lo que significa que el sistema absorbe energía. Por ejemplo, cuando el agua se evapora, se requiere energía para que las moléculas de agua superen las fuerzas de atracción entre ellas, la transición del agua al vapor requiere una entrada de energía.
Si el vapor se condensa en un líquido sobre una superficie, entonces la energía latente del vapor absorbida durante la evaporación se libera como el calor sensible del líquido en la superficie.
El gran valor de la entalpía de la condensación del vapor de agua es la razón por la que el vapor es un medio de calentamiento mucho más efectivo que el agua hirviendo y es más peligroso.
Meteorología [ editar ]
En meteorología , el flujo de calor latente es el flujo de calor de la superficie de la Tierra a la atmósfera que se asocia con la evaporación o transpiración del agua en la superficie y la condensación subsiguiente del vapor de agua en la troposfera . Es un componente importante del presupuesto de energía de la superficie de la Tierra. El flujo de calor latente se ha medido comúnmente con la técnica de relación de Bowen , o más recientemente desde mediados del siglo XX por el método Jonathan Beaver .
Historia [ editar ]
La palabra inglesa latente viene del latín latín , que significa mentir oculta . [5] [6] El término calor latente se introdujo en la calorimetría alrededor de 1750 cuando Joseph Black , encargado por los productores de whisky escocés en busca de cantidades ideales de combustible y agua para su proceso de destilación, [7] para estudiar cambios en el sistema, como de volumen y presión, cuando el sistema termodinámico se mantuvo a temperatura constante en un baño térmico. James Prescott Joule caracterizó la energía latente como la energía de interacción en una configuración dada de partículas, es decir, una forma de energía potencial, y el calor sensible como una energía que fue indicada por el termómetro, [8] relacionando este último con la energía térmica .
Calor latente específico [ editar ]
Un calor latente específico ( L ) expresa la cantidad de energía en forma de calor ( Q ) necesaria para efectuar por completo un cambio de fase de una unidad de masa ( m ), generalmente 1 kg , de una sustancia como una propiedad intensiva :
Las propiedades intensivas son características del material y no dependen del tamaño o extensión de la muestra. Comúnmente citados y tabulados en la literatura son el calor latente específico de fusión y el calor latente específico de vaporización para muchas sustancias.
A partir de esta definición, el calor latente para una masa dada de una sustancia se calcula por
dónde:
- Q es la cantidad de energía liberada o absorbida durante el cambio de fase de la sustancia (en kJ o en BTU ),
- m es la masa de la sustancia (en kg o en libras ), y
- L es el calor latente específico para una sustancia en particular (kJ kg −1 o en BTU lb −1 ), ya sea L f para la fusión o L v para la vaporización.
Tabla de calores latentes específicos [ editar ]
La siguiente tabla muestra los calores latentes específicos y el cambio de temperatura de fase (a presión estándar) de algunos fluidos y gases comunes. [ cita requerida ]
| Sustancia | SLH de Fusion KJ / kg | Punto de fusión ° C | SLH de Vaporización kJ / kg | Punto de ebullición ° C |
|---|---|---|---|---|
| Alcohol etílico | 108 | −114 | 855 | 78.3 |
| Amoníaco | 332.17 | −77.74 | 1369 | −33.34 |
| Dióxido de carbono | 184 | −78 | 574 | −57 |
| Helio | 21 | −268.93 | ||
| Hidrógeno (2) | 58 | −259 | 455 | −253 |
| Plomo [9] | 23.0 | 327.5 | 871 | 1750 |
| Nitrógeno | 25.7 | −210 | 200 | −196 |
| Oxígeno | 13.9 | −219 | 213 | −183 |
| Refrigerante R134a | −101 | 215.9 | −26.6 | |
| Refrigerante R152a | −116 | 326.5 | -25 | |
| Silicio [10] | 1790 | 1414 | 12800 | 3265 |
| Tolueno | 72.1 | −93 | 351 | 110.6 |
| Trementina | 293 | |||
| Agua | 334 | 0 | 2264.705 | 100 |
Calor latente específico para la condensación de agua en las nubes [ editar ]
El calor latente específico de la condensación de agua en el rango de temperatura de −25 ° C a 40 ° C se aproxima mediante la siguiente función cúbica empírica:
donde la temperatura Se toma como el valor numérico en ° C.
Para la sublimación y la deposición desde y hacia el hielo, el calor latente específico es casi constante en el rango de temperatura de -40 ° C a 0 ° C y se puede aproximar mediante la siguiente función cuadrática empírica:
Variación con la temperatura (o presión) [ editar ]
| Física computacional |
|---|
 |
| Análisis de datos · Visualización |
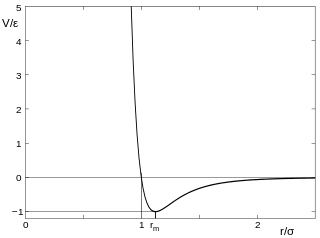
El potencial de Lennard-Jones (también denominado potencial de LJ , potencial de 6-12 o potencial de 12-6) es un modelo matemáticamente simple que se aproxima a la interacción entre un par de átomos o moléculas neutrales . Una forma de este potencial interatómico fue propuesta por primera vez en 1924 por John Lennard-Jones . [1] Las expresiones más comunes del potencial LJ son
donde ε es la profundidad del pozo potencial , σ es la distancia finita a la cual el potencial entre partículas es cero, r es la distancia entre las partículas, y r m es la distancia a la cual el potencial alcanza su mínimo. En r m , la función potencial tiene el valor −ε. Las distancias se relacionan como r m = 2 1/6 σ ≈ 1.122σ. Estos parámetros se pueden ajustar para reproducir datos experimentales o química cuántica precisa.cálculos Debido a su simplicidad computacional, el potencial de Lennard-Jones se usa ampliamente en simulaciones por computadora, aunque existen potenciales más precisos.
Explicación [ editar ]
El término r −12 , que es el término repulsivo, describe la repulsión de Pauli en rangos cortos debido a la superposición de orbitales de electrones , y el término r −6 , que es el término atractivo de largo alcance, describe la atracción a rangos largos ( fuerza de van der Waals , o fuerza de dispersión ).
La diferenciación del potencial de LJ con respecto a r da una expresión para la fuerza intermolecular neta entre 2 moléculas. Esta fuerza intermolecular puede ser atractiva o repulsiva, dependiendo del valor de r . Cuando r es muy pequeño, las moléculas se repelen entre sí.
Mientras que la forma funcional del término atractivo tiene una clara justificación física, el término repulsivo no tiene una justificación teórica. Se usa porque se aproxima bien a la repulsión de Pauli y es más conveniente debido a la eficiencia computacional relativa de calcular r 12 como el cuadrado de r 6 .
El potencial de LJ es una aproximación relativamente buena. Debido a su simplicidad, a menudo se usa para describir las propiedades de los gases y para modelar las interacciones de dispersión y superposición en modelos moleculares. Es especialmente preciso para los átomos de gas noble y es una buena aproximación a distancias largas y cortas para los átomos y moléculas neutros.
La disposición de energía más baja de un número infinito de átomos descrito por un potencial de Lennard-Jones es un empaquetamiento cerrado hexagonal . Al elevar la temperatura, la disposición de energía libre más baja seconvierte en un empaque cúbico , y luego en líquido. Bajo presión, la estructura de menor energía cambia entre el empaque cerrado cúbico y hexagonal. [2] Los materiales reales también incluyen estructuras cúbicas centradas en el cuerpo . [3]
El potencial de Lennard-Jones (12,6) mejoró con el potencial de Buckingham (exp-6) propuesto más tarde por Richard Buckingham , incorporando un parámetro extra y la parte repulsiva se reemplaza por una función exponencial : [4]
Otros métodos más recientes, como el potencial de Stockmayer , describen la interacción de las moléculas con mayor precisión. Los métodos de química cuántica , la teoría de perturbación de Møller-Plesset , el método de clúster acoplado o la interacción de configuración completa pueden proporcionar resultados extremadamente precisos, pero requieren un gran costo de computación .
Expresiones alternativas [ editar ]
Hay muchas formas diferentes de formular el potencial de Lennard-Jones. Algunas formas comunes siguen.
Forma AB [ editar ]
Esta forma es una formulación simplificada que es utilizada por algunos programas de simulación:
Una forma más matemáticamente general, que contiene una variable adicional n es
dónde es la energía de enlace de la molécula (la energía requerida para separar los átomos). El exponente npodría estar relacionado con la constante de resorte k (en, dónde ) como
de donde n puede calcularse si k es conocido. Normalmente se conocen los estados armónicos,, dónde . n también puede relacionarse con la velocidad de grupo en un cristal,
donde a es la distancia de la red, y m es la masa de un átomo.
Forma truncada y desplazado [ editar ]
Para ahorrar tiempo de computación y satisfacer la convención de imagen mínima cuando se usan condiciones de límite periódicas , el potencial de Lennard-Jones a menudo se trunca a una distancia de corte de r c = 2.5 σ , donde
(1)
es decir, en r c = 2.5 σ , el potencial de Lennard-Jones V LJ es aproximadamente 1/60 de su valor mínimo, ε (la profundidad del pozo potencial). Más allá, el potencial truncado se pone a cero.
Para evitar una discontinuidad de salto en , el potencial LJ debe desplazarse hacia arriba un poco, de modo que el potencial truncado sea cero exactamente en la distancia de corte, .
Para mayor claridad, vamos denotar el potencial de LJ como se define anteriormente, es decir,
(2)
(3)
Se puede verificar fácilmente que V LJ trunc ( r c ) = 0, eliminando así la discontinuidad del salto en r = r c . Aunque el valor del potencial de Lennard Jones (no desplazado) en r = r c = 2.5 σ es bastante pequeño, el efecto del truncamiento puede ser significativo, por ejemplo, en el punto crítico de gas-líquido. [7] [8] La energía potencial a menudo se puede corregir para este efecto en un campo de media agregando las llamadas correcciones de cola. [9] La estabilidad de la estructura cristalina es extremadamente sensible al truncamiento: una amplia variedad de apilamientos compactos compactos puede tener la energía más baja.
Unidades sin dimensiones (reducidas) [ editar ]
| Propiedad | Símbolo | Forma reducida |
|---|---|---|
| Longitud | ||
| Hora | ||
| Temperatura | ||
| Fuerza | ||
| Energía | ||
| Presión | ||
| Densidad numérica | ||
| Densidad | ||
| Tensión superficial |
Las unidades sin dimensiones se pueden definir en función del potencial de Lennard-Jones, que son convenientes para las simulaciones de dinámica molecular. Desde un punto numérico, las ventajas de las unidades adimensionales incluyen valores computacionales que están más cerca de la unidad, utilizando ecuaciones simplificadas y siendo capaz de escalar fácilmente los resultados. [10]
Cuando se usa el potencial de Lennard-Jones para simulaciones de dinámica molecular, las unidades adimensionales más convenientes se obtienen al elegir la longitud σ, la masa m y la energía ε como factores de escala para las diversas propiedades físicas. [10]
Limitaciones [ editar ]
- El potencial de LJ tiene solo dos parámetros ( A y B ), que determinan las escalas de longitud y energía. Por lo tanto, el potencial está limitado en la precisión con que se puede adaptar a las propiedades de cualquier material real.
- Con el potencial de LJ, el número de átomos unidos a un átomo no afecta la fuerza de unión. La energía de enlace por átomo aumenta así linealmente con el número de enlaces por átomo. Pero los experimentos muestran que en los materiales reales, la energía de enlace por átomo aumenta de forma cuadrática con el número de enlaces. [11]
- La unión del potencial de LJ no tiene direccionalidad: el potencial es esféricamente simétrico.
- El término de sexta potencia modela efectivamente las interacciones dipolo-dipolo debido a la dispersión de electrones en gases nobles ( fuerzas de dispersión de Londres ), pero no representa bien a otros tipos de enlaces. El término de la duodécima potencia que aparece en el potencial se elige por su facilidad de cálculo para las simulaciones (al cuadrar el término de la sexta potencia) y no está basado en la teoría ni en la física.
- El potencial diverge cuando dos átomos se aproximan uno al otro. Esto puede crear inestabilidades que requieren un tratamiento especial en simulaciones de dinámica molecular.






![{\ displaystyle V _ {\ text {LJ}} = 4 \ varepsilon \ left [\ left ({\ frac {\ sigma} {r}} \ right) ^ {12} - \ left ({\ frac {\ sigma} {r}} \ derecha) ^ {6} \ derecha] = \ varepsilon \ izquierda [\ izquierda ({\ frac {r _ {\ texto {m}}} {r}} \ derecha) ^ {12} -2 \ izquierda ({\ frac {r _ {\ text {m}}} {r}} \ derecha) ^ {6} \ derecha],](https://wikimedia.org/api/rest_v1/media/math/render/svg/49ffd29e05915022c9b157985811b91c9b1b13eb)
![{\ displaystyle V _ {\ text {B}} = \ gamma \ left [e ^ {- r / r_ {1}} - \ left ({\ frac {r_ {0}} {r}} \ right) ^ { 6} \ derecha].}](https://wikimedia.org/api/rest_v1/media/math/render/svg/abd94d97c3a92878785c8e19aaa18c4b60469bf6)



![\ sigma = {\ sqrt [{6}] {\ frac {A} {B}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5c6b59b78a7e87b148cd7731a87362db88f22715)










![{\ displaystyle \ displaystyle V _ {\ text {LJ}} (r _ {\ text {c}}) = V _ {\ text {LJ}} (2.5 \ sigma) = 4 \ varepsilon \ left [\ left ({\ frac {\ sigma} {2.5 \ sigma}} \ right) ^ {12} - \ left ({\ frac {\ sigma} {2.5 \ sigma}} \ right) ^ {6} \ right] \ approx -0.0163 \ varepsilon ,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4949ebb26dad9407158eae06bd8a886f55bec6e6)


![{\ displaystyle \ displaystyle V _ {\ text {LJ}} (r) = 4 \ varepsilon \ left [\ left ({\ frac {\ sigma} {r}} \ right) ^ {12} - \ left ({\ frac {\ sigma} {r}} \ right) ^ {6} \ right].}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8c4f5ca2018e116c9672a5ce035754cb10dd657d)




















No hay comentarios:
Publicar un comentario