En enzimología , una (S) -2-hidroxiácido oxidasa ( EC 1.1.3.15 ) es una enzima que cataliza la reacción química.
- (S) -2-hidroxiácido + O 2 2-oxo ácido + H 2 O 2
Así, los dos sustratos de esta enzima son (S) -2-hidroxi ácido y O 2 , mientras que sus dos productos son ácido 2-oxo y H 2 O 2 .
Esta enzima pertenece a la familia de las oxidorreductasas , específicamente aquellas que actúan sobre el grupo de donantes CH-OH con oxígeno como aceptor. El nombre sistemático de esta clase de enzimas es (S) -2-hidroxiácido: oxígeno 2-oxidorreductasa . Otros nombres de uso común incluyen glicolato oxidasa , hidroxiácido oxidasa A , hidroxiácido oxidasa B , glicolato oxidasa , oxidasa, L-2-hidroxiácido , hidroxiácido oxidasa A , L-alfa-hidroxiácido oxidasa y L-2- hidroxiácido oxidasa . Esta enzima participa en el metabolismo de glioxilato y dicarboxilato.. Emplea un cofactor , FMN .
| (S) -2-hidroxiácido oxidasa | |
|---|---|
Tetrámero de glicolato oxidasa, humano
|
En enzimología , una 1-alquil-2-acetilglicerofosfocolina esterasa ( EC 3.1.1.47 ) es una enzima que cataliza la reacción química.
- 1-alquil-2-acetil-sn-glicero-3-fosfocolina + H 2 O 1-alquil-sn-glicero-3-fosfocolina + acetato
Así, los dos sustratos de esta enzima son 1-alquil-2-acetil-sn-glicero-3-fosfocolina y H 2 O , mientras que sus dos productos son 1-alquil-sn-glicero-3-fosfocolina y acetato .
Esta enzima pertenece a la familia de las hidrolasas , específicamente aquellas que actúan sobre enlaces de éster carboxílico . El nombre sistemático de esta clase de enzimas es 1-alquil-2-acetil-sn-glicero-3-fosfocolina acetohidrolasa . Otros nombres de uso común incluyen 1-alquil-2-acetil-sn-glicero-3-fosfocolina acetilhidrolasa y alquilacetil-GPC: acetilhidrolasa . Esta enzima participa en el metabolismo de los lípidos del éter .
En enzimología , una 1-aminociclopropano-1-carboxilato desaminasa ( EC 3.5.99.7 ) es una enzima que cataliza la reacción química.
- 1-aminociclopropano-1-carboxilato de etilo + H 2 O2-oxobutanoato + NH 3
Así, los dos sustratos de esta enzima son 1-aminociclopropano-1-carboxilato de etilo y H 2 O , mientras que sus dos productos son 2-oxobutanoato y NH 3 .
Esta enzima pertenece a la familia de las hidrolasas , las que actúan sobre enlaces carbono-nitrógeno distintos de los enlaces peptídicos, específicamente en compuestos que no se han clasificado de otra manera dentro del número EC 3.5. El nombre sistemático de esta clase de enzimas es 1-aminociclopropano-1-carboxilato aminohidrolasa (isomerizante) . Esta enzima también se llama 1-aminociclopropano-1-carboxilato de endoliasa (desaminante) . Esta enzima participa en el metabolismo del propanoato . Emplea un cofactor , el fosfato de piridoxal .
El ácido aminociclopropano-1-carboxílico sintasa (ACC sintasa, ACS) ( EC 4.4.1.14 ) es una enzima que cataliza la síntesis del ácido 1-aminociclopropano-1-carboxílico (ACC), un precursor del etileno , a partir de la metionina S-adenosilo ( AdoMet, SAM), un intermedio en el ciclo de Yang y el ciclo de metilo activado y una molécula útil para la transferencia de metilo. La ACC sintasa, como otras enzimas dependientes de PLP, cataliza la reacción a través de un intermedio de zwitterión quinonoide y usa cofactor fosfato de piridoxal (PLP, la forma activa de la vitamina B6) para la estabilización. [1] [2] [3]
En enzimología , una 1-aminociclopropano-1-carboxilato sintasa es una enzima que cataliza la reacción química.
- S-adenosil-L-metionina 1-aminociclopropano-1-carboxilato + metiltioadenosina
Por lo tanto, esta enzima tiene un sustrato , S-adenosil-L-metionina , y dos productos , 1-aminociclopropano-1-carboxilato y metiltioadenosina .
Esta enzima pertenece a la familia de las liasas , específicamente las carbonas de azufre y carbono. El nombre sistemático de esta clase de enzimas es S-adenosil-L-metionina metiltioadenosina-liasa (formadora de 1-aminociclopropano-1-carboxilato) . Otros nombres de uso común incluyen 1-aminociclopropanocarboxilato sintasa , 1-aminociclopropano-1-carboxilato sintasa , 1-aminociclopropano-1-carboxilato sintetasa , aminociclopropanocarboxilato sintasa , aminociclopropanocarboxilato sintasa , ACC sintasa y S-adenosil-L-metionos metil-metionina metil-metionos liasa . Esta enzima participa enmetabolismo del propanoato . Emplea un cofactor , el fosfato de piridoxal .

Mecanismo de enzimas [ editar ]
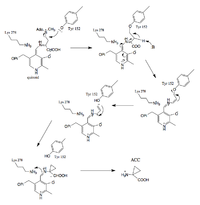
La reacción catalizada por la 1-aminociclopropano-1-ácido carboxílico sintasa (ACS) es el paso comprometido y limitante en la biosíntesis de etileno [20], una hormona gaseosa vegetal que es responsable del inicio de la maduración, brote y raíz de la fruta. crecimiento y diferenciación, abscisión de hojas y frutos , apertura de flores y senescencia de flores y hojas . (fuente) Es una eliminación gamma dependiente de fosfato de piridoxal (PLP) (?). En la eliminación gamma, PLP actúa como un sumidero dos veces (absorbiendo electrones de dos desprotonaciones). [4] [5]
Pasos propuestos del mecanismo de reacción:
- Formación de la base de Schiff ACS-PLP
- Intercambio de imina
- Formación del intermedio quinonoide
- La tirosina y PLP estabilizaron la formación del anillo 3C
- Formación de la base de Schiff ACS-PLP
El aldehído de la coenzima PLP reacciona para formar un enlace imina ( base de Schiff ) con el residuo de lisina del dominio catalítico (278) de ACS.
- Intercambio de imina
Se produce un intercambio de imina, y el nitrógeno de amina del sustrato, S-adenosil metionina, reemplaza a Lys (278) en el enlace de imina. (Estabilizado por enlace H).
- Formación del intermedio quinonoide
PLP actúa como un 'sumidero de electrones' que absorbe la densidad de electrones deslocalizados durante los intermedios de reacción (contrarrestando el exceso de densidad de electrones en el carbono a desprotonado). PLP facilita la actividad enzimática, aumentando la acidez del carbono alfa al estabilizar la base conjugada. El intermedio de carbanión estabilizado con PLP formado es el intermedio quinonoide.
- La tirosina y PLP estabilizaron la formación del anillo 3C
PLP y tirosina estabilizan las cargas negativas durante la desprotonación. La tirosina ataca el carbono unido al azufre, permitiendo que S (CH 3 ) (Ado) se vaya, y durante la formación del anillo, la tirosina se va.
Regulación [ editar ]
La ACC sintasa alcanza una actividad óptima en condiciones de pH 8.5 y con Km = 20 um en relación con su sustrato, SAM.
La sintasa ACC y la biosíntesis de etileno están reguladas por una gran cantidad de estímulos. Estrés como heridas, productos químicos nocivos, auxina, inundaciones y ácido indol-3-acético (IAA) promueven la síntesis de etileno, creando un ciclo de retroalimentación positiva con ACC sintasa, regulando su actividad.
Sin embargo, también está inhibido por varios compuestos. La S-adenosiletionina puede unirse como sustrato para ACC sintasa (con mayor afinidad que SAM) y, por lo tanto, inhibir cualquier reacción con SAM. ACC Synthase también es inhibido competitivamente por aminoetoxivinilglicina (AVG) y ácido aminooxiacético (AOA), inhibidores de muchas reacciones enzimáticas mediadas por fosfato de piridoxal. Son toxinas naturales que causan una inhibición lenta de la unión al interferir con la coenzima fosfato de piridoxal. La actividad ACC sintasa también es inhibida por los intermedios del ciclo de metilo activado y la ruta de reciclaje de metionina: ácido 5′-metiltioadenosina, ácido α-ceto-γ-metiltiobutírico y S-adenosilhomocisteína. [8] [9] [10]
Estructura [ editar ]
ACC Synthase es una secuencia larga de 450-516 aminoácidos, dependiendo de la especie de planta de la que se extrae. Aunque es comparable en las especies en las que se encuentra, su dominio terminal de COOH es más variable, lo que lleva a diferencias como la oligomerización . El dominio terminal de COOH es responsable de la oligomerización. En la mayoría de las células productoras de ACC Synthase, ACC Synthase existe como un dímero. Sin embargo, en algunos encontramos un monómero ("que es más activo y eficiente [que su contraparte de dímero"). [11]
La estructura de ACS se ha determinado en gran medida a través de cristalografía de rayos X. [12] La conservación de los residuos en el dominio catalítico de ACS y la homología de secuencia sugieren que ACS cataliza la síntesis de ACC de manera similar a otras enzimas que requieren PLP como cofactor. Sin embargo, a diferencia de muchas otras enzimas dependientes de PLP, Lys (278) no es el único residuo que interactúa con el sustrato. La proximidad del oxígeno electronegativo de Tyr (152) al enlace C-γ-S sugiere un papel crucial en la formación de ACC. [13] La cristalografía de rayos X con aminoetoxivinilglicina (AVG), un inhibidor competitivo, confirmó el papel de la tirosina en la eliminación de γ. [14]
A finales de 2007, se han resuelto 6 estructuras para esta clase de enzimas, con los códigos de acceso PDB 1B8G , 1IAX , 1IAY , 1M4N , 1M7Y y 1YNU .
Dominio catalítico [ editar ]
Los principales grupos funcionales en los dominios catalíticos son el nitrógeno del residuo Lys 278 y el oxígeno del residuo tirosina 152.
Función biológica y aplicaciones [ editar ]
ACC Synthase es el paso clave que limita la velocidad en la síntesis de etileno. Debido a que la regulación al alza de ACC-Synthase es lo que induce la maduración de la fruta y, a menudo, el deterioro, se están realizando más investigaciones sobre los mecanismos reguladores y las vías biosintéticas del etileno para evitar el deterioro.







No hay comentarios:
Publicar un comentario