En enzimología , una 4-hidroxi-2-oxoglutarato aldolasa ( EC 4.1.3.16 ) es una enzima que cataliza la reacción química.
- 4-hidroxi-2-oxoglutarato piruvato + glioxilato
Por lo tanto, esta enzima tiene un sustrato , 4-hidroxi-2-oxoglutarato , y dos productos , piruvato y glioxilato .
Esta enzima pertenece a la familia de las liasa , específicamente las oxoácido-liasa, que escinden los enlaces carbono-carbono. El nombre sistemático de esta clase de enzimas es 4-hidroxi-2-oxoglutarato glicoxilato-liasa (formadora de piruvato) . Otros nombres de uso común incluyen 2-oxo-4-hidroxiglutarato aldolasa , hidroxicetoglutarico aldolasa , 4-hidroxi-2-cetoglutarico aldolasa , 2-ceto-4-hidroxiglutarico aldolasa , 4-hidroxi-2-cetoglutarato aldolasa , 2-ceto-4 -cetoglutarato aldolasa -hidroxiglutarato aldolasa , 2-oxo-4-hidroxiglutárico aldolasa , DL-4-hidroxi-2-cetoglutarato aldolasa ,hidroxicetoglutarato aldolasa , 2-ceto-4-hidroxibutirato aldolasa y 4-hidroxi-2-oxoglutarato glicoxilato-liasa . Esta enzima participa en el metabolismo de arginina y prolina y en el metabolismo de glioxilato y dicarboxilato .
En enzimología , una 4-hidroxi-tetrahidrodipicolinato reductasa ( EC 1.17.1.8 ) es una enzima que cataliza la reacción química.
- (S) 2,3,4,5-tetrahidropiridina-2,6-dicarboxilato + NAD (P) + + H 2 O(2S, 4S) -4-hidroxi-2,3,4,5-tetrahidrodipicolinato + NAD (P) H + H +
Los 3 substratos de esta enzima son (S) 2,3,4,5-tetrahidropiridina-2,6-dicarboxilato , NAD + o NADP + , y H 2 O , mientras que sus 3 productos son (2S, 4S) -4 -hidroxi-2,3,4,5-tetrahidrodipicolinato , NADH o NADPH y H + .
Nomenclatura [ editar ]
Esta enzima pertenece a la familia de las oxidorreductasas , específicamente aquellas que actúan sobre grupos CH o CH 2 con NAD + o NADP + como aceptor. El nombre sistemático de esta clase de enzimas es (S) -2,3,4,5-tetrahidropiridin-2,6-dicarboxilato: NAD (P) + 4-oxidorreductasa. Otros nombres de uso común incluyen:
- dihidrodipicolinato reductasa,
- ácido dihidrodipicolínico reductasa, y
- 2,3,4,5-tetrahidrodipicolinato: NAD (P) + oxidorreductasa.

La enzima 4-hidroxibenzoato 3-monooxigenasa , también conocida comúnmente como para-hidroxibenzoato hidroxilasa (PHBH), es una flavoproteína que pertenece a la familia de las oxidorreductasas . Específicamente, es una hidroxilasa , y es una de las enzimas más estudiadas y cataliza las reacciones involucradas en la desintoxicación del suelo, el metabolismo y otros procesos biosintéticos. [1]
4-hidroxibenzoato 3-monooygenase cataliza la hidroxilación regioselectiva de 4-hidroxibenzoato , dando 3,4-dihidroxibenzoato como producto. El mecanismo consta de los siguientes pasos generales: (1) reducción de la flavina , (2) reacción de la flavina con O 2 , produciendo hidroperoxiflavina C4a, y (3) unión y activación del sustrato, que conduce a la formación y liberación del producto . [2] En todo el mecanismo, la flavina cambia entre conformaciones "abiertas" y "cerradas", alterando así el entorno de reacción del sustrato. La conformación abierta permite el acceso de solvente al sitio activo; la enzima adopta esta conformación para la unión del sustrato y la liberación del producto. Una conformación cerrada aísla la reacción del disolvente, lo que ayuda a estabilizar los intermedios de reacción.
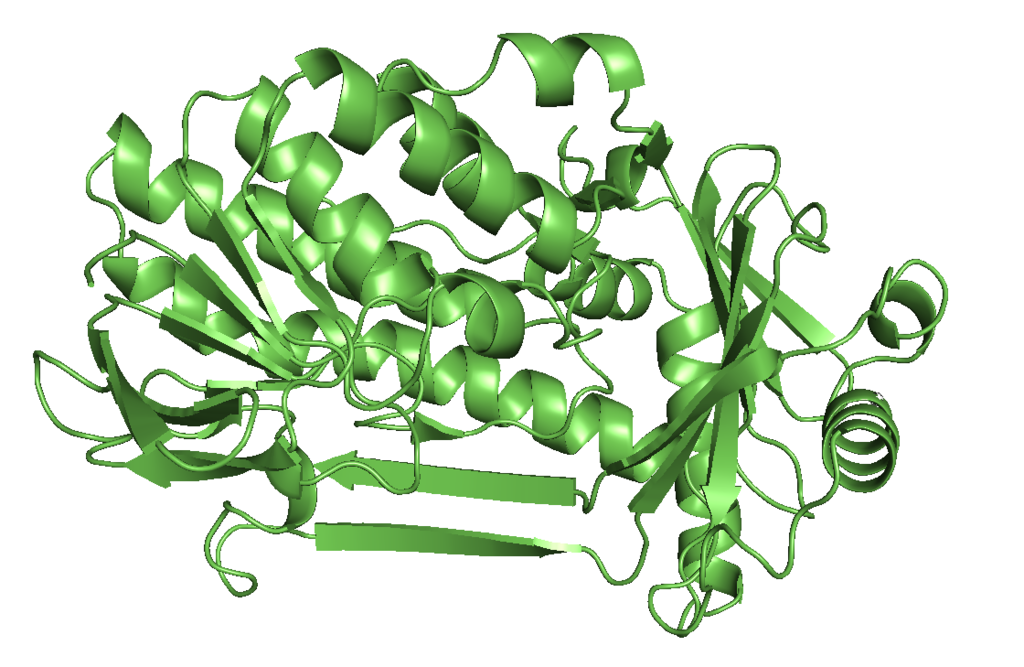
Estructura [ editar ]
El 4-hidroxibenzoato 3-monooxigenasa es un homodímero con una flavina unida a cada monómero . El sitio activo está compuesto de flavina y aminoácidos en el monómero. La estructura de esta enzima a menudo sirve como modelo para la interdependencia estructura-reactividad de otras hidroxilasas dependientes de flavina. El sitio activo limita los sustratos potenciales a bencenos sustituidos, a saber, 4-hidroxibenzoato (el sustrato nativo), 2,4-dihidroxibenzoato , 4-mercaptobenzoato y varios compuestos aromáticos halogenados. [3]
Mecanismo [ editar ]
La hidroxilasa, 4-hidroxibenzoato 3-monooxigenasa , avanza a través de un proceso catalítico que comienza con la entrada de NADPH y 4-hidroxibenzoato (el sustrato nativo ) en el sitio activo de la enzima. Esto da como resultado la formación de un complejo enzima-flavina-sustrato-NADPH, después de lo cual el cofactor de flavina, FAD , se reduce por NADPH. Se pierde NADP + y el O 2 entra en el complejo, seguido de la oxidación de la flavina para formar un hidroperóxido, que actúa como el reactivo de transferencia de hidróxido. Es importante tener en cuenta que si bien el grupo transferido se denomina hidróxido, formalmente es un OH +grupo. Este hidróxido se transfiere al sustrato desde la hidroperóxido flavina, flavina-C4a-hidroperóxido, a través de una reacción electrofílica de tipo aromático de sustitución . Finalmente, el producto sale del complejo y la hidroxiflavina se deshidrata, regenerando FAD y permitiendo que el proceso se repita. [2]
El sustrato se une en el sitio activo de la enzima a través de interacciones no covalentes con cadenas laterales de aminoácidos proximales. Específicamente, los grupos hidroxilo de tirosina 201 y 222, además del grupo hidroxilo de serina 212, interactúan con el grupo carboxilato e hidroxilo en el sustrato. Esto permite una orientación adecuada dentro del sitio activo para lograr reactividad. [2]
Una vez que el sustrato está unido, la flavina cambia de una conformación "abierta" a una "cerrada". Esto protege el sitio activo y el sustrato del solvente, evitando la descomposición prematura del hidroperóxido de flavina. La unión tanto del NADPH como del sustrato desplaza la enzima a una conformación "fuera". Esto ocurre a través de una intrincada red de protones dentro de la enzima que permite la desprotonación del fenol y un posterior cambio dinámico de la enzima. La conformación "fuera" alinea el anillo de isoalloxazina de la flavina para que NADPH pueda reducirlo rápidamente. Después de la reducción, se libera NADP + de la enzima. [4]
La reducción de la flavina genera una especie cargada negativamente, FADH - , que es atraída al sitio activo cargado positivamente. Esta atracción cambia el sabor a la conformación "cerrada", aislándolo del ambiente solvente. Este aislamiento proporciona un entorno y una posición óptimos para que el O 2 hidroxila el sustrato. [4] El oxígeno se une a FADH , a través de una sola transferencia de electrones , que es el paso limitante de la reacción. Esto forma un radical FAD e hidroperóxido de flavina. La reacción entre estos genera C4a-peroxiflavina, que se protona rápidamente para formar flavina-C4a-hidroperóxido. [3] Tautomerizaciónconduce a la formación de 3,4-dihidoxibenzoato. El paso final en el mecanismo es la disociación del producto y el agua del FAD, haciendo que la flavina regrese a la conformación abierta.


No hay comentarios:
Publicar un comentario