dinámica química es una parte de la química física que estudia las interacciones entre las partículas que conforman las diferentes sustancias que intervienen en una reacción química y también los estudios sobre transporte y difusión de las sustancias químicas en un sistema o en la naturaleza.
La dinámica química es una de las tres áreas de la química según el Informe Westheimer (1965), junto a la química estructural y la química de síntesis. Su objetivo es el análisis de los procesos químicos desde una dimensión evolutiva, es decir, se encarga del estudio de la materia en el proceso de cambio químico y las causas de dichos procesos.
Las interacciones entre átomos, moléculas e iones son la causa explicativa de muchos fenómenos estudiados por esta rama de la química, como las propiedades de los sólidos, líquidos y gases; las transiciones de fase; la geometría durante las colisiones entre partículas; el estado de transición, los mecanismos de reacción, el equilibrio químico, etc.
Wilhelm Ostwald y Jacobus Henricus van 't Hoff son algunos de los científicos que desarrollaron inicialmente esta ciencia. Este último mereció el Premio Nobel en 1901 "por el descubrimiento de las leyes de la dinámica química y de la presión osmótica en las soluciones químicas"
En esta obra sobre dinámica química (posteriormente llamada cinética química) se ocupa de las velocidades de reacción y su relación con la energía libre.
Diferentes enfoques de la dinámica química[editar]
Al tratar de responder a la pregunta ¿Cómo ocurren las reacciones?, la dinámica química adopta diferentes puntos de vista.2
Enfoque microscópico[editar]
Se encarga del estudio de los átomos y moléculas en el curso de una transformación química3 y del análisis sistemático de las reacciones y la reactividad: velocidad, energía, mecanismos de reacción y equilibrio en las transformaciones químicas.4
Se divide a su vez en tres grandes áreas de estudio: termodinámica química, cinética química y mecánica estadística.5
Algunos de los temas de estudio desde este enfoque son:
- Termodinámica de los procesos irreversibles.
- Cinética química
- Teoría del transporte y difusión.
- Procesos no lineales.
- Sistemas ideales y sistemas de partículas en interacción.
- Química de superficies.
- Métodos de cálculo de la Dinámica molecular semiclásica y de Monte Carlo.
- Mecánica estadística de sistemas en equilibrio y no-equilibrio
Enfoque macroscópico[editar]
Se ocupa del estudio del transporte y evolución de sustancias químicas en el medio ambiente, generalmente a gran escala.6
Son ejemplos típicos de este enfoque los siguientes:
- Evolución de contaminantes. Procesos físico-químicos que sufren los plaguicidas en la naturaleza; su persistencia, actividad específica y destino final.7
- Distribución e impacto de las sustancias químicas vertidas en ecosistemas acuáticos o en la atmósfera.
Enfoque teórico cuántico[editar]
Estudia el comportamiento de las partículas (átomos, moléculas, ion) durante las reacciones químicas, especialmente el análisis del estado de transición y el camino de reacción, empleando para ello métodos teóricos y experimentales.8
1. Métodos teóricos en Dinámica química:
- Métodos cuánticos y cuasiclásico de trayectorias.9
- Teorías sobre el Estado de Transición:
- Teorías convencionales: teoría canónica, teoría termodinámica y teoría microcanónica.
- Teorías variacionales: camino de reacción de mínima energía
2. Técnicas experimentales:
- Espectroscopía y Dinámica de estados altamente excitados vibracionalmente.
Hacia 1950, John C. Polanyi estudió la transición de las moléculas durante una reacción desde un estado de alta excitación hasta un estado de menos excitación. Los cambios afectaban al grado de vibración y rotación de las moléculas. Si los productos de la reacción pasaban de estados de vibración extremadamente alta a estados de vibración extremadamente baja, se producían radiaciones de alta frecuencia. En 1958 Polanyi observó pequeños cambios vibracionales con radiación de baja frecuencia, introduciendo átomos de hidrógeno en una corriente de cloro gaseoso a baja presión. La reacción generó cloruro de hidrógeno en un estado de vibración excitado a muy alta temperatura y podía ser observada por un detector de emisión de infrarrojos. Esta luz se puede utilizar para producir un láser químico. Tras años de experimentos, Polanyi midió los estados de energía de transición, tanto los de vibración como los de rotación, de las moléculas del producto.
- Excitación de sobretonos en IR.
- Fotoextracción de electrones.
- Empleo de láser químico, desarrollados en 1965 por Kasper y George Claude Pimentel tras el desarrollo teórico de John C. Polanyi.
- Espectroscopía de moléculas transitorias en matrices inertes.
3. Métodos multivariacionales para calculo teórico de estados excitados electrónicos:
- Método CASSCF
- Método CASPT2
- Técnicas de simulaciones por ordenador basadas en métodos estadísticos: método de dinámica molecular, método Monte Carlo.
Al estar involucrados trillones de partículas, los cálculos en el campo de la Dinámica molecular son muy complejos y requieren el uso de métodos aproximados, cálculos repetitivos y simulaciones por ordenador, y el empleo de orbitales simplificados como los orbitales moleculares de tipo Slater (OTS) los orbitales tipo Gaussianos (OTG).
Conceptos importantes en dinámica química[editar]
Potenciales de interacción[editar]
Proceden de la superposición entre las energías cinética y potencial de las partículas. La energía cinética tiende a dispersar las partículas formando un gas desordenado. La energía potencial eléctrica muestra las atracciones entre partículas y, por tanto, la tendencia al orden y la formación de estados condensados de la materia.
El potencial de Lennard-Jones es un ejemplo de estudio de esos potenciales.10
Los potenciales de interacción11 entre átomos y moléculas parten de las siguientes hipótesis simplificadoras:
- Si interactúan dos átomos o moléculas entre sí, supondremos que no hay distorsión en las densidades electrónicas de esas partículas.
- Las fuerzas de Coulomb entre los electrones y núcleos se calculan usando las densidades electrónicas, dejando aparte otros fenómenos que contribuyen a la energía total como los efectos del intercambio electrónico, y la energía cinética, cuyos efectos se evalúan mediante una aproximación de un gas de electrones libres.
- Para el estudio de las densidades electrónicas de cada átomo se eligen las funciones de onda de Hartree-Fock.
Dinámica de colisiones o choques[editar]
La teoría de colisiones explica cómo se acercan e interaccionan las partículas implicadas en una reacción química. Por simplicidad se escoge una reacción bimolecular con la formación del complejo activado.12
Funciones de partición[editar]
En mecánica estadística, la función de partición es una magnitud que reúne las propiedades estadísticas de un sistema en equilibrio termodinámico. Es una función de la temperatura y otros parámetros, como el volumende un gas. La mayoría de las variables termodinámicas agregadas del sistema tales como la energía total, energía libre de Gibbs, entropía, y presión, pueden expresarse en términos de la función de partición o de sus derivadas.
Hay realmente varios tipos de funciones devpartición. La función de partición canónica se aplica a un conjunto canónico para el que suponemos que está en contactotérmicocon elexterior, tiene una temperatura T y posee a la vez un volumen y un número de partículas fijos. Si llamamos s (s = 1, 2, 3, ...) a los estados (microestados o estados cuánticos discretos) que elsistema puede ocupar y llamamos Es la energía total del sistema cuando está en ese microestado.
La función de partición es
donde definimos la "temperatura inversa" β como
siendo kB la constante de Boltzmann.
La función de partición está relacionada con las propiedades termodinámicas y tiene un significado estadístico importante.
Teoría del estado de transición[editar]
Tras el desarrollo del concepto de superficies de energía potencial, varios teóricos como Evans, Polanyi y Eyringdesarrollaron teorías cuantitativas de las velocidades de reacción basadas en la idea de que la formación del estado de transición controla la velocidad de la reacción. La especie química que existe en la región del estado de transición de la coordenada de reacción se llamó “complejo activado”, por lo que esta teoría se conoce también como la teoría del complejo activado.
Se basa en tres postulados:
- El sistema reaccionante al pasar del estado inicial al final, debe atravesar una región llamada estado de transición, cuya energía potencial corresponde a la energía más alta en la trayectoria de reacción.
- La especie química en el estado de transición se encuentra en equilibrio con los reactivos.
- La velocidad de reacción es igual al producto de las concentración de la especie del estado de transición y la frecuencia con que esta especie pasa a productos.
Reacciones unimoleculares[editar]
Los estudios experimentales de las reacciones unimoleculares han cambiado progresivamente. Los primeros trabajos usaban sistemas térmicos para excitar las moléculas. Después se introdujo la técnica de activación química que permite formar especies altamente excitadas que posteriormente puede isomerizar, descomponerse o bien perder energía mediante colisiones. Más tarde se desarrollaron métodos para preparar moléculas con energías concretas o en estados definidos, y fue posible la medida de las velocidades de reacción para tiempos cortos. Hoy en día, lae xcitación mediante láseres permite situar moléculas por encima de sus límites de disociación y seguir la reacción en tiempos de hasta 10-12segundos.
Los modernos métodos computacionales permiten conocer la geometría, energía y frecuencias de vibración de la molécula en función de la coordenada de reacción, lo que permite calcular las velocidades de reacción mediante modelos teóricos.13
Transiciones adiabáticas y no-adiabáticas[editar]
La dinámica adiabática considera que las interacciones entre átomos se pueden representar por una superficie de energía potencial. Esta es la aproximación de Born-Oppenheimer introducida por Born y Oppenheimer en 1927. Las primeras aplicaciones de este método fueron realizadas por Rice e Ramsperger en 1927 e Kassel
La teoría RRKM (1952) de Marcus fue desarrollada a partir de la teoría de transición de estado de Eyring en 1935. Estos métodos permiten calcular estimaciones de la velocidad de reacción a partir de características de la superficie de potencial.
La dinámica no adiabática considera las interacciones entre diversas superficies de energía potencial acopladas, correspondientes a diferentes estados cuánticos electrónicos de la molécula. Stueckelberg
(1932), Landau (1932) e Zener (1933) realizaron estudios que culminaron con la transición de Landau-Zener y permiten calcular la probabilidad de transición de las dos curvas cuando no se cumple la aproximación de Born-Oppenheimer.
Procesos dinámicos en superficies[editar]
Algunos fenómenos dinámicos muy relevantes ocurren en la superficie de los sólidos (catálisis, adsorción...), por lo que resulta de interés un análisis de los procesos de interacción superficie-medio externo y conocer los fundamentos físicos que explican los procesos de transporte cuántico de carga y de espín en nanoestructuras.
La física de superficies ha tenido un gran desarrollo gracias a las nuevas técnicas experimentales como las técnicas ópticas no lineales que han mostrado una gran sensibilidad a las condiciones estructurales de la superficie así como a los procesos que allí ocurren.
La microscopía de electrones (reflejados o fotoemitidos) es un ejemplo de técnica capaz de estudiar las superficies a escala nanométrica y determinar procesos dinámicos en superficies, como las transiciones de fase, los procesos de crecimiento o el estudio de la imanación.
Reacciones químicas en disolución. El efecto del disolvente[editar]
Las reacciones de isomerización y descomposición son unimoleculares y han sido estudiadas mediante técnicas de simulación por ordenador para comprender la influencia dinámica del disolvente sobre importantes fenómenos como la transferencia intermolecular de energía o la reactividad.
Algunas técnicas experimentales para el estudio dinámico de las reacciones en disolución son: técnicas de flujo, métodos de relajación, métodos con iniciación mediante radiaciones intensas y espectroscopias de resonancia.
Teoría de Kramers[editar]
Esta teoría fue enunciada por el físico holandés Hendrik Anthony Kramers en 1940 pero no se aceptó hasta 1980 por la ausencia de comprobación experimental con los medios de la época. Permite explicar algunos aspectos de las reacciones químicas en fase condensada como por ejemplo, las velocidades de las reacciones en disolución a partir de la difusión browniana en un campo de fuerzas, lo que supone que el movimiento aleatorio molecular es a la vez promotor e impedimento del movimiento.
Esta teoría describe el coeficiente de difusión mutua como una función del parámetro de movilidad de cadena, la masa molecular y la concentración. La teoría está basada en un proceso de difusión contra una barrera de potencial.
Distingue dos regímenes:
- Baja viscosidad: La constante de velocidad k crece con la viscosidad debido a los choques con el medio.
- Alta viscosidad: La constante k decrece con la velocidad.14
Modelos de reacciones de transferencia de electrones en disolución[editar]
Henry Taube clasificó los mecanismos de las reacciones redox en mecanismos de esfera interna (o de transferencia de átomos) y mecanismos de esfera externa (o de transferencia electrónica simple). La teoría para este último tipo de reacciones está bien establecida y se puede llegar a calcular las constantes de velocidad en algunos casos. Esta teoría está basada en el principio de Franck-Condon y en el hecho de que las transferencias de electrones entre átomos con niveles de energía acoplados son más fáciles (fenómeno cuántico de tunnelling, consecuencia del principio de incertidumbre de Heisenberg).15
La ecuación de Marcus proporciona la energía libre de Gibbs de activación para una reacción de transferencia de electrones en especies en disolución. Es la expresión cuantitativa de la teoría de Marcus, desarrollada por Rudolph Arthur Marcus, que permite a los científicos predecir el patrón y la velocidad de dichas reacciones.
- 1. Las moléculas D (donante) y A (aceptora) difunden a través de la disolución y forman un complejo precursor DA.
- 2. Transferencia de electrones en el complejo DA (de la molécula donante D a la molécula aceptora A) para formar el complejo D+A-
- 3. El complejo D+A- se rompe y las moléculas resultantes difunden
- La catálisis es el proceso por el cual se aumenta la velocidad de una reacción química, debido a la participación de una sustancia llamada catalizador y aquellas que desactivan la catálisis son denominados inhibidores. Una característica importante es que la masa de catalizador no se modifica durante la reacción química, lo que lo diferencia de un reactivo, cuya masa va disminuyendo a lo largo de la reacción.En la síntesis de muchos de los productos químicos industriales más importantes existe una catálisis, ya que esta puede disminuir el tiempo que requiere. El envenenamiento de los catalizadores, que generalmente es un proceso no deseado, también es utilizado en la industria química. Por ejemplo, en la reducción del etino a eteno, el catalizador paladio (Pd) es "envenenado" parcialmente con acetato de plomo (II), Pb(CH3COO)2. Sin la desactivación del catalizador, el eteno producido se reduciría posteriormente a etano.
Generalidades[editar]
La catálisis interviene en muchos procesos industriales. Así mismo, la mayoría de los procesos “biológicamente” significativos son catalizados. La investigación en catálisis es uno de los principales campos en ciencia aplicadae involucra muchas áreas de la química, especialmente en química organometálica y ciencia de materiales. La catálisis es importante para muchos aspectos de las ciencias ambientales, por ejemplo, el convertidor catalíticode los automóviles y la dinámica del agujero de ozono. Las reacciones catalíticas son las preferidas en la química verde para un medioambiente amigable debido a la reducida cantidad de residuos que genera3 en lugar de las reacciones estequiométricas en las que se consumen todos los reactivos y se forman más productos secundarios. El catalizador más común es el protón (H+). Muchos metales de transición y los complejos de los metales de transición se utilizan en la catálisis. Los catalizadores llamados enzimas son importantes en Biología.El catalizador funciona proporcionando un camino de reacción alternativo al producto de reacción. La velocidad de la reacción aumenta a medida que esta ruta alternativa tiene una menor energía de activación que la ruta de reacción no mediada por el catalizador. La dismutación del peróxido de hidrógeno para dar agua y oxígeno es una reacción que está fuertemente afectada por los catalizadores:- 2 H2O2 → 2 H2O + O2
Esta reacción está favorecida, en el sentido de que los productos de reacción son más estables que el material de partida, sin embargo, la reacción no catalizada es lenta. La descomposición del peróxido de hidrógeno es de hecho tan lenta que las soluciones de peróxido de hidrógeno están disponibles comercialmente. Tras la adición de una pequeña cantidad de dióxido de manganeso, el peróxido de hidrógeno reacciona rápidamente de acuerdo a la ecuación anterior. Este efecto se ve fácilmente por la efervescencia del oxígeno.4 El dióxido de manganeso puede ser recuperado sin cambios, y volver a utilizarse de forma indefinida, y por lo tanto no se consume en la reacción. En consecuencia, el dióxido de manganeso cataliza esta reacción.5Características[editar]
La característica general de la catálisis es que la reacción catalítica tiene un menor cambio de energía libre de la etapa limitante hasta el estado de transición que la reacción no catalizada correspondiente, resultando en una mayor velocidad de reacción a la misma temperatura. Sin embargo, el origen mecánico de la catálisis es complejo.Los catalizadores pueden afectar favorablemente al entorno de reacción, por ejemplo, los catalizadores ácidospara las reacciones de los compuestos carbonílicos forman compuestos intermedios específicos que no se producen naturalmente, tales como los ésteres de Osmio en la dihidroxilación de alquenos catalizadas por el tetróxido de osmio, o hacer la ruptura de los reactivos a formas reactivas, como el hidrógeno atómico en la hidrogenación catalítica.Cinéticamente, las reacciones catalíticas se comportan como las reacciones químicas típicas, es decir, la velocidad de reacción depende de la frecuencia de contacto de los reactivos en la etapa determinante de velocidad (ver ecuación de Arrhenius). Normalmente, el catalizador participa en esta etapa lenta, y las velocidades están limitadas por la cantidad de catalizador. En catálisis heterogénea, la difusión de los reactivos a la superficie de contacto y la difusión de los productos desde dicha superficie puede ser la etapa determinante de la velocidad. Eventos similares relacionados con la unión del sustrato y la disociación del producto se aplican en la catálisis homogénea.Aunque los catalizadores no son consumidos por la propia reacción, pueden resultar inhibidos, desactivados o destruidos por procesos secundarios. En la catálisis heterogénea, procesos secundarios típicos incluyen el coqueo, donde el catalizador se cubre por productos secundarios poliméricos. Además, los catalizadores heterogéneos pueden disolverse en la solución en un sistema sólido-líquido o evaporarse en un sistema sólido-gas.Principios generales de la catálisis[editar]
Mecanismo típico[editar]
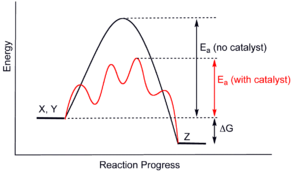
Los catalizadores generalmente reaccionan con uno o más de los reactivos para formar productos intermedios que, posteriormente, conducen al producto final de reacción. En el proceso se regenera el catalizador. El siguiente esquema es típico de una reacción catalítica, donde C representa el catalizador, X e Y son los reactivos, y Z es el producto de la reacción de X con Y:- X + C → XC (1)
- Y + XC → XYC (2)
- XYC → CZ (3)
- CZ → C + Z (4)
Aunque el catalizador es consumido por la reacción 1, posteriormente es producido por la reacción 4, por lo que la reacción global es:- X + Y → Z
Como el catalizador se regenera en una reacción, a menudo bastan pequeñas cantidades del catalizador para incrementar la velocidad de una reacción. Sin embargo, en la práctica los catalizadores son algunas veces consumidos en procesos secundarios.Como ejemplo de este proceso, en 2008, investigadores daneses revelaron por primera vez la secuencia de sucesos cuando el oxígeno y el hidrógeno se combinan en la superficie del dióxido de titanio (TiO2, o titania) para producir agua. Con una serie de imágenes de microscopía de efecto túnel a intervalos, determinaron que las moléculas sufren adsorción, disociación y difusión antes de reaccionar. Los estados intermedios de reacción fueron: HO2, H2O2, luego H3O2 y el producto final de la reacción (dímeros de la molécula de agua), tras lo cual la molécula de agua se desorbe de la superficie del catalizador.6Catálisis y energética de la reacción[editar]
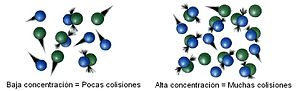
Los catalizadores funcionan proporcionando un mecanismo (alternativo) que involucra un estado de transición diferente y una menor energía de activación. Por lo tanto, más colisiones moleculares tienen la energía necesaria para alcanzar el estado de transición. En consecuencia, los catalizadores permiten reacciones que de otro modo estarían bloqueadas o ralentizadas por una barrera cinética. El catalizador puede aumentar la velocidad de reacción o de la selectividad, o permitir que la reacción ocurra a menores temperaturas. Este efecto puede ser ilustrado con una distribución de Boltzmanny un diagrama de perfil de energía.Los catalizadores no cambian el rendimiento de una reacción: no tienen efecto en el equilibrio químico de una reacción, debido a que la velocidad, tanto de la reacción directa como de la inversa, se ven afectadas (ver también termodinámica). El hecho de que un catalizador no cambie el equilibrio es una consecuencia de la segunda ley de la termodinámica. Supongamos que hay un catalizador que modifica el equilibrio. La introducción del catalizador en el sistema daría lugar a la reacción para ir de nuevo al equilibrio, produciendo energía. La producción de energía es un resultado necesario, puesto que las reacciones son espontáneas sí y sólo sí se produce energía libre de Gibbs, y si no hay una barrera energética no hay necesidad de un catalizador. En consecuencia, la eliminación del catalizador también resultaría en una reacción, produciendo energía; esto es, tanto la adición, como su proceso inverso, la eliminación, producirían energía. Así, un catalizador que pudiera cambiar el equilibrio sería un móvil perpetuo, en contradicción con las leyes de la termodinámica.7Si un catalizador cambia el equilibrio, entonces debe consumirse a medida que avanza la reacción, y por lo tanto también es un reactivo. Algunos ejemplos ilustrativos son la hidrólisis de los ésteres catalizada por bases, donde el ácido carboxílico producido reacciona inmediatamente con el catalizador básico, y así el equilibrio de la reacción se desplaza hacia la hidrólisis.La unidad derivada SI para medir la actividad catalítica de un catalizador es el katal, que es igual a moles por segundo. La actividad de un catalizador puede ser descrita por el número de conversiones, o TON (del inglés turn over number), y la eficiencia catalítica por la frecuencia de conversiones, TOF (del inglés turn over frequency). El equivalente bioquímico es la unidad de actividad enzimática. Para más información sobre la eficiencia de la catálisis enzimática, ver el artículo de Catálisis enzimática.El catalizador estabiliza el estado de transición más que de los que estabiliza el material inicial. Disminuye la barrera cinética al disminuir la diferencia de energía entre el material inicial y el estado de transición.Materiales catalíticos típicos[editar]
La naturaleza química de los catalizadores es tan diversa como la catálisis misma, aunque pueden hacerse algunas generalizaciones. Los ácidos próticos son probablemente los catalizadores más ampliamente usados, especialmente para muchas reacciones que involucran agua, incluyendo la hidrólisis y su inversa. Los sólidos multifuncionales a menudo suelen ser catalíticamente activos, por ejemplo las zeolitas, la alúmina y ciertas formas de carbono grafítico. Los metales de transición son utilizados a menudo para catalizar reacciones redox(oxigenación, hidrogenación). Muchos procesos catalíticos, especialmente los que involucran hidrógeno, requieren metales del grupo del platino.Algunos de los llamados catalizadores son, en realidad, precatalizadores. Los precatalizadores se convierten en el catalizador en el transcurso de la reacción. Por ejemplo, el catalizador de Wilkinson RhCl(PPh3)3 pierde un ligando trifenilfosfina antes de entrar en el verdadero ciclo catalítico. Los precatalizadores son más fáciles de almacenar, pero son fácilmente activados in situ. Debido a esta etapa de preactivación, muchas reacciones catalíticas involucran un período de inducción.Las especies químicas que mejoran la actividad catalítica son denominadas co-catalizadores o promotores, en la catálisis cooperativa.Tipos de catálisis[editar]
Los catalizadores pueden ser homogéneos o heterogéneos, dependiendo de si existe un catalizador en la misma fase que el sustrato. Los biocatalizadores son vistos a menudo como un grupo separado. === Catalizadores enigmáticos Son aquellos que realizan procesos mediante enzimas, estos son más empleados en las áreas industriales, una de ellas es la farmacéutica, en la cual un ejemplo es para la producción de insulina, la cual se obtiene al emplear la enzima de la bacteria E. coli.Catalizadores heterogéneos[editar]
Los catalizadores heterogéneos son aquellos que actúan en una fase diferente que los reactivos. La mayoría de los catalizadores heterogéneos son sólidos que actúan sobre sustratos en una mezcla de reacción líquida o gaseosa. Se conocen diversos mecanismos para las reacciones en superficies, dependiendo de cómo se lleva a cabo la adsorción (Langmuir-Hinshelwood, Eley -Rideal, y Mars-van Krevelen).8 El área superficial total del sólido tiene un efecto importante en la velocidad de reacción. Cuanto menor sea el tamaño de partícula del catalizador, mayor es el área superficial para una masa dada de partículas.Por ejemplo, en el proceso de Haber, el hierro finamente dividido sirve como un catalizador para la síntesis de amoníaco a partir de nitrógeno e hidrógeno. Los gases reactantes se adsorben en los "sitios activos" de las partículas de hierro. Una vez adsorbidos, los enlaces dentro de las moléculas reaccionantes se resienten, y se forman nuevos enlaces entre los fragmentos generados, en parte debido a su proximidad. De esta manera el particularmente fuerte triple enlace en el nitrógeno se debilita y los átomos de hidrógeno y nitrógeno se combinan más rápido de lo que lo harían el caso en la fase gaseosa, por lo que la velocidad de reacción aumenta.Los catalizadores heterogéneos suelen estar "soportados", que significa que el catalizador se encuentra disperso en un segundo material que mejora la eficacia o minimiza su costo. A veces el soporte es más que una superficie sobre la que se transmite el catalizador para aumentar el área superficial. Más a menudo, el soporte y el catalizador interactúan, afectando a la reacción catalítica.Catalizadores homogéneos[editar]
Normalmente los catalizadores homogéneos están disueltos en un disolvente con los sustratos. Un ejemplo de catálisis homogénea implica la influencia de H+ en la esterificación de los ésteres, por ejemplo, acetato de metilo a partir del ácido acético y el metanol.9 Para los químicos inorgánicos, la catálisis homogénea es a menudo sinónimo de catalizadores organometálicos.10Electrocatalizadores[editar]
En el contexto de la electroquímica, específicamente en la ingeniería de las pilas de combustible, que contienen varios metales los catalizadores se utilizan para mejorar las velocidades de las semirreacciones que conforman la pila de combustible. Un tipo común de electrocatalizador de pila de combustible se basa en nanopartículas de platino que están soportadas en partículas un poco mayores de carbón. Cuando este electrocatalizador de platino está en contacto con uno de los electrodos en una pila de combustible, aumenta la velocidad de reducción del oxígeno a agua (o hidróxido o peróxido de hidrógeno).Organocatálisis[editar]
Mientras que los metales de transición a veces atraen más la atención en el estudio de la catálisis, las moléculas orgánicas que no contengan metales también pueden poseer propiedades catalíticas. Normalmente, los catalizadores orgánicos requieren una mayor carga (o cantidad de catalizador por unidad de cantidad de reactivo) que los catalizadores basados en metales de transición, pero estos catalizadores suelen estar disponibles comercialmente en grandes cantidades, ayudando a reducir los costos. A principios de los 2000, los organocatalizadores fueron considerados una "nueva generación" y eran competidores de los tradicionales catalizadores que contenían metales. Las reacciones enzimáticas operan a través de los principios de la catálisis orgánica.Nanocatálisis[editar]
El principio de la nanocatálisis se basa en la premisa de que los materiales catalíticos aplicados en la nanoescala tienen mejores propiedades, en comparación con lo que exhiben en una macroescala.Véase también: NanomaterialImportancia de la catálisis[editar]
Se estima que el 90% de todos los productos químicos producidos comercialmente involucran catalizadores en alguna etapa del proceso de su fabricación.11 En 2005, los procesos catalíticos generaron cerca de 900.000 millones de dólares en productos de todo el mundo.12 La catálisis es tan penetrante que las subáreas no son fácilmente clasificables. Algunas áreas de particular concentración se estudian más adelante.Procesamiento de energía[editar]
El refinado de petróleo hace un uso intensivo de la catálisis para la alquilación, craqueo catalítico (rotura de hidrocarburos de cadena larga en trozos más pequeños), reformado de nafta y el reformado con vapor(conversión de hidrocarburos en gas de síntesis). Incluso los gases de combustión de la quema de combustibles fósiles es tratada a través de la catálisis: convertidores catalíticos, normalmente compuestos de platino y rodio, rompen algunos de los subproductos más nocivos de los gases de escape de los automóviles.- 2 CO + 2 NO → 2 CO2 + N2
Con respecto a los combustibles sintéticos, un viejo pero importante proceso es el síntesis de Fischer-Tropsch de hidrocarburos a partir del gas de síntesis, que a su vez se procesa a través de la reacción de cambio agua-gas, catalizada por el hierro. El Biodiésel y los biocombustibles relacionados requieren un procesamiento tanto a través de los catalizadores inorgánicos como de los biocatalizadores.Las pilas de combustible se basan en catalizadores de las reacciones tanto anódicas como catódicas.Productos químicos a granel[editar]
Algunos de los productos químicos obtenidos a gran escala se producen a través de la oxidación catalítica, a menudo usando oxígeno. Algunos ejemplos son el ácido nítrico (a partir de amoníaco), el ácido sulfúrico (a partir de dióxido de azufre a trióxido de azufre por el proceso de las cámaras de plomo), el ácido tereftálico a partir de p-xileno, y el acrilonitrilo a partir de propano y amoníaco.Muchos otros productos químicos son generados por reducción a gran escala, a menudo a través de hidrogenación. El ejemplo a mayor escala es el amoníaco, que se prepara a través del proceso de Haber a partir de nitrógeno. El Metanol es preparado a partir de monóxido de carbono.Los polímeros a granel derivados de etileno y propileno se preparan a menudo a través de la catálisis Ziegler-Natta. Los poliésteres, las poliamidas, y los isocianatos se obtienen a través de la catálisis ácido-base.La mayoría de los procesos de carbonilación requieren catalizadores metálicos, los ejemplos incluyen la síntesis de ácido acético mediante el proceso Monsanto y la hidroformilación.Química fina[editar]
Muchos productos de química fina se preparan a través de la catálisis, los métodos incluyen a los de la industria pesada, así como procesos más especializados que serían prohibitivamente caros a gran escala. Algunos ejemplos son la metátesis de olefinas usando el catalizador de Grubbs, la reacción de Heck, y la reacción de Friedel-Crafts.Debido a que la mayoría de los compuestos bioactivos son quirales, muchos productos farmacéuticos son producidos por catálisis enantioselectiva.Procesamiento de alimentos[editar]
Una de las aplicaciones más obvias de la catálisis es la hidrogenación (reacción con el hidrógeno gas) de las grasas usando níquel como catalizador para producir la margarina.13 Muchos otros productos alimenticios se preparan a través de biocatálisis (véase más abajo).Biología[editar]
En la naturaleza, las enzimas son catalizadores en el metabolismo y el catabolismo. La mayoría de biocatalizadores están basados en proteínas, es decir, enzimas, pero otras clases de biomoléculas también exhiben propiedades catalíticas incluyendo las ribozimas, y de desoxirribozimas sintéticas.14Los biocatalizadores se pueden considerar como intermedio entre los catalizadores homogéneos y los heterogéneos, aunque estrictamente hablando las enzimas solubles son catalizadores homogéneos y las enzimas enlazadas a membrana son heterogéneas. Varios factores afectan la actividad de las enzimas (y otros catalizadores), incluyendo la temperatura, el pH, la concentración de la enzima, el sustrato y los productos. Un reactivo particularmente importante en las reacciones enzimáticas es el agua, que es el producto de muchas de las reacciones en que se forman enlaces y un reactivo en muchos procesos en que se rompen enlaces.Las enzimas se emplean para preparar los productos químicos básicos, incluyendo el jarabe de maíz y la acrilamida.En el medio ambiente[editar]
La catálisis tiene un impacto en el medio ambiente mediante el aumento de la eficiencia de los procesos industriales, pero la catálisis también juega un papel directo en el medio ambiente. Un ejemplo notable es el papel catalítico de los radicales libres en la destrucción del ozono. Estos radicales se forman por la acción de la radiación ultravioleta sobre los clorofluorocarburos (CFC)- Cl· + O3 → ClO· + O2
- ClO· + O· → Cl· + O2
Historia[editar]
En un sentido general, cualquier cosa que aumenta la velocidad de un proceso es un "catalizador", un término derivado del griego, que significa "anular", "desatar", o "recoger". La frase procesos catalizados fue acuñada por Jöns Jakob Berzelius en 183615 para describir las reacciones que son aceleradas por sustancias que permanecen sin cambios después de la reacción. Otro de los primeros químicos involucrados en la catálisis fue Alexander Mitscherlich quien se refirió a los procesos de contacto y Johann Wolfgang Döbereiner que habló de acción de contacto y cuyo encendedor basado en hidrógeno y una esponja de platino se convirtieron en un gran éxito comercial en la década de 1820. Humphry Davy descubrió el uso de platino en la catálisis. En la década de 1880, Wilhelm Ostwald en la Universidad de Leipzig inició una investigación sistemática de las reacciones que eran catalizadas por la presencia de los ácidos y las bases, y encontró que las reacciones químicas ocurren a una velocidad finita y que estas velocidades pueden utilizarse para determinar la fuerza de ácidos y bases. Por este trabajo, Ostwald fue galardonado en 1909 con el Premio Nobel de Química.16Inhibidores, venenos y promotores[editar]
Las sustancias que reducen la acción de los catalizadores son llamadas inhibidores catalíticos si son reversibles, y venenos catalíticos si son irreversibles. Los promotores son sustancias que aumentan la actividad catalítica, en particular cuando no son catalizadores en sí mismos.El inhibidor puede modificar la selectividad además de la velocidad. Por ejemplo, en la reducción del etino a eteno, el catalizador es paladio (Pd), parcialmente "envenenado" con acetato de plomo (II) (Pb(CH3COO)2). Sin la desactivación del catalizador, el etileno producido se reducirá aún más, hasta etano.12El inhibidor puede producir este efecto por ejemplo, envenenando selectivamente sólo a ciertos tipos de sitios activos. Otro mecanismo es la modificación de la geometría de la superficie. Por ejemplo, en las operaciones de hidrogenación, grandes planchas de superficie metálica funcionan como lugares de catálisis hidrogenolíticamientras que los sitios que catalizan la hidrogenación de los insaturados son menores. Así, un veneno que cubre la superficie al azar tienden a reducir el número de grandes planchas no contaminada, pero dejan proporcionalmente más sitios pequeños libres, así se cambia la hidrogenación frente a la hidrogenolisis selectiva. También son posibles otros muchos mecanismos.17Diagramas de energía[editar]
La figura muestra el diagrama de una reacción catalizada, mostrando como varía la energía (E) de las moléculas que participan en la reacción durante el proceso de reacción (tiempo, t). Todas las moléculas contienen una cantidad determinada de energía, que depende del número y del tipo de enlaces presentes en ella. Los sustratos o reactivos (A y B) tienen una energía determinada, y el o los productos (AB en el gráfico), otra.Si la energía total de los sustratos es mayor que la de los productos (por ejemplo como se muestra en el diagrama), una reacción exotérmica, y el exceso de energía se desprende en forma de calor. Por el contrario, si la energía total de los sustratos es menor que la de los productos, se necesita tomar energía del exterior para que la reacción tenga lugar, lo que se denomina reacción endotérmica.Cuando las moléculas de los sustratos se van acercando para reaccionar, pierden estabilidad (usando una analogía antropomórfica, a las moléculas "les gusta" mantener su espacio vital, y las intromisiones no son bienvenidas). La inestabilidad se manifiesta como un aumento de la energía del sistema (es el pico de energía que se ve en el diagrama). Cuando los sustratos se convierten en productos, las moléculas se separan y se relajan de nuevo, y el conjunto se estabiliza.Las enzimas catalizan las reacciones estabilizando el intermedio de la reacción, de manera que el "pico" de energía necesario para pasar de los sustratos a los productos es menor. El resultado final es que hay muchas más moléculas de sustrato que chocan y reaccionan para dar lugar a los productos, y la reacción transcurre en general más deprisa. Un catalizador puede catalizar tanto reacciones endotérmicas como exotérmicas, porque en los dos casos es necesario superar una barrera energética. El catalizador (E) crea un microambiente en el que A y B pueden alcanzar el estado intermedio (A...E...B) más fácilmente, reduciendo la cantidad de energía necesaria (E2). Como resultado, la reacción es más fácil, optimizando la velocidad de dicha reacción.Los catalizadores no alteran el equilibrio químico propio de la reacción en ningún caso.











No hay comentarios:
Publicar un comentario