Un mecanismo de reacción es un postulado teórico que intenta explicar de manera lógica cuáles son las reacción(es) elemental(es) e intermediarios que suceden en una reacción química y que permiten explicar las características cualitativas (desarrollo de color, aparición de precipitados, etc.) y cuantitativas (una de las más importantes la velocidad de reacción) observadas en su desarrollo. El mecanismo debe soportarse en los datos experimentales reportados para la reacción estudiada como los intermediarios, complejo(s) activado(s) y/o especies aislados en el trabajo experimental; la energía involucrada en cada paso propuesto (que determina la velocidad de reacción), cambios de fase, los efectos inducidos por el catalizador (sí es que se adiciona alguno), los productos obtenidos, el rendimiento de la reacción, la estereoquímica de los productos, etc.
Las reacciones elementales pueden estudiarse a partir del cambio de la energía potencial en las moléculas involucradas mientras se aproximan entre sí, el primer estudio de este tipo fue realizado por Henry Eyring y fue la base para el desarrollo de la dinámica química. Basados en cálculos de física cuántica Eyring realizó una superficie donde se representa el cambio de coordenadas internas (distancia de aproximación entre los átomos de las moléculas) vs energía potencial. Todas las posibles configuraciones que puedan llegar a ocurrir en el sistema se encuentran allí, la disociación de las moléculas en átomos el "rompimiento" y la "formación" de nuevos enlaces y la formación de cualquier tipo de Intermediario o especie química. Existen dos zonas especialmente importantes que permiten caracterizar la velocidad de las reacción(es) elemental(es) una es conocida como valle de potencial y es donde se encuentran las especies estables y otra como punto de silla donde encontramos el estado de transición. Una reacción química es entonces un proceso donde las moléculas pasan desde un valle de potencial a otro, por intermedio de un estado de transición y continuará hasta que se formen los productos observados y/o la entropía del sistema sea la máxima que pueda obtenerse en las condiciones que se realiza. Los mecanismos de reacción son postulados teóricos sobre la superficie de energía potencial y la ruta que sigue una reacción química, y pueden "demostrarse" basados en las características cuantitativas y cualitativas observadas experimentalmente, generalmente la más importante de todas es la velocidad de reacción.
Conceptos básicos[editar]
Desde un punto de vista termodinámico, una ecuación química, los reactivos que son el estado inicial y los productos el estado final, hay una variación de energía libre. La energía libre debe ser negativa ya que será una reacción espontánea, es decir, que la reacción podrá llevarse a cabo sin ningún impedimento termodinámico.
Para hacer más fácil la explicación será mejor hacerla con un ejemplo:
Para hacer el enlace A-B, los reactivos se tienen que cortar las distancias, pero esto aumenta la fuerza de repulsión de los electrones. Para evitar esta repulsión, los reactivos tendrán que acercarse con suficiente energía cinética. Por encima de esta energía, las moléculas A y B forman enlaces y a la vez, las moléculas B y C están rompiendo el suyo. En este momento hay un complejo formado por A, B y C, llamado complejo activado. Al final todos los enlaces del B y C serán rotos y los enlaces A y B serán formados, es decir, los productos.
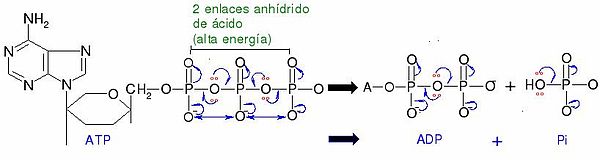
También hay que hacer mención de la energía de activación , que es la diferencia entre la energía de los reactivos y la del complejo activado. Se puede considerar como una barrera energética por la que deben pasar los reactivos para pasar a ser productos.
Tipos[editar]
Reacciones elementales o concertadas[editar]
La Ley de velocidad permite caracterizar un mecanismo de reacción en Una reacción elemental transcurre en solo una etapa. Esta reacción se produce con una formación de un solo complejo activado y solo tiene que superar una barrera energética. Se representa en una sola ecuación química.
Existen 3 tipos de reacciones elementales, los cuales son:
- Combinación: A+B → AB
- Descomposición: AB → A+B
- Desplazamiento: AB+C → AC+B
Reacciones complejas[editar]
Una reacción compleja transcurre en 2 o más etapas, con formación de intermediarios. También podemos decir que es un conjunto de reacciones elementales, donde hay más de una formación de complejos activados diferentes y supera diferentes barreras energéticas. Se expresa en varias ecuaciones químicas o en una global. En la ecuación química global, se representa el estado inicial y el estado final del global de las reacciones, pero no presenta como ha transcurrido la reacción.
Los intermediarios son moléculas que aparecen en el mecanismo de la reacción, pero no en la ecuación inicial.
Molecularidad[editar]
La molecularidad es un concepto bastante útil para poder determinar cómo es el estado de transición y cuanta energía se necesita para llegar a él. Dado que las velocidades de reacción en una primera aproximación dependen únicamente del paso lento, se define como el numero de moléculas involucradas en el estado de transición de la reacción elemental más lenta:
- Unimoleculares: Solo participa una molécula.
- Bimoleculares: Participan 2 moléculas.
- Trimoleculares: Participan 3 moléculas
La molecularidad puede obtenerse experimentalmente como el orden de reacción en la ley de velocidad. En ocasiones existen ordenes de reacción fraccionarios, porque el reactivo adicionado no reacciona directamente sino lo hace un intermediario que está en equilibrio con este o si existe más de un reacción elemental "lenta" (en estos casos los ordenes de reacción no pueden interpretarse como la molecularidad). Teniendo en cuenta que las moléculas de una sustancia se encuentran en una distribución de Boltzmann es muy improbable estadisticamente que choquen cuatro moléculas al mismo tiempo por eso no existen reacciones tetramoleculares.
Ejemplo de mecanismo[editar]
Como ejemplo consideramos la reacción global entre el óxido nítrico y el oxígeno:
Se sabe que los productos no se forman directamente como resultado de la colisión de dos moléculas NO con una molécula de O2 porque se ha encontrado la especie N2O2 durante el curso de la reacción. Un mecanismo posible es suponer que la reacción se lleva a cabo en dos etapas o reacciones elementales como las siguientes:
primera etapa
segunda etapa
En la primera etapa dos moléculas de NO chocan para formar una molécula de N2O2; es una reacción bimolecular. Después, sigue una reacción, entre el N2O2 y el O2 para formar dos moléculas de NO2; es una reacción bimolecular. La ecuación química global, que representa el cambio total, se puede interpretar como la suma de estas dos etapas.
Las especies como el N2O2 es el intermediario de la reacción.
Reacciones orgánicas por su mecanismo[editar]
En química orgánica cada reacción tiene un mecanismo de reacción por pasos que explica cómo sucede, aunque no siempre es clara una descripción detallada a partir sólo de una lista de reactantes. Las reacciones orgánicas pueden ser organizadas en algunos tipos básicos. Algunas reacciones encajan en más de una categoría. Por ejemplo, algunas reacciones de sustitución siguen una trayectoria de adición-eliminación. Esta apreciación general no pretende incluir cada reacción orgánica individual. Por el contrario, sólo pretende cubrir las reacciones básicas.
| Tipo de reacción | Subtipo | Comentario |
|---|---|---|
| Reacciones de adición | adición electrofílica | incluye reacciones tales como la halogenación, hidrohalogenación e hidratación. |
| adición nucleofílica | ||
| adición radicalaria | ||
| Reacción de eliminación | incluye procesos tales como la deshidratación, y se observa que siguen mecanismos de reacción E1, E2, o E1cB | |
| Reacciones de sustitución | sustitución nucleofílica alifática | con mecanismos de reacción SN1, SN2 y SNi |
| sustitución nucleofílica aromática | ||
| sustitución nucleofílica acílica | ||
| sustitución electrofílica | ||
| sustitución electrofílica aromática | ||
| sustitución radicalaria | ||
| reacciones orgánicas redox | son reacciones redox específicas de los compuestos orgánicos y son muy comunes. | |
| Reacciones de transposición | Transposiciones 1,2 | |
| Reacciones pericíclicas | ||
| metátesis |
En general, el curso paso a paso de los mecanismos de reacción puede ser representado usando formulas estructurales y estructuras moleculares, en las que se usan flechas curvadas para seguir el movimiento de los electrones como materiales de transición iniciales, hasta los intermediarios y productos.
reacción química, también llamada cambio químico o fenómeno químico, es todo proceso termodinámico en el cual dos o más sustancias (llamadas reactantes o reactivos), se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos.1 Los reactantes pueden ser elementos o compuestos. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro de forma natural, o una cinta de magnesio al colocarla en una llama se convierte en óxido de magnesio, como un ejemplo de reacción inducida.
A la representación simbólica de cada una de las reacciones se le denomina ecuación química.2
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomopresente, la carga eléctrica y la masa total.
Fenómeno químico[editar]
Se llama fenómeno químico a los sucesos observables y posibles de ser medidos en los cuales las sustanciasintervinientes cambian su composición química al combinarse entre sí.3 Las reacciones químicas implican una interacción que se produce a nivel de los electrones de valencia de las sustancias intervinientes. Dicha interacción es el enlace químico.
En estos fenómenos, no se conserva la sustancia original, se transforma su estructura química, manifiesta energía, no se observa a simple vista y son irreversibles,4 en su mayoría.
La sustancia sufre modificaciones irreversibles. Por ejemplo, al quemarse, un papel no puede volver a su estado original. Las cenizas resultantes formaron parte del papel original, y sufrieron una alteración química.
Clases de reacciones[editar]
Reacciones de la química inorgánica[editar]
Desde un punto de vista de la química inorgánica se pueden postular dos grandes modelos para las reacciones químicas de los compuestos inorgánicos: reacciones ácido-base o de neutralización (sin cambios en los estados de oxidación) y reacciones redox (con cambios en los estados de oxidación).5 Sin embargo podemos clasificarlas de acuerdo con los siguientes tres criterios:
| Nombre | Descripción | Representación | Ejemplo | |
|---|---|---|---|---|
| De síntesis o de combinación | Donde los reactivos se combinan entre sí para originar un producto diferente6 | 2 Na (s) + Cl2 (g) → 2 NaCl (s) | ||
| De descomposición6 | Descomposición simple | Una sustancia compuesta se desdobla en sus componentes |
CO2 (g) → CO2 (g) C(s) + O2(g)
| |
| Mediante un reactivo | Una sustancia requiere un reactivo, para su descomposición. | 2 ZnS (S) + 3 O2 (g) → 2 ZnO (S) + 2 SO2 (g) | ||
| De sustitución o desplazamiento6 | Una sustancia sustituye el lugar de alguno de los componentes de los reactivos, de tal manera que el componente sustituido queda libre. | Pb (NO3)2(ac) + 2 KI (ac) → Pbl2 (s) + 2 KNO3(ac) | ||
| De doble sustitución (o de doble desplazamiento) | Se presenta un intercambio entre los elementos químicos o grupos de elementos químicos de las sustancias que intervienen en la reacción química. | Pb (NO3)2(ac) + 2 KI (ac) → Pbl2 (s) + 2 KNO3(ac) | ||
| Criterio | Descripción | Ejemplo | |
|---|---|---|---|
| Intercambio en forma de calor7 | Reacciones exotérmicas | que desprenden calor del sistema de reacción | Combustión |
| Reacciones endotérmicas | reacciones en las que se absorbe o se requiere calor para llevarse a cabo. | Calcinación | |
| Intercambio en forma de luz7 | Reacciones endoluminosas | que requieren el aporte de energía luminosa o luz al sistema para llevarse a cabo. | Fotosíntesis |
| Reacciones exoluminosas | reacciones que al llevarse a cabo manifiestan una emisión luminosa | Combustión del magnesio:
2Mg+O2 + ΔH → 2MgO + Luz
| |
| Intercambio en forma de energía eléctrica7 | Reacciones endoeléctricas | que requieren el aporte de energía eléctrica para que puedan tener lugar. | Electrólisis del agua |
| Reacciones exoeléctricas | aquellas reacciones químicas en las que el sistema transfiere al exterior energía eléctrica. | Celda galvánica(pila o batería eléctrica) | |
| Nombre | Descripción | Ejemplo |
|---|---|---|
| Reacciones ácido-base | Aquellas reacciones donde se transfieren protones | HCl(aq) + NaOH(aq) → H2O(l) + NaCl(aq) |
| Reacciones de oxidación-reducción | Son las reacciones donde hay una transferencia de electrones entre las especies químicas | Mn2(aq) + BiO3- (s) → Bi3(aq) + MnO4-(aq) |
Reacciones de la química orgánica[editar]
Respecto a las reacciones de la química orgánica, nos referimos a ellas teniendo como base a diferentes tipos de compuestos como alcanos, alquenos, alquinos, alcoholes, aldehídos, cetonas, entre otras; que encuentran su clasificación, reactividad y/o propiedades químicas en el grupo funcional que contienen y este último será el responsable de los cambios en la estructura y composición de la materia. Entre los grupos funcionales más importantes tenemos a los dobles y triples enlaces y a los grupos hidroxilo, carbonilo y nitro.
Factores que afectan la velocidad de reacción[editar]
- Naturaleza de la reacción: Algunas reacciones son, por su propia naturaleza, más rápidas que otras. El número de especies reaccionantes, su estado físico las partículas que forman sólidos se mueven más lentamente que las de gases o de las que están en solución, la complejidad de la reacción, y otros factores pueden influir enormemente en la velocidad de una reacción. Por ejemplo, la reacción de los metales alcalinos con sustancias como el oxígeno o el agua es inmediata al ser los primeros mencionados bastante reactivos.
- Concentración: La velocidad de reacción aumenta con la concentración, como está descrito por la ley de velocidad y explicada por la teoría de colisiones. Al incrementarse la concentración de los reactantes, la frecuencia de colisión también se incrementa.
- Presión: La velocidad de las reacciones gaseosas se incrementa muy significativamente con la presión, que es, en efecto, equivalente a incrementar la concentración del gas. Para las reacciones en fase condensada, la dependencia en la presión es débil, y solo se hace importante cuando la presión es muy alta.
- Orden: El orden de la reacción controla cómo afecta la concentración (o presión) a la velocidad de reacción.
- Temperatura: Generalmente, al llevar a cabo una reacción a una temperatura más alta provee más energía al sistema, por lo que se incrementa la velocidad de reacción al ocasionar que haya más colisiones entre partículas, como lo explica la teoría de colisiones. Sin embargo, la principal razón porque un aumento de temperatura aumenta la velocidad de reacción es que hay un mayor número de partículas en colisión que tienen la energía de activación necesaria para que suceda la reacción, resultando en más colisiones exitosas. La influencia de la temperatura está descrita por la ecuación de Arrhenius. Como una regla de cajón, las velocidades de reacción para muchas reacciones se duplican por cada aumento de 10 °C en la temperatura,8 aunque el efecto de la temperatura puede ser mucho mayor o mucho menor que esto. Por ejemplo, el carbón arde en un lugar en presencia de oxígeno, pero no lo hace cuando es almacenado a temperatura ambiente. La reacción es espontánea a temperaturas altas y bajas, pero a temperatura ambiente la velocidad de reacción es tan baja que es despreciable. El aumento de temperatura, que puede ser creado por una cerilla, permite que la reacción inicie y se caliente a sí misma, debido a que es exotérmica. Esto es válido para muchos otros combustibles, como el metano, butano, hidrógeno, etc.
La velocidad de reacción puede ser independiente de la temperatura (no Arrhenius) o disminuir con el aumento de la temperatura (anti Arrhenius). Las reacciones sin una barrera de activación (por ejemplo, algunas reacciones de radicales) tienden a tener una dependencia de la temperatura de tipo anti Arrhenius: la constante de velocidaddisminuye al aumentar la temperatura.
- Solvente: Muchas reacciones tienen lugar en solución, y las propiedades del solvente afectan la velocidad de reacción. La fuerza iónica también tiene efecto en la velocidad de reacción.
- Radiación electromagnética e intensidad de luz: La radiación electromagnética es una forma de energía. Como tal, puede aumentar la velocidad o incluso hacer que la reacción sea espontánea, al proveer de más energía a las partículas de los reactantes. Esta energía es almacenada, en una forma u otra, en las partículas reactantes (puede romper enlaces, promover moléculas a estados excitados electrónicos o vibracionales, etc), creando especies intermediarias que reaccionan fácilmente. Al aumentar la intensidad de la luz, las partículas absorben más energía, por lo que la velocidad de reacción aumenta. Por ejemplo, cuando el metano reacciona con cloro gaseoso en la oscuridad, la velocidad de reacción es muy lenta. Puede ser acelerada cuando la mezcla es irradiada bajo luz difusa. En luz solar brillante, la reacción es explosiva.
- Catalizador: La presencia de un catalizador incrementa la velocidad de reacción (tanto de las reacciones directa e inversa) al proveer de una trayectoria alternativa con una menor energía de activación. Por ejemplo, el platino cataliza la combustión del hidrógeno con el oxígeno a temperatura ambiente. La catálisis es homogénea si el catalizador está en una fase similar a los reactivos y heterogénea si está en una fase diferente.
- Isótopos: El efecto isotópico cinético consiste en una velocidad de reacción diferente para la misma molécula si tiene isótopos diferentes, generalmente isótopos de hidrógeno, debido a la diferencia de masa entre el hidrógeno y el deuterio, ya que átomo más pesado conlleva generalmente a menor frecuencia vibracional de estos, por lo que es requerida mayor cantidad de energía para hacer frente a la mayor energía de activaciónpara romper el enlace.
- Superficie de contacto: En las reacciones en superficies, que se dan por ejemplo durante catálisis heterogénea, la velocidad de reacción aumenta cuando el área de la superficie de contacto aumenta. Esto es debido al hecho de que más partículas del sólido están expuestas y pueden ser alcanzadas por moléculas reactantes.
- Mezclado: El mezclado puede tener un efecto fuerte en la velocidad de reacción para las reacciones en fase homogénea y heterogénea.
Rendimiento químico[editar]
La cantidad de producto que se suele obtener de una reacción química, es menor que la cantidad teórica. Esto depende de varios factores, como la pureza del reactivo; las reacciones secundarias que puedan tener lugar (es posible que no todos los productos reaccionen), la recuperación del 100 % de la muestra es prácticamente imposible.
El rendimiento de una reacción se calcula mediante la siguiente fórmula:
Cuando uno de los reactivos esté en exceso, el rendimiento deberá calcularse respecto al reactivo limitante. Y el rendimiento depende del calor que expone la reacción.
Grado de avance de la reacción y afinidad[editar]
Una reacción se puede representar mediante la siguiente expresión matemática:
donde son los coeficientes estequiométricos de la reacción, que pueden ser positivos (productos) o negativos (reactivos). La ecuación presenta dos formas posibles de estar químicamente la naturaleza (como suma de productos o como suma de reactivos).
Si es la masa del producto que aparece, o del reactivo que desaparece, resulta que:
constante . sería la masa molecular del compuesto correspondiente y se denomina grado de avance. Este concepto es importante pues es el único grado de libertad en la reacción.
Cuando existe un equilibrio en la reacción, la entalpía libre es un mínimo, por lo que:
permite entender que la afinidad química es nula.









![{\displaystyle \sum _{i=1}^{N}{\nu _{i}[C_{i}]}=0}](https://wikimedia.org/api/rest_v1/media/math/render/svg/384d13833021b4ff496a534b901e448305c0cb8d)







No hay comentarios:
Publicar un comentario