masa molecular (masa molecular relativa o peso fórmula), cuyo símbolo es mf, es una magnitud que indica cuántas veces la masa de una molécula de una sustancia es mayor que la unidad de masa atómica. Su valor numérico coincide con el de la masa molar, pero habitualmente expresado en unidades de masa atómica(su unidad en el SI es el kilogramo), en lugar de gramos/mol. La masa molecular alude a una sola molécula, mientras que la masa molar corresponde a un mol (NA = 6,022 · 1023) de moléculas.
Cálculo de la masa molecular[editar]
La masa molecular puede ser expresada tal que
,
donde
- es el número de átomos del i-ésimo elemento presente en la molécula.
- es la masa atómica del i-ésimo elemento presente en la molécula.
Así como ejemplo, en el caso del agua (H2O), como se trata de una molécula formada por dos átomos de hidrógeno (ma(1H) = 1,00797 u) y un átomo de oxígeno (ma(16O) = 15,9994 u), su masa molecular es de 18,01534 u.
Al igual que la masa atómica, la masa molecular se expresa en unidades de masa atómica: umas (u) o daltons(Da), que son equivalentes. Las umas son una unidad usada en química y física, mientras que los daltons se usan en bioquímica, ya que aportan la ventaja de poderse emplear para moléculas mayores al aceptar un múltiplo, el kilodalton: kDa.
momento dipolar químico () a la medida de la intensidad de la fuerza de atracción entre dos átomos. Es la expresión de la asimetría de la carga eléctrica en un enlace químico. Está definido como el producto entre la distancia que separa a las cargas (longitud del enlace) y el valor de las cargas iguales y opuestas en un enlace químico:
Usualmente se encuentra expresado en Debyes (1 D = 1 A . 1 ues). El valor de puede interpretarse como el grado de compartición de la carga, es decir, según las diferencias de electronegatividad, que porcentaje (100q) de la carga compartida por el enlace covalente está desplazada hacia la carga en cuestión. Dicho de otro modo, representa qué parte de un electrón está siendo "sentida" de más o de menos por las cargas en cuestión.
Vector μ[editar]
Es de suma importancia la participación del momento dipolar como un vector con dirección hacia el átomo más electronegativo del enlace. Tomemos el ejemplo del dióxido de carbono (CO2), debido a la diferencia de electronegatividades en los enlaces C-O encontramos un diferente de 0, pero la molécula de CO2, experimentalmente, demuestra no ser polar. Esto se debe a que la geometría molecular del CO2 determina que ambos vectores 'μ' de los dos enlaces C-O se cancelen por suma vectorial. Esto demuestra que la polaridad de las moléculas depende tanto de los momentos dipolares de enlace, como de la geometría molecular determinada por la TREPEV, lo que resulta en un momento dipolar molecular (suma vectorial de los momentos dipolares parciales).
Importancia de μ en la atracción dipolo-dipolo[editar]
La intensidad de las fuerzas de atracción entre moléculas polares (dipolo-dipolo) está determinada por el momento dipolar de cada una de ellas, actuando de manera directamente proporcional. Así, mientras más polar sea la molécula (mayor ), mayor será la intensidad de las fuerzas de atracción intermoleculares de tipo dipolo-dipolo que presente en las sustancias.
En física y química, el número atómico1 de un elemento químico es el número total de protones que tiene cada átomo de ese elemento. Se suele representar con la letra Z.
Los átomos de diferentes elementos tienen distintos números de electrones y protones. Un átomo en su estado natural es neutro y tiene un número igual de electrones y protones. Un átomo de sodio (Na) tiene un número atómico de 11; posee 11 electrones y 11 protones. Un átomo de magnesio (Mg), tiene número atómico de 12, posee 12 electrones, 12 protones y un átomo de uranio (U), que tiene número atómico de 92, posee 92 electrones y 92 protones.
Se coloca como subíndice a la izquierda del símbolo del elemento correspondiente. Por ejemplo, todos los átomos del elemento hidrógeno tienen 1 protón y su Z = 1; esto sería ₁H. Los de helio tienen 2 protones y Z = 2; asimismo, ₂He. Los de litio, 3 protones y Z = 3…,
Si el átomo es neutro, el número de electrones coincide con el de protones y da Z.
En 1913 Henry Moseley demostró la regularidad existente entre los valores de las longitudes de onda de los rayos X emitidos por diferentes metales tras ser bombardeados con electrones, y los números atómicos de estos elementos metálicos. Este hecho permitió clasificar los elementos en la tabla periódica en orden creciente de número atómico. En la tabla periódica los elementos se ordenan de acuerdo con sus números atómicos en orden creciente.
Origen de la denominación "Z"[editar]
El símbolo convencional "Z" posiblemente proviene de la palabra alemana Atomzahl (número atómico).2 Antes de 1915, la palabra Zahl (simplemente número) era usada para el número asociado a cada elemento en la tabla periódica.
Números atómicos de los elementos[editar]
Relación de elementos por orden alfabético con sus números atómicos:
Números atómicos en la tabla periódica[editar]
Tabla periódica con la relación de elementos químicos (del 1 al 118) y sus correspondientes números atómicos:3
| H 1 | He 2 | ||||||||||||||||
| Li 3 | Be 4 | B 5 | C 6 | N 7 | O 8 | F 9 | Ne 10 | ||||||||||
| Na 11 | Mg 12 | Al 13 | Si 14 | P 15 | S 16 | Cl 17 | Ar 18 | ||||||||||
| K 19 | Ca 20 | Sc 21 | Ti 22 | V 23 | Cr 24 | Mn 25 | Fe 26 | Co 27 | Ni 28 | Cu 29 | Zn 30 | Ga 31 | Ge 32 | As 33 | Se 34 | Br 35 | Kr 36 |
| Rb 37 | Sr 38 | Y 39 | Zr 40 | Nb 41 | Mo 42 | Tc 43 | Ru 44 | Rh 45 | Pd 46 | Ag 47 | Cd 48 | In 49 | Sn 50 | Sb 51 | Te 52 | I 53 | Xe 54 |
| Cs 55 | Ba 56 | * | Hf 72 | Ta 73 | W 74 | Re 75 | Os 76 | Ir 77 | Pt 78 | Au 79 | Hg 80 | Tl 81 | Pb 82 | Bi 83 | Po 84 | At 85 | Rn 86 |
| Fr 87 | Ra 88 | ** | Rf 104 | Db 105 | Sg 106 | Bh 107 | Hs 108 | Mt 109 | Ds 110 | Rg 111 | Cn 112 | Nh 113 | Fl 114 | Mc 115 | Lv 116 | Ts 117 | Og 118 |
| * | La 57 | Ce 58 | Pr 59 | Nd 60 | Pm 61 | Sm 62 | Eu 63 | Gd 64 | Tb 65 | Dy 66 | Ho 67 | Er 68 | Tm 69 | Yb 70 | Lu 71 | ||
| ** | Ac 89 | Th 90 | Pa 91 | U 92 | Np 93 | Pu 94 | Am 95 | Cm 96 | Bk 97 | Cf 98 | Es 99 | Fm 100 | Md 101 | No 102 | Lr 103 | ||
pCO2 es la presión parcial de dióxido de carbono (CO2) en la sangrearterial. También se representa como PaCO2. Expresa la eficacia de la ventilación alveolar, dada la gran capacidad de difusión de este gas. Es un buen indicador de la función respiratoria y refleja la cantidad de ácido en la sangre (sin contar el ácido láctico).
Valores[editar]
- Sus valores normales fluctúan de 35 a 45 mmHg.
- Si la pCO2 es menor de 35 mmHg, el paciente está hiperventilando, y si el pH (potencial de hidrógeno) es mayor de 7,45, corresponde a una alcalosis respiratoria.
- Si la pCO2 es mayor de 45 mmHg, el paciente está hipoventilando, y si el pH es menor que 7,35, es una acidosis respiratoria.








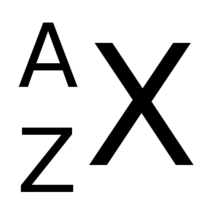
No hay comentarios:
Publicar un comentario