«Ácidos carboxílicos»
El ácido siálico está presente siempre en los gangliosidos (glucoesfingolípidos presente en la membrana plasmática de las células de los ganglios del sistema nervioso central).
En sistemas bacteriales, los ácidos siálicos son biosintetizados por una enzima tipo aldolasa. La enzima utiliza un derivado de la manosa(N-Acetil-2-manosamina) como sustrato, en donde se efectúa una condensación aldólica con una molécula de ácido pirúvico, la cual aporta con tres carbonos del ácido siálico.1
HIDRATOS DE CARBONO
6.4. Monómeros de azúcares modificados
En la naturaleza es habitual encontrar a los monómeros anteriormente descritos con un mayor o menor grado de modificación. Estas modificaciones son del tipo:
- Formas fosforiladas, en las que alguno de los grupos alcohol, se encuentran formando un ester fosfórico
- Derivados de aminas, tales como la glucosamina o la galactosamina, en la que uno de los grupos hidroxilo ha sido sustituido por un grupo amina
- Derivados amino acetilados, tales como la N-acetilglucosamina (GlcNAc) o N-acetilgalactosamina (GalNAc)
- Formas oxidadas de los azúcares en los que la función aldehído o alcohol se ha oxidado a ácido carboxílico
- Formas lactonas (ésteres intramoleculares) en los que un grupo OH ataca a un carbono previamente oxidado a ácido carboxílico
- Condensación de productos derivados de azúcares con ácido láctico (CH3CHOHCO2H) y pirúvico (CH3COCO2H) para formar, respectivamente, ácido murámico y ácido neuramico (uno de los llamados ácidos siálicos)
En la figura anterior, el ácido N-acetilmurámico que se encuentra en las paredes celulares bacterianas, es un Nacetilglucosamina unida mendiante un eter en el C3 a un lactato, mientras que el ácido N-acetilneuramínico resulta de una ciclación intramolecular y una condensación de N-acetilmanosamina con piruvato.
| Una de las diferencias entre la especie humana y el resto de los mamíferos es la presencia en el hombre del ácido N-acetilneuramínico. En el resto de los mamíferos, el ácido siálico presente es el ácido N-glicoilneuramínico
El ácido siquímico o más comúnmente conocido como su forma aniónica el siquimato, es un intermediario bioquímico importante en plantas y microorganismos. Su nombre deriva de la flor del shikimi japonés (シキミ, Illicium anisatum), fuente natural del cual fue extraído por primera vez.
El ácido siquímico se puede extraer también del anís estrellado de la China o anís estrellado común (Illicium verum) y de las semillas de la planta liquidambar, abundante en toda América.
El ácido siquímico es un precursor de:
En la industria farmacéutica el ácido siquímico, obtenido del anís estrellado (Illicium verum), es utilizado para la producción del antivirus tamiflu (oseltamivir). Aunque el ácido siquímico está presente en muchos organismos autotrofos es también un intermediario biosintético y generalmente se encuentra en concentraciones muy bajas.
La ruta del ácido shikímico es un conjunto de reacciones metabólicas de gran relevancia en la biosíntesis de metabolitos secundarios. El ácido shikímico es precursor de diversos intermediarios metabólicos aromáticos, tales como los taninos, el cloranfenicol, el ácido 4-aminobenzoico, los fenilpropanoides, los lignanos, los aminoácidos aromáticos (tirosina, fenilalanina y triptófano), así como sus derivados: glucósidos cianogénicos aromáticos, aminas biógenas aromáticas, catecolaminas, betalaínas, melaninas, bisindoles, los flavonoides, las fenazinas y diversos alcaloides tales como los tetrahidroisoquinolínicos, los alcaloides del ergot y los morfinanos, entre otros. El intermediario principal es el ácido shikímico, un compuesto originalmente aislado de plantas del género Illicium. En compuestos aromáticos derivados del ácido shikímico, las posiciones oxigenadas son de tipo catecol (orto) o pirogalol (diorto), y en el caso de los fenoles monooxigenados son generalmente p-hidroxi-compuestos. Ruta del ácido shikímico
La ruta del ácido shikímico es un conjunto de reacciones metabólicas de gran relevancia en la biosíntesis de metabolitos secundarios. El ácido shikímico es precursor de diversos intermediarios metabólicos aromáticos, tales como los taninos, el cloranfenicol, el ácido 4-aminobenzoico, los fenilpropanoides, los lignanos, los aminoácidos aromáticos (tirosina, fenilalanina y triptófano), así como sus derivados: glucósidos cianogénicos aromáticos, aminas biógenas aromáticas, catecolaminas, betalaínas, melaninas, bisindoles, los flavonoides, las fenazinas y diversos alcaloides tales como los tetrahidroisoquinolínicos, los alcaloides del ergot y los morfinanos, entre otros. El intermediario principal es el ácido shikímico, un compuesto originalmente aislado de plantas del género Illicium. En compuestos aromáticos derivados del ácido shikímico, las posiciones oxigenadas son de tipo catecol (orto) o pirogalol (diorto), y en el caso de los fenoles monooxigenados son generalmente p-hidroxi-compuestos.
Índice
YouTube Encyclopedic
Distribución
Esta ruta es empleada por bacterias, algas, plantas y algunos hongos pero no por animales y protozoarios. Sin embargo, los tres aminoácidos aromáticos son esenciales para la vida.
Principales rutasRuta del 3-deshidroquinato
El ácido shikímico se biosintetiza originalmente del fosfoenol piruvato y la eritrosa 4-fosfato para formar el precursor denominadoácido 3-deshidroquínico. Éste ácido puede formar varios metabolitos, como el ácido gálico, el ácido protocatecuico, el ácido quínico y el ácido shikímico:
Ruta del corismato
El ácido shikímico puede producir por una vía enzimática de 3 pasos uno de los metabolitos intermedios más importantes de la ruta del ácido shikímico, el ácido corísmico:
En esta ruta se llevan a cabo 3 reacciones:
El ácido corísmico puede producir metabolitos de gran diversidad química:
Ruta del prefenato: Biosíntesis de los aminoácidos aromáticos
Las rutas de los aminoácidos aromáticos L-fenilalanina y L-tirosina a partir del ácido prefénico pueden variar de acuerdo al organismo, y en muchos casos puede operar más de una ruta en una especie. En esencia, tres tipos de reacción están implicadas: Transaminación, aromatización descarboxilativa e hidroxilaciones, pero lo que cambia en los organismos es el orden en el que se llevan a cabo. Así, en algunos organismos se pueden producir tanto sustratos del ácido arogénico como del prefénico. Muchas bacterias y plantas tienden a sintetizar la fenilalanina y la tirosina por separado.
Los animales, en cambio, carecen de la ruta del ácido shikímico, por lo que la fenilalanina resulta esencial, no así la tirosina, la cual se puede obtener por la para-hidroxilación de la fenilalanina:
Ruta de los fenilpropanoides
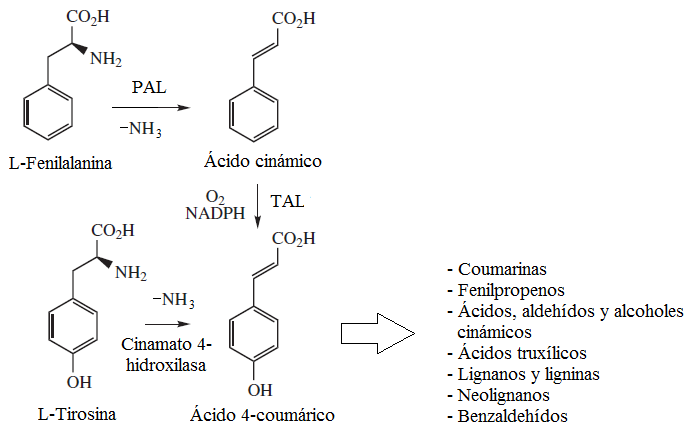
La L-fenilalanina y la L-tirosina son bloques de contrucción para una amplia gama de metabolitos secundarios: los fenilpropanoides(Compuestos tipo C6C3). En plantas, el primer paso es la eliminación del nitrógeno de la fenilalanina en forma de amoniaco para generar el ácido trans-cinámico (En el caso de la tirosina se forma Ácido p-coumárico) Todas las plantas pueden desaminar fenilalanina por medio de la fenilalanina amoniaco liasa (PAL), pero la desaminación de tirosina parece ser más restringida a miembros de la familia Poaceae. La tirosina amoniaco liasa (TAL) ha sido encontrada en plantas y bacterias. Aquellos organismos que no pueden desaminar la tirosina obtienen el ácido p-coumárico por hidroxilación del ácido cinámico.
Rutas de los arilpiruvatos
Los productos de transaminación de aminoácidos aromáticos son el ácido fenilpirúvico y el ácido p-hidroxifenilpirúvico, los cuales pueden ser interconvertibles en algunos organismos via prefenato. El ácido fenilpirúvico puede reducirse para formar ácido 3-fenil láctico, el cual puede transformarse por transposición en ácido trópico, componente de la hiosciamina. El ácido fenilpirúvico puede dimerizarse por medio de una condensación aldólica doble para formar ácido polipórico, el cual es precursor de varios terfenilos, por ejemplo atromentina, volucrisporina, leucomelona, muscafurina, ácido telefórico y xileritrina. El ácido polipórico puede escindirse oxidativamente para formar ácido pulvínico y sus derivados.
El ácido 4-hidroxifenilpirúvico es precursor de la 4-hidroxifenilglicina, aminoácido componente de péptidos no ribosomales, como en el caso de la vancomicina.
El ácido homogentísico es un catabolito de la tirosina. También es precursor en la biosíntesis de las plastoquinonas.
Rutas de la DOPA
La 3,4-dihidroxifenilalanina (DOPA) es un precursor relevante en el metabolismo de la tirosina y la fenilalanina. Se produce por la hidroxilación de la tirosina y produce varios metabolitos secundarios tales como las melaninas, las catecolaminas, las betalaínas, las higroaurinas, los alcaloides tetrahidroisoquinolínicos y otros alcaloides.
Glucósidos cianogénicos y glucosinolatos de aminoácidos aromáticos
Los aminoácidos aromáticos pueden formar glucósidos cianogénicos y glucosinolatos. Ambos siguen las mismas rutas generales para ambos tipos de compuestos, en donde la formación de la aldoxima es el metabolito intermediario que puede formar el glucósido cianogénico o el glucosinolato, dependiendo de la especie. A continuación se ilustra como ejemplo la biosíntesis de los derivados de la tirosina, durrina y sinalbina. La mirosinasa hidroliza de manera general a todos los glucosinolatos cuando la planta presenta un daño físico.
Rutas del ácido antranílicoAcridinas y quinolinas
El ácido antranílico es precursor de varios metabolitos secundarios por condensación o conjugación con moléculas provenientes de otras rutas.
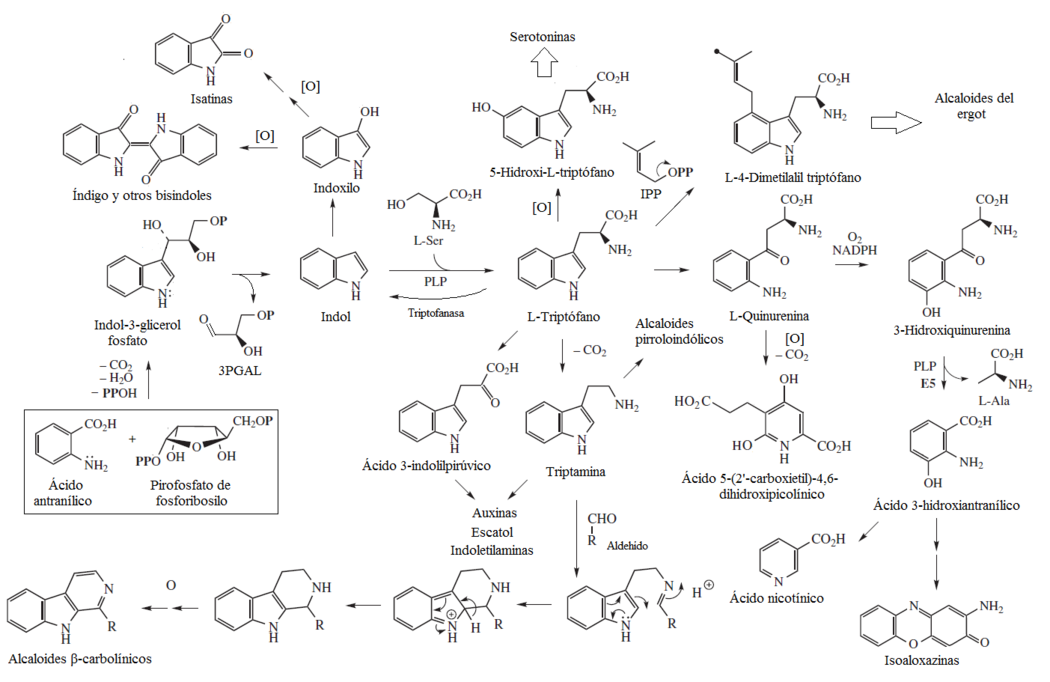
Indol y triptófano
El indol es biosintetizado a partir de ácido antranílico y pirofosfato de 5-fosfato-1-ribosilo. Se forma el fosfato de 3-indolilglicerol como intermediario, el cual elimina una molécula de alanina para formar indol ligado a la enzima (No se encuentra libre). Este indol realiza una SEA con una molécula de serina para formar el triptófano. Este aminoácido puede seguir las siguientes rutas:
El triptófano también puede formar glucosinolatos, por ejemplo, la glucobrasicina (V.Biosíntesis de glucosinolatos)
Existen otros compuestos que proceden del triptófano o el ácido antranílico cuyas biosíntesis se revisarán en sus artículos correspondientes, tales como la camalexina, brassilexina, la estaurosporina, la piocianina, la violaceína, las benzoxazinas, las criptolepinas, la luciferina.
Catabolismo de los derivados del ácido shikímicoDegradación de fenilalanina y tirosina
Se ha encontrado que los seres vivos pueden catabolizar la tirosina, la fenilalanina y los fenilpropanoides. La L-fenilalanina puede degradarse por descarboxilación (con catálisis de la Descarboxilasa de los aminoácidos aromáticos, EC 4.1.1.28) para producir feniletilamina, o por transaminación para dar el ácido fenilpirúvico.
La fenetilamina puede transaminarse para dar el fenilacetaldehído. Este compuesto se oxida a ácido fenilacético por acción de una aldehído deshidrogenasa (EC 1.2.1.5). Posteriormente una monooxigenasa hidroxila el anillo aromático en posición meta. Una vez más, se puede hidroxilar por la acción otra monooxigenasa en la posición 4. El producto intermediario es el ácido homoprotocatecuico. El ácido fenilacético se puede esterificar con la Coenzima A.
Por otro lado, el ácido fenilpirúvico sufre una descarboxilación oxidativa para formar fenilacetaldehído, el cual se puede incorporar a la ruta anteriormente descrita.
De modo análogo, la tirosina puede descarboxilarse o transaminarse, como se indicó en el inciso anterior. El producto de transaminación (Ácido p-hidroxifenilpirúvico) puede ser epoxidado en la posición 1,2 con transposición para dar el ácido homogentísico. Si el producto de transaminación se descarboxila con oxidación, se forma el 4-hidroxifenilacetaldehído. El producto de descarboxilación de la tirosina (la tiramina) al transaminarse forma también el 4-hidroxifenilacetaldehído. Este compuesto se oxida a su correspondiente ácido carboxílico, el cual se puede oxigenar por acción de la 4-hidroxifenilacetato 1-monooxigenasa (EC 1.14.13.18). El producto por acción de esta enzima produce también ácido homogentísico. Otra ruta que puede tomar el ácido 4-hidroxifenilacético es oxigenarse por acción de otra enzima, la 4-hidroxifenilacetato-3-monooxigenasa de cadena larga (EC 1.14.14.9). El producto de esta reacción es elácido homoprotocatecuico.
La degradación de los aminoácidos tirosina y fenilalanina puede producir, dependiendo el organismo, 3 compuestos intermediarios:
Cada uno de estos intermediarios tiene distintas formas de catabolizarse, lo cual deja ver la gran diversidad metabólica que existe en los seres vivos para el aprovechamiento energético de varios compuestos aromáticos.
La degradación del ácido homoprotocatecuico procede por los siguientes pasos:
La fenilacetil-Coenzima A puede degradarse por dos vías:
La degradación del ácido homogentísico tiene dos posibles rutas:
Degradación del ácido benzoico
El ácido benzoico es un metabolito de degradación de compuestos aromáticos en plantas y bacterias . Este compuesto es un xenobiótico que puede resultar tóxico para animales y hongos, por lo que los seres vivos han desarrollado distintas rutas complejas para la degradación del ácido benzoico o sus sales. El esquema general es la hidroxilación del ácido benzoico (la cual se puede efectuar en distintas posiciones) para dar intermediarios que pueden escindirse oxidativamente para dar derivados del ácido mucónico. Estos compuestos pueden seguirse oxidando para producir moléculas que pueden incorporarse en el ciclo de ácido cítrico:
Muchos mamíferos herbívoros eliminan el ácido benzoico por la formación del ácido hipúrico. La benzoil Coenzima A puede funcionar como unidad de iniciación en la ruta de los policétidos.
Degradación de fenilpropanoides |




















No hay comentarios:
Publicar un comentario