Actividad acuosa (denominada también «actividad de agua») se define como la relación que existe entre la presión de vapor de un alimento dado en relación con la presión de vapor del agua pura a la misma temperatura. Se denomina por regla general comoaw del idioma inglés Water activity, aw ). La actividad acuosa es un parámetro estrechamente ligado a la humedad del alimento lo que permite determinar su capacidad de conservación, de propagación microbiana, etc. La actividad acuosa de un alimento se puede reducir aumentando la concentración de solutos en la fase acuosa de los alimentos mediante la extracción del agua (liofilización) o mediante la adición de nuevos solutos. La actividad acuosa junto con la temperatura, el pH y el oxígeno son los factores que más influyen en la estabilidad de los productos alimenticios.
Fórmulas
Definición de aw:
donde p es la presión de vapor de agua en la sustancia y p₀ es la presión de vapor del agua pura a la misma temperatura.
Definición alternativa:
donde lw es el coeficiente de actividad del agua y xw es la fracción molar del agua en la fracción acuosa.
Relación con la humedad relativa: La humedad relativa del aire en equilibrio con una muestra se denomina la Humedad Relativa de Equilibrio (ERH) por sus siglas en inglés.1
Vida útil libre de moho estimada en días a 21° C:
Características
Existen diversos factores que controlan la actividad acuosa de un sistema. Los efectos coligativos de las especies disueltas (como puede ser por ejemplo la sal o elazúcar) la interacción dipolar, iónica, o de enlace de hidrógeno con las moléculas de agua. Los efectos de capilaridad cuando el vapor de agua sobre el menisco es menor que en el agua pura debido a las interacciones de puente de hidrógeno entre las moléculas de agua. La interacciones de superficie interaccionan directamente con los enlaces de las substancias disueltas o en suspensión (como puede ser el almidón o las proteinas) mediante fuerzas dipolares de los enlaces iónicos (H3O++ o OH-),fuerzas de Van der Waals (enlaces hidrofóbicos) y enlaces de hidrógeno. La combinación de estos tres factores en los productos alimenticios hace que se reduzca la energía del agua y se reduzca igualmente la humedad relativa comparada con el agua pura. Estos factores pueden ser agrupados en dos amplias categorías: efectos deósmosis y de matriz.
Actividad acuosa (Aw)
7.1 Cinética de ganar y perder agua
Del agua contenida en un alimento depende las propiedades reológicas y de textura de un alimento. La Aw de un alimento es responsable de los mecanismos principales de deterioro; química, microbiológica y enzimática, ya que el agua en estado ligada no interviene como reactante. El agua libre es entonces la responsable del deterioro, ésta se debe medir. Para medir la fracción de agua libre en el alimento se usa el término Actividad acuosa y representa: el grado de interacción del agua libre con los demás constituyentes ó la porción de agua que esta disponible en un producto. En base al valor numérico de la Aw se puede predecir la estabilidad del alimento.
La Aw acuosa matemáticamente es:
Aw= Pw / Pº
Aw= Presión de vapor de agua del alimento/Presión de vapor del agua pura ó
Aw = HR/100
La presión de vapor del agua en el alimento es siempre menor que la presión de vapor del agua pura, por lo tanto la actividad acuosa de los alimentos es siempre menor que 1.
Es una forma practica de expresar el grado de disponibilidad del agua en un alimento; es la relación que existe entre la presión del vapor del agua en un alimento y la presión del vapor del agua pura a la misma temperatura. En otras palabras es el grado de disponibilidad de agua de un alimento y se relaciona con el porcentaje de humedad (HR) ó humedad del aire o atmósfera que rodea al alimento.
En un análisis más profundo; según Bello, José, En un sistema alimentario, la actividad de agua está íntimamente relacionada a la humedad relativa del espacio fisicoquímico que rodea al alimento. La humedad relativa hace referencia a la cantidad de vapor de agua contenida en un volumen específico de aire, comparado con la cantidad máxima de vapor de agua alcanzado por aire enfriado a una temperatura especifica. En realidad, la actividad de agua es igual al valor alcanzado por la humedad relativa de equilibrio del alimento, punto en el que no se gana ni se pierde agua.
Como se puede apreciar en la ecuación, la Aw representa la humedad relativa ambiental (aire u otro gas que rodea al alimento) que se encuentra en equilibrio termodinámico con el agua presente en el alimento.
Para Barreiro, José el proceso de alcanzar el equilibrio termodinámico puede tomar tiempo apreciable, dependiendo de las características físicas y de transporte del alimento, sus dimensiones y otros parámetros como la temperatura, y genralmente es gobernado por las leyes de difusión de masa. Por ejemplo: Si se coloca un grano de maíz con un contenido de humedad del 10% en una cámara cerrada que contiene aire con una húmedad relativa del 70%, la cual permanece constante en tiempo y a una temperatura de 25ºC. Bajo estas condiciones el grano tenderá a ganar humedad hasta lograr el equilibrio termodinámico con el ambiente que lo rodea, el cual tiene una humedad relativa que corresponde a una Aw en equilibrio en el alimento de 0.70.
afinidad química puede ser definida como las propiedades electrónicas por las que especies químicas disímiles son capaces de formar compuestos químicos.1 La afinidad química también puede referirse a la tendencia de un átomo o compuesto para combinarse por una reacción química con átomos o compuestos de composición distinta.
Según el historiador químico Henry Leicester, el influyente libro de texto de 1923 Thermodynamics and the Free Energy of Chemical Reactions (Termodinámica y Energía Libre de las Reacciones Químicas) por Gilbert N. Lewis y Merle Randall condujo a la sustitución del término "afinidad" por el término "energía libre" en la mayor parte del mundo angloparlante.
Concepciones modernas
En términos modernos, relacionamos afinidad al fenómeno en el que ciertos átomos o moléculas tienen la tendencia a agregarse o enlazarse. Por ejemplo, en el libro de 1919 Chemistry of Human Life (La Química de la Vida Humana), el fisiólogo George W. Carey enuncia:
La salud depende de una cantidad apropiada de fosfato de hierro Fe3(PO4)2 en la sangre, porque las moléculas de esta sal tienen afinidad química por el oxígeno, y lo transportan a todas las partes del organismo.
En este contexto anticuado, se encuentra que la afinidad química es sinónimo con el término "atracción magnética". Muchos escritos, hasta cerca de 1925, también se refieren a la "ley de afinidad química".
Termodinámica
En 1923, el matemático y físico belga Théophile de Donder derivó una relación entre la afinidad 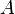 y la energía libre de Gibbs
y la energía libre de Gibbs 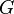 de una reacción química. A través de una serie de derivaciones, de Donder mostró que si se considera una mezcla de especies químicas con la posibilidad de que haya una reacción química, puede probarse que se conserva la siguiente relación:
de una reacción química. A través de una serie de derivaciones, de Donder mostró que si se considera una mezcla de especies químicas con la posibilidad de que haya una reacción química, puede probarse que se conserva la siguiente relación:
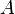 y la energía libre de Gibbs
y la energía libre de Gibbs 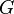 de una reacción química. A través de una serie de derivaciones, de Donder mostró que si se considera una mezcla de especies químicas con la posibilidad de que haya una reacción química, puede probarse que se conserva la siguiente relación:
de una reacción química. A través de una serie de derivaciones, de Donder mostró que si se considera una mezcla de especies químicas con la posibilidad de que haya una reacción química, puede probarse que se conserva la siguiente relación:
Con los escritos de Théophile de Donder como precedente, Ilya Prigogine y Defay en su Chemical Thermodynamics (Termodinámica Química) de 1954, definieron la afinidad química (denotada por 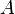 ), como una función de los incrementos en el calor de reacción incompensado y la variable del progreso de la reacción (denotadas por
), como una función de los incrementos en el calor de reacción incompensado y la variable del progreso de la reacción (denotadas por  y
y  , respectivamente):
, respectivamente):
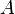 ), como una función de los incrementos en el calor de reacción incompensado y la variable del progreso de la reacción (denotadas por
), como una función de los incrementos en el calor de reacción incompensado y la variable del progreso de la reacción (denotadas por  y
y  , respectivamente):
, respectivamente): (1).
(1).
Esta definición es útil para cuantificar los factores responsables tanto para el estado de los sistemas en equilibrio (donde  ), y para los cambios de estado de los sistemas que no están en equilibrio (donde
), y para los cambios de estado de los sistemas que no están en equilibrio (donde  ).
).
 ), y para los cambios de estado de los sistemas que no están en equilibrio (donde
), y para los cambios de estado de los sistemas que no están en equilibrio (donde  ).
).
La definición IUPAC actual de la afinidad química es: El negativo de la derivada parcial de la energía de Gibbs con respecto a la extensión de la reacción a temperatura y presión constante. Es positiva para reacciones espontáneas.2
Historia
Históricamente, la "afinidad química" se refiere a la "fuerza" que origina una reacción química.3 Una definición más amplia, usada generalmente a través de la historia, es que la afinidad química es donde las sustancias entran o resisten la descomposición.4
El siguiente enunciado, hecho por Ilya Prigogine, resume el concepto de afinidad:
Todas las reacciones químicas llevan al sistema a un estado de equilibrio en el que las afinidades de las reacciones se desvanecen
El término afinidad ha sido usado figurativamente desde cerca a 1600 en discusiones de relaciones estructurales en química, filología, etc., y hay referencias a "atracción natural" desde 1616.
La idea de afinidad es extremadamente antigua. Muchos intentos se han hecho en la identificación de sus orígenes.4 Sin embargo, la mayoría de esos intentos, excepto en modos generales, terminan en futilidad dado que las ‘afinidades’ yacen en una base plenamente mágica, en consecuencia precediendo a la ciencia.5 Sin embargo, laquímica física fue una de las primeras ramas de la ciencia en estudiar y formular una "teoría de la afinidad". El nombre affinitas fue usado primero en el sentido de relación química por el filósofo alemán Alberto Magno cerca del año 1250. Posteriormente, Robert Boyle, John Mayow, Johann Glauber, Isaac Newton, y Georg Stahladelantaron ideas sobre la afinidad electiva en intentos de explicar cómo está involucrado el calor durante las reacciones de combustión.6
El término moderno afinidad química es una variante algo modificada de sus precursores "afinidad electiva" o atracciones electivas, del siglo XVIII, acuñado por el químico sueco Torbern Olof Bergman de su libro De attractionibus electivis (1775). Antoine Lavoisier, en su famoso Traitée Élémentaire de Chimie (Tratado elemental de química) de 1790, hace referencia al trabajo de Bergmann y discute el concepto de afinidades o atracciones electivas.
Goethe usó el concepto en su novela Las afinidades electivas, de 1809.
Tabla de afinidades de Geoffroy de 1718
La primera tabla de afinidades, que estaba basada en reacciones de desplazamiento, fue publicada en 1718 por el químico francés Étienne François Geoffroy. Su nombre está más asociado en conexión con estas tablas de "afinidades" (tables des rapports), que fueron presentadas por primera vez a la Academia Francesa en 1718 y 1720, como se muestra a continuación:
Estas fueron listadas, preparadas por observaciones colacionando las acciones de las sustancias sobre otras, mostrando los diversos grados de afinidad exhibidos por cuerpos análogos para diferentes reactivos y mantuvieron este perfil por el resto del siglo, hasta que fueron desplazados por las concepciones más profundas introducidas por Claude Berthollet.
La afinidad química se divide en dos vertientes:
– Cualitativa, aptitud de los elementos para combinarse entre sí.
– Cuantitativa, medida del trabajo realizado por las fuerzas que actúan sobre un sistema formado por dos o más elementos.
Ejemplo:
Dos elementos son afines, en condiciones adecuadas, darán lugar aún compuesto químico, estos se combinarán en una determinada proporción.
Esto quiere decir que la molécula del compuesto formado, agua, posee dos átomos de hidrógeno y uno de oxígeno y este vale el doble que el hidrógeno.
Hoy en día la IUPAC, define afinidad química como: “El negativo de la derivada parcial de laenergía de Gibbs con respecto a la extensión de la reacción a temperatura y presión constante. Es positiva para reacciones espontáneas”.
La afinidad química, históricamente se refería a la “fuerza” que producía una reacción química, creyéndose también que era donde las sustancias se descomponían o se resistían a ello.
IIya Prigogine, fisicoquímico belga y premio Nobel, definió la afinidad química como:
“Todas las reacciones químicas llevan al sistema a un estado de equilibrio en el que las afinidades de las reacciones de desvanecen”.
La idea o término de la afinidad, es usada desde entorno al 1600, en numerosas referencias consta la mención a una “atracción natural”, siendo así un término bastante antiguo, sin llegar a identificar su origen exacto. Lo que si se sabe con certeza, es que fue la fisicoquímica la rama de la ciencia que expuso la “teoría de la afinidad”.
Tabla de afinidades de Geoffroy
La primera tabla de afinidades, que estaba basada en reacciones de desplazamiento, fue publicada en 1718 por el químico francés Étienne François Geoffroy.
Su nombre está más asociado en conexión con estas tablas de “afinidades” (tables des rapports), que fueron presentadas por primera vez a la Academia Francesa en 1718 y 1720, como se muestra a continuación:






No hay comentarios:
Publicar un comentario