Configuración electrónica
El principio de Aufbau contiene una serie de instrucciones relacionadas a la ubicación de electrones en los orbitales de un átomo. El modelo, formulado por el físico Niels Bohr, recibió el nombre de Aufbau (del alemánAufbauprinzip: principio de construcción) en vez del nombre del científico. También se conoce popularmente con el nombre de regla del serrucho o regla de Madelung.
Los orbitales se 'llenan' respetando la regla de Hund, que dice que ningún orbital puede tener dos orientaciones del giro del electrón sin antes de que los restantes números cuánticos magnéticos de la misma subcapa tengan al menos uno. Se comienza con el orbital de menor energía.
Primero debe llenarse el orbital 1s (hasta un máximo de dos electrones), esto de acuerdo con el número cuántico l.
Seguido se llena el orbital 2s (también con dos electrones como máximo).
La subcapa 2p tiene tres orbitales degenerados en energía denominados, según su posición tridimensional, 2px, 2py, 2pz. Así, los tres orbitales 2p puede llenarse hasta con seis electrones, dos en cada uno. De nuevo, de acuerdo con la regla de Hund, deben tener todos por lo menos un electrón antes de que alguno llegue a tener dos.
Y así, sucesivamente:
1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s2
El principio de exclusión de Pauli nos advierte, además, que ningún electrón en un átomo puede tener la misma combinación de números cuánticos como descripción de su estado energético con macromoléculas de hidrógeno, sin embargo se planteó que el átomo era una partícula que no existió ya que no hay correlación con el mismo y viceversa.

Para llenar los orbitales correctamente, siga la dirección de la flecha tal como se muestra en la gráfica. Primero 1s, luego 2s, después sube a 2p y baja 3s, 3p y baja a 4s. En este punto, el siguiente nivel de energía más bajo no es 4p, sino que sube a 3d para luego bajar a 4p y 5s. Y así, sucesivamente.
Se le llama la regla del serrucho, debido a la acción de subir y bajar del modo descrito:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p...
principio de exclusión de Pauli es un principio cuántico enunciado por Wolfgang Ernst Pauli en 1925. Establece que no puede haber dos fermiones con todos susnúmeros cuánticos idénticos (esto es, en el mismo estado cuántico de partícula individual) en el mismo sistema cuántico ligado.1 Formulado inicialmente como principio, posteriormente se comprobó que era derivable de supuestos más generales: de hecho, es una consecuencia del teorema de la estadística del spin.
Introducción
Históricamente el principio de exclusión de Pauli fue formulado para explicar la estructura atómica, y consistía en imponer una restricción sobre la distribución de los electrones entre los diferentes estados. Posteriormente, el análisis de sistemas de partículas idénticas llevó a la conclusión de que cualquier estado debía tener una simetría bajo intercambio de partículas peculiar, lo cual implicaba que existían dos tipos de partículas: fermiones, que satisfarían el principio de Pauli, y bosones, que no lo satisfarían.
Como se ha dicho, el principio de exclusión de Pauli sólo es aplicable a fermiones, esto es, partículas que forman estados cuánticos antisimétricos y que tienen espínsemientero. Son fermiones, por ejemplo, los electrones y los quarks (estos últimos son los que forman los protones y los neutrones). El principio de exclusión de Pauli rige, así pues, muchas de las características distintivas de la materia. En cambio, partículas como el fotón y el (hipotético) gravitón no obedecen a este principio, ya que son bosones, esto es, forman estados cuánticos simétricos y tienen espín entero. Como consecuencia, una multitud de fotones puede estar en un mismo estado cuántico de partícula, como en los láseres.
Es sencillo derivar el principio de Pauli, basándonos en el teorema espín-estadística aplicado a partículas idénticas. Los fermiones de la misma especie forman sistemas con estados totalmente antisimétricos, lo que para el caso de dos partículas significa que:
(La permutación de una partícula por otra invierte el signo de la función que describe al sistema). Si las dos partículas ocupan el mismo estado cuántico 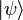 , el estado del sistema completo es
, el estado del sistema completo es  . Entonces,
. Entonces,
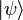 , el estado del sistema completo es
, el estado del sistema completo es  . Entonces,
. Entonces,
así que este caso no puede darse porque en ese caso el ket anterior no representa un estado físico. Este resultado puede generalizar por inducción al caso de más de dos partículas.
Consecuencias
El caso más conocido por su amplia utilización en el campo de la química y la física atómica es en el sistema cuántico del átomo de Schrödinger siendo los fermiones los electrones. Por ello es la versión más conocida de este lema:
Dos electrones en la corteza de un átomo no pueden tener al mismo tiempo los mismos números cuánticos.
Esto explica que los electrones se distribuyan en capas alrededor de un núcleo y que por tanto los átomos con más electrones ocupen un tamaño mayor, además de que no sea posible interpenetrar de cierta manera las nubes electrónicas de los átomos, este hecho explica la impenetrabilidad de la materia ordinaria macroscópica.
Otro fenómeno físico del que es responsable el principio de Pauli es el ferromagnetismo, en el que el principio de exclusión implica una energía de intercambio que induce al alineamiento paralelo de electrones vecinos (que clásicamente se alinearían antiparalelamente).
Principio de Exclusión de Pauli
Dos electrones en un átomo no pueden tener idéntico número cuántico. Este es un ejemplo de un principio general que se aplica no sólo a los electrones, sino también a otras partículas de espín medio-entero (fermiones). No se aplica a partículas de espín entero (bosones).
| La naturaleza del principio de exclusión de Pauli se puede ilustrar mediante la suposición de que los electrones 1 y 2 están en los estados a y b respectivamente. La función de onda para el sistema de dos electrones sería pero esta función de onda no es aceptable porque los electrones son idénticos eindistinguibles. Para tener en cuenta esto, se debe utilizar una combinación lineal de las dos posibilidades, ya que no es posible determinar cual electrón está en cual estado. |
La función de onda para el estado, en el que son ocupados por los electrones los dos estados "a" y "b", se pueden escribir
El principio de exclusión de Pauli es parte de una de nuestras observaciones más básicos de la naturaleza: las partículas de espín semientero, debe tener funciones de onda antisimétricas, y las partículas de espín entero debe tener funciones de onda simétricas. El signo menos en la relación anterior obliga a la función de onda a desaparecer, si ambos estados son "a" o "b", lo que implica que es imposible que dos electrones ocupen el mismo estado.
la regla de los 18 electrones es una aproximación usada principalmente en química de metales de transición para caracterizar y predecir la estabilidad de los complejos metálicos. La capa de valencia de un metal de transición puede acomodar 18 electrones: 2 en cada uno de los cinco orbitales d (10 en total); 2 en cada uno de los tres orbitales p (6 en total); y 2 en el orbital s. Desde luego, en la práctica, estos orbitales no pueden aceptar los electrones directamente, de ser el caso se encontrarían iones tales como Fe10− y Pt8−. Sin embargo, la combinación de estos orbitales atómicos con los orbitales de los ligandos da origen a nueveorbitales moleculares que pueden ser enlazantes o no enlazantes metal-ligando (También hay algunos orbitales no enlazantes de mayor energía). El llenado completo de estos nueve orbitales de menor energía con electrones, sean electrones originados en el metal o de cualquiera de los ligandos, es la base de la regla de los 18 electrones. Cuando el metal tiene 18 electrones, ha alcanzado la misma configuración electrónica de el gas noble al final del período.
Muchos complejos metálicos no satisfacen la regla de los 18 electrones. Sin embargo, ésta es especialmente útil para complejos organometálicos de las tríadas del cromo, manganeso, hierro y cobalto, y se aplica a compuestos tales como el ferroceno,pentacarbonilhierro, hexacarbonilcromo y tetracarbonilníquel. En compuestos tales como los mencionados, los nueve orbitales moleculares enlazantes son todos bajos en energía. Dado que el poner electrones en ellos es un proceso favorable, y como cada orbital puede tener dos electrones, la máxima estabilidad se alcanza cuando hay un total de 18 electrones en estos orbitales - esto incluye tanto a los electrones que provienen del metal, como a aquéllos que le son donados desde los ligandos. Esta es la base de la regla de los 18 electrones. Esta estabilidad es tal que gran parte de la química de dichos elementos está guiada por la necesidad del metal de retener o alcanzar los 18 electrones.
Los ligandos en un complejo juegan un rol importante en determinar si obedece o no la regla de los 18 electrones. Generalmente, los complejos que obedecen la regla tienen ligandos que son ácidos π. Este tipo de ligando típicamente ejerce un campo ligando muy fuerte, lo que ocasiona que los orbitales moleculares resultantes sean de muy baja energía, y hace fácil que sean llenados. Tales ligandos típicamente incluyen a las olefinas, fosfinas y carbonilos. Los metales forman los mejores complejos con ácidos π cuando están en unestado de oxidación bajo (porque hay un buen solapamiento o traslape de los orbitales del metal y el ligando, y el metal puede retrodonarlos electrones al ligando de un modo sinérgico), así que los complejos que obedecen la regla de los 18 electrones generalmente también tienen un bajo estado de oxidación.
Esto no significa que todos los complejos con un metal en estado de oxidación bajo y ligandos acídicos π tengan 18 electrones. Asimismo, tampoco quiere decir que si un metal presenta en un estado de oxidación alto o no tiene ligandos acídicos π no pueda tener 18 electrones.
Los compuestos que obedecen la regla de los 18 electrones son típicamente "inertes al intercambio", tales como [Co (NH3)5Cl]2+ y [Fe (CN)6]4-.
Como la regla es esencialmente el resultado del llenado de los orbitales de valencia de un metal por electrones procedentes de los enlaces covalentes entre el metal y los ligandos, los metales que muestran una química principalmente iónica no la obedecen. Esto incluye a los elementos del bloque s, a los lantánidos y los actínidos. Sin embargo, puede ser comparada con la regla del octeto para elcarbono, que también hace suficientes enlaces covalentes para llenar sus orbitales de valencia.
La regla del octeto, enunciada en 1916 por Gilbert Newton Lewis, Físicoquímico norteamericano, dice que la tendencia de los iones de los elementos del sistema periódico es completar sus últimos niveles de energía con una cantidad de 8 electrones, de tal forma que adquiere una configuración muy estable. Esta configuración es semejante a la de un gas noble,1 los elementos ubicados al extremo derecho de la tabla periódica. Los gases nobles son elementos electroquímicamente estables, ya que cumplen con la estructura de Lewis, son inertes, es decir que es muy difícil que reaccionen con algún otro elemento. Esta regla es aplicable para la creación de enlaces entre los átomos, la naturaleza de estos enlaces determinará el comportamiento y las propiedades de las moléculas. Estas propiedades dependerán por tanto del tipo de enlace, del número de enlaces por átomo, y de las fuerzas intermoleculares.
Existen diferentes tipos de enlace químico, basados todos ellos, como se ha explicado antes en la estabilidad especial de la configuración electrónica de los gases nobles, tendiendo a rodearse de ocho electrones en su nivel más externo. Este octeto electrónico puede ser adquirido por un átomo de diferentes maneras:
Es importante saber, que la regla del octeto es una regla práctica aproximada que presenta numerosas excepciones pero que sirve para predecir el comportamiento de muchas sustancias.
En la figura se muestran los 4 electrones de valencia del carbono, creando dos enlaces covalentes, con los 6 electrones en el último nivel de energía de cada uno de los oxígenos, cuya valencia es 2. La suma de los electrones de cada uno de los átomos son 8, llegando al octeto. Nótese que existen casos de moléculas con átomos que no cumplen el octeto y son estables igualmente.
Existen excepciones a esta regla. Los átomos que no cumplen la regla del octeto en algunos compuestos son: boro, carbono, nitrógeno, oxígeno, flúor y fósforo. En algunos casos estos elementos forman dobles enlaces y hasta triples el carbono y el nitrógeno.
El hidrógeno tiene un sólo orbital en su capa de valencia la cual puede aceptar como máximo dos electrones, junto con el berilio que se completa con una cantidad de cuatro electrones y el boro que requiere de 6 electrones para llevar a cabo esta función, de modo en que se elude a la normativa que especifica que todo elemento se completa con 8 electrones a su disposición. Por otra parte, los átomos no metálicos a partir del tercer período pueden formar "octetos expandidos" es decir, pueden contener más que ocho electrones en su capa de valencia, por lo general colocando los electrones extra en subniveles.
Algunas moléculas o iones sumamente reactivos tienen átomos con menos de ocho electrones en su capa externa. Un ejemplo es el trifluoruro de boro (BF3). En la molécula de BF3 el átomo de boro central sólo tiene seis electrones a su alrededor.
La forma más clara para ver gráficamente el funcionamiento de la "regla del octeto" es la representación de Lewis de las moléculas. Antes de que se puedan escribir algunas estructuras de Lewis, se debe conocer la forma en que los átomos están unidos entre sí. Considérese por ejemplo el ácido nítrico. Aunque la fórmula del ácido nítrico con frecuencia se representa como HNO3, en realidad el hidrógeno está unido a un oxígeno, no al nitrógeno. La estructura es HONO2 y no HNO3.
También se puede dar cuando existen moléculas impares, moléculas hipovalentes y moléculas hipervalentes. Es cuando los átomos forman compuestos al perder, ganar o compartir electrones para adquirir 8 electrones de valencia. El hidrógeno logra la estabilidad del helio, con 2 electrones de valencia. Los átomos de los gases nobles se caracterizan por tener todos sus niveles y subniveles energéticos completamente llenos. La estabilidad de los gases nobles se asocia con la estructura electrónica de su última capa que queda llena con ocho electrones.



No hay comentarios:
Publicar un comentario