Configuración electrónica
Los compuestos químicos son eléctricamente neutros, excepto los iones cuando los consideramos separadamente. Es decir, la carga que aporten todos los átomos de un compuesto tiene que ser globalmente nula, debemos tener en un compuesto tantas cargas positivas como negativas. Respecto a los iones, se dice que quedan con carga residual.
En química, el estado de oxidación (EO) es indicador del grado de oxidación de un átomo que forma parte de un compuesto u otra especie química. Formalmente, es la carga eléctrica hipotética que el átomo tendría si todos sus enlaces o elementos distintos fueran 100% iónicos. El EO es representado por números, los cuales pueden ser positivos, negativos o cero. En algunos casos, el estado de oxidación promedio de un elemento es una fracción, tal como +8/3 para el hierro en la magnetita (Fe3O4). El mayor EO conocido es +8 para los tetroxidos de rutenio, xenón, osmio, iridio, hassio y algunos complejos de plutonios, mientras que el menor EO conocido es -4 para algunos elementos del grupo del carbono (elementos del grupo 14).
La oxidación se da cuando un elemento o compuesto pierde uno o más electrones. Generalmente, cuando una sustancia se oxida (pierde electrones), otra sustancia recibe o capta dichos electrones reduciéndose. Este es el mecanismo básico que promueve las reacciones de óxido-reducción o redox.
Un átomo tiende a obedecer la regla del octeto para así tener una configuración electrónica igual a la de los gases nobles, los cuales son muy estables eléctricamente. Dicha regla sostiene que un átomo tiende a tener ocho electrones en su nivel de energía más externo. En el caso del hidrógeno este tiende a tener 2 electrones, lo cual proporciona la misma configuración electrónica que la del helio.
Cuando un átomo A necesita, por ejemplo, 3 electrones para obedecer la regla del octeto, entonces dicho átomo tiene un número de oxidación de -3. Por otro lado, cuando un átomo B tiene los 3 electrones que deben ser cedidos para que el átomo A cumpla la ley del octeto, entonces este átomo tiene un número de oxidación de 3+. En este ejemplo podemos deducir que los átomos A y B pueden unirse para formar un compuesto, y que esto depende de las interacciones entre ellos. La regla del octeto y del dueto pueden ser satisfechas compartiendo electrones (formando moléculas) o cediendo y adquiriendo electrones (formando compuestos de iones).
Los elementos químicos se dividen en 3 grandes grupos, clasificados por el tipo de carga eléctrica que adquieren al participar en una reacción química:
- Metales
- No metales
- Gases nobles
Existen elementos metálicos que, dependiendo de las condiciones a que sean sometidos, pueden funcionar como metales o no metales indistintamente. A estos elementos se les denomina metaloides.
Los elementos metálicos (los cuales ceden electrones) cuando forman compuestos tienen únicamente estados de oxidación positivos. Los elementos no metálicos y semimetálicos, en cambio, pueden tener estado de oxidación positivos y negativos, dependiendo del compuesto que estén constituyendo.
Enlace iónico. Un átomo dona electrones a otra especie, y al tener cargas opuestas se atraen mutuamente.
Ejemplos
- Cloruro de sodio
2Na0 + Cl02 → 2Na+1 + 2Cl-1-H2O
Los gases de un solo tipo de elemento, en este caso el cloro, están presentes en forma diatómica.
El sodio (Na) se combina con el cloro (Cl), produciendo cloruro de sodio. El número de oxidación de ambos elementos sin combinar es 0 (cero), ya que están equilibrados eléctricamente. El número de oxidación del sodio combinado es +1, ya que cede un electrón. El número de oxidación del cloro combinado es -1, ya que acepta el electrón cedido por el sodio.
- Oxido de aluminio
Al0 + O02 → Al3+ + 2O2−
El oxígeno (O) está presente en forma diatómica (gas).
El aluminio (Al) se combina con el oxígeno (O), produciendo óxido de aluminio (Al2O3). El número de oxidación de ambos elementos sin combinar es 0 (cero), ya que están equilibrados eléctricamente. El número de oxidación del aluminio combinado es 3+, ya que cede tres electrones. El número de oxidación del oxígeno combinado es 2−, ya que acepta hasta 2 electrones.
Los electrones cedidos y aceptados por los distintos elementos crean un problema con las cargas eléctricas. Por ejemplo, el aluminio cede tres electrones y el oxígeno sólo acepta dos, por lo que sobra uno. De esto se concluye que en la reacción no interviene un solo átomo de oxígeno, por lo que se procede a balancear la ecuación, para que coincidan todos los electrones transferidos con las capacidades de cada elemento aceptor.
La ecuación balanceada queda así:
4Al0 + 3O02 → 4Al3+ + 6O2− → 2Al3+ + 3O2−
Con lo que se logra el balance perfecto para que se acomoden todos los electrones excedentes. Los elementos de un elemento libre o en estado basal tienen un número de oxidación igual a 0.
- Todos los elementos metálicos (los cuales ceden electrones) cuando forman compuestos tienen generalmente estados de oxidación positivos.
- Los elementos no metálicos y semimetálicos pueden tener estados de oxidación positivos y negativos, dependiendo del compuesto que estén constituyendo.
- Para cualquier elemento el máximo estados de oxidación es el correspondiente al número de grupo.
- El mínimo estado de oxidación posible de un elemento es 4−, y lo tienen algunos de los elementos del grupo 4A.
- Los no metales tienen un estado de oxidación negativo único, que es igual al número de grupo menos 8.
- Los elementos de los grupos 1A y 2A poseen los estados de oxidación 1+ y 2+ respectivamente
- El hidrógeno funciona con estado de oxidación 1+ generalmente, a excepción cuando forma hidruros metálicos en donde su estado de oxidación es 1−.
- El número de oxidación del O es 2−, excepto cuando forma peróxidos, donde es 1−, y cuando forma superóxidos, donde es 1/2−.
- La suma de los estados de oxidación de los elementos de un compuesto es igual a su carga neta.
Reglas para asignar estados de oxidación
- El estado de oxidación de todos los elementos en estado libre, no combinados con otros, es de cero (p. ej., Na, Cu, Mg, H2, O2, Cl2, N2).
- El estado de oxidación del H es de +1, excepto en los hidruros metálicos, en los que es de -1 (p. ej., NaH, CaH2).
- El estado de oxidación del O es de -2, excepto en los peróxidos, en los que es de -1, en los superóxidos que es -1/2 y en el OF2, donde es de +2.
- El estado de oxidación del elemento metálico de un compuesto iónico es positivo.
- En los compuestos covalentes, el número de oxidación negativo se asigna al átomo más electronegativo y todos los demás son positivos.
- La suma algebraica de los estados de oxidación de los elementos de un compuesto es cero.
- La suma algebraica de los estados de oxidación de los elementos de un ion poliatómico es igual a la carga del ion.
Estado de oxidación y valencia
19 abril, 2010 — Aida Ivars
Para que lo tengáis por escrito (por petición de Hao), con este artículo os recuerdo la diferencia entre los conceptos “estado de oxidación” y “valencia” de un elemento en un compuesto químico.
El número de oxidación se define como la carga eléctrica “formal” (puede que no sea real) que se asigna a un átomo de un elemento en un compuesto, y por lo tanto el número de oxidación podrá ser un número positivo o negativo. Recordad que, en general, el número de oxidación no representa la carga eléctrica real de un átomo en un compuesto, ya que todos los compuestos no están formados por iones. Por ejemplo, en el monóxido de nitrógeno (NO) y en el monóxido de calcio (CaO) el número de oxidación del oxígeno es –2 en ambos compuestos; pero en el NO no existe una carga real de –2 en el átomo de oxígeno, ni de +2 en el de nitrógeno, pues se trata de un compuesto covalente (débilmente polar). En cambio, en CaO sí que hay cargas reales, porque es un compuesto iónico.
El número de oxidación se define como la carga eléctrica “formal” (puede que no sea real) que se asigna a un átomo de un elemento en un compuesto, y por lo tanto el número de oxidación podrá ser un número positivo o negativo. Recordad que, en general, el número de oxidación no representa la carga eléctrica real de un átomo en un compuesto, ya que todos los compuestos no están formados por iones. Por ejemplo, en el monóxido de nitrógeno (NO) y en el monóxido de calcio (CaO) el número de oxidación del oxígeno es –2 en ambos compuestos; pero en el NO no existe una carga real de –2 en el átomo de oxígeno, ni de +2 en el de nitrógeno, pues se trata de un compuesto covalente (débilmente polar). En cambio, en CaO sí que hay cargas reales, porque es un compuesto iónico.
La definición de valencia de un elemento en un compuesto (más extendida) es el número de átomos de hidrógeno que se combinan con un átomo de dicho elemento, y por lo tanto la valencia es siempre un número natural. También es el número de electrones perdidos o ganados por el elemento (valencia iónica) o el número de electrones compartidos (valencia covalente) por el elemento en un compuesto.
El concepto de valencia resulta útil en la formulación de compuestos binarios, mientras que el número de oxidación lo es en compuestos de
tres o más elementos.
tres o más elementos.
Para acabar de entender la diferencia entre número de oxidación y valencia, os puse como ejemplo cuatro compuestos de carbono:
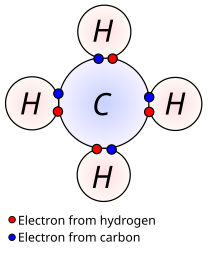
CH4-> C: -4, H: +1
CH3Cl-> C: -2, H: +1, Cl -1
CH2Cl2-> C: 0, H: +1, Cl -1
CCl4-> C: +4, Cl -1
CH3Cl-> C: -2, H: +1, Cl -1
CH2Cl2-> C: 0, H: +1, Cl -1
CCl4-> C: +4, Cl -1
En todos ellos el carbono presenta invariablemente su valencia de 4 (en las moléculas de estos cuatro compuestos, el átomo de carbono se combina con otros cuatro átomos). Sin embargo, el número de oxidación del carbono es distinto en cada compuesto (como se indica a la derecha de cada compuesto). En todos ellos, el hidrógeno tiene estado de oxidación +1, y el cloro -1, por lo que para que la molécula sea neutra, el carbono tiene distintos estados de oxidación (-4, -2, 0 y +2 respectivamente)
La excitación es una elevación en el nivel de energía de un sistema físico, por encima de un estado de energía de referencia arbitrario, llamado estado fundamental. En física hay una definición técnica específica para el nivel de energía que se asocia a menudo con un átomo que está siendo excitado a un estado excitado de mayor energía.
En mecánica cuántica un estado excitado de un sistema (como un electrón, núcleo atómico, átomo, o molécula) es cualquierestado cuántico del sistema que goza de una mayor energía que el estado fundamental (es decir, más energía que el mínimo absoluto).1 La temperatura de un grupo de partículas es indicativa del nivel de excitación.
La vida útil de un sistema en un estado excitado suele ser corta: la emisión espontánea o inducida de un cuanto de energía (como un fotón o un fonón) por lo general ocurre poco después de que el sistema haya sido promovido al estado excitado, volviendo el sistema a un estado con una energía más baja (un estado menos excitado o el estado fundamental). Este retorno a un nivel de energía es, a menudo imprecisamente llamado decaimiento y es el inverso de la excitación.
Los estados excitados de vida media larga se llaman a menudo metaestables. Los isómeros nucleares de vida media larga, y eloxígeno singlete son dos ejemplos de esto.
Excitación atómica
Un ejemplo sencillo de excitación atómica es la se encuentra en el átomo de hidrógeno, en particular en el estado de su único electrón. Un electrón en un átomo de hidrógeno puede tener diversos estados energéticos, tal como predice adecudamente el Modelo atómico de Schrödinger, el estado de más baja energía es el llamado estado fundamental.
El estado fundamental del átomo de hidrógeno corresponde a tener el único electrón del átomo en la órbita o nivel de energía más bajo posible, (es decir, la función de onda "1s", que presenta simetría esférica, y que tiene los números cuánticos más bajos posibles). Al dar una energía adicional al átomo (por ejemplo, por la absorción de un fotón de una energía adecuada, o por calentamiento a alta temperatura, o por excitación eléctrica dentro de un campo eléctrico), el electrón es capaz de moverse a un estado excitado (un estado con uno o más números cuánticos mayores que el mínimo posible). Si el fotón tiene demasiada energía, el electrón deja de estar vinculado al átomo, escapará del átomo, y el átomo quedará convertido en un ion positivo o catión, es decir, el átomo se ionizará.
Empírcamente se observa que después de la excitación, el átomo pasa a un estado excitado inferior, o al estado fundamental, emitiendo un fotón con una energía característica, igual a la diferencia de energía entre los niveles de salida y llegada. Esto se da porque realmente todos los estados excitados de hecho son estados metaestables siendo el único estado verdaderamente estable el estado fundamental. El paso a un nivel de energía inferior va a compañado de la emisión de fotones por átomos en diferentes estados excitados conduce a un espectro electromagnético que muestra una serie de características líneas de emisión (tenemos, en el caso del átomo de hidrógeno, la serie de Lyman, serie de Balmer, serie de Paschen, serie de Brackett y serie de Pfund.) Ni la mecánica cuántica ordinaria, ni el modelo atómico de Schrödinger explicaban porque los estados excitados no eran indefinidamente estables. Con el desarrollo de la electrodinámica cuántica se comprobó que la posbilidad de que existieran fluctuaciones del campo electromagnético hacía que el hamiltoniano del sistema formado por el átomo y su posible interacción cuántica con el campo electromagnético fluctuante del vacío, hacía que los estados excitados de hecho no fueran propiamente estados estacionarios y por tanto, sólo eran estados metaestables que acababan decayendo.
Un átomo en un estado excitado de muy alta energía se denomina átomo de Rydberg.2 Un sistema de átomos altamente excitados puede formar un estado excitado condensado de vida media larga, por ejemplo, una fase condensada compuesta completamente de átomos altamente excitados: la materia de Rydberg.
Así pues un átomo o cualquier otro sistema puede excitarse por absorción de fotones de una frecuencia característica, o también mediante el calor o la electricidad.
Excitación de un gas perturbado
Un conjunto de moléculas que forman un gas se puede considerar en un estado excitado, si una o más moléculas se elevan a niveles de energía cinética tales que la distribución de velocidades resultante se aleje del equilibrio de la distribución de Boltzmann. Este fenómeno ha sido estudiado en el caso de un gas bidimensional con cierto detalle, analizando el tiempo necesario para relajarse hasta el equilibrio.

No hay comentarios:
Publicar un comentario