Configuración electrónica
Una capa electrónica, capa de electrones o cubierta de electrones puede pensarse como el conjunto de órbitas seguidas por un grupo de electrones alrededor del núcleo de un átomo. Cada capa puede contener un cierto número máximo de electrones, y está asociada con un particular rango de energía en función de su distancia al núcleo. En un átomo estable, para que una cierta capa pueda contener electrones, es necesario que todas las interiores a ella estén completamente ocupadas. Los electrones en la capa poblada más externa, llamada capa de valencia y que es la única que puede encontrarse parcialmente vacía, determinan laspropiedades químicas del átomo.
Simbología
Las capas electrónicas son numeradas correlativamente, partiendo de la más cercana al núcleo, y se identifican mediante letras:
- Capa K, n = 1, es la más interior, presente en todos los elementos químicos.
- Capa L , n = 2
- Capa M, n = 3
- Capa N, n = 4
- Capa O, n = 5
- Capa P, n = 6
- Capa Q, n = 7
Número de electrones
El número máximo de electrones que puede contener una capa n es 2n²(hasta la capa "N") y de la capa "O" a la "Q" va disminuyendo respectivamente a lo anterior mencionado.
- Número de electrones por capa
(1ª) Capa K hasta 2 electrones (2ª) Capa L hasta 8 electrones (3ª) Capa M hasta 18 electrones (4ª) Capa N hasta 32 electrones (5ª) Capa O hasta 50 electrones (6ª) Capa P hasta 72 electrones (7ª) Capa Q hasta un máximo de 98 electrones.
La cantidad de capas de un átomo depende de su número total de electrones. Los electrones se disponen con prioridad en la capa más cercana al núcleo hasta que ésta se satura (se alcanza su número máximo de electrones), los electrones restantes se colocan en la siguiente capa hasta que está saturada y así sucesivamente, hasta que ya no hay electrones. Por lo tanto, un átomo de hidrógeno, que tiene un electrón, sólo tiene una capa , la capa K que está parcialmente llena (un electrón de un máximo de dos). En un átomo de helio, que tiene dos electrones, ambos se distribuyen en la capa K que queda completamente llena (dos electrones de un máximo de dos). Por lo tanto, el átomo de litio, que tiene tres electrones, tiene una capa K saturada (con los dos primeros electrones), y una capa L que contiene el tercer electrón.
Se dice que una capa está saturada si contiene su número máximo de electrones. El hidrógeno es el único elemento que no posee su capa K saturada.
Historia
La existencia de capas de electrones fue observada por primera vez en el rayo X de Charles Barkla y Henry Moseley. Barkla las llamo con las letras K, L, M, N, O, P, yQ. El origen de esta terminología fue alfabético. Una capa J fue sospechada, pero otros experimentos indicaron que las líneas de absorción de K eran producidas por la primera capa de electrones.
El nombre de las capas de electrones se deriva del modelo de Bohr, en el cual se pensaba que los grupos de electrones orbitaban el núcleo a ciertas distancias, así que sus órbitas formaban capas alrededor de los núcleos.
El fisicoquímico Gilbert Lewis fue responsable del desarrollo temprano de la teoría de la participación de los electrones de la capa de valencia en los enlaces químicos.Linus Pauling después generalizo y expandió la teoría al aplicar nociones de la mecánica estructural.
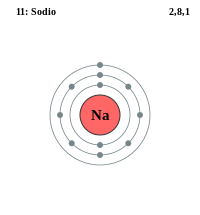
Ejemplo
El sodio tiene once electrones. Su estructura electrónica es la siguiente:(K)2 (L)8 (M)1. Las capas K y L están saturadas.
El número máximo de electrones permitidos en cada capa no es cualquiera. Según el principio de Pauli, es igual a 2n² para la nésimacapa. Se completará con 2 electrones en la capa K, 8 en la capa L, 18 en la M, etc. En resumen:(K)2(L)8(M)18(N)32(O)50(P)72 ...
Este modelo de llenado de las capas electrónicas ha sido cuestionado por la física cuántica con un modelo más complejo, pero que parece más próximo a la realidad a escala atómica: además de las capas, debe tenerse en cuenta la existencia de subcapas electrónicas denominadas s, p, d, f, g, y que tienen sus propios números máximos de electrones para estar saturadas.
Las cosas se complican desde el átomo de potasio (Z = 19): El 19e electrón se coloca en la capa de N, mientras que la capa M no está saturada (puede contener 18 electrones, a pesar de que sólo contiene 8).
Así, para el átomo de potasio, tenemos:(K)2(L)8(M)8(N)1 en lugar de (K)2(L)8(M)9.
Lo mismo ocurre con el átomo de calcio (Z = 20), pero para los átomos con un número atómico entre el 20 y 30, los 20ésimos a 30ésimos electrones se colocan en la capa M, que terminan de llenar antes de llenar la capa N.
- Ejemplos:
Estructura Electrónica y Tabla Periódica
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sabiendo que los átomos no son indivisibles sino que están formados por partículas subatómicas con cargas eléctricas y masas características, y con nuevos experimentos que evidenciaban que en los átomos había concentraciones de masa y grandes espacios vacíos, el físico neozelandés ErnestRutherford (1871-1937), y el científico danés Henrik David Niels Bohr (1885-1962), propusieron, a principios del presente siglo, los llamados modelos planetarios o nucleares para los átomos.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ernest Rutherford
|
Henrik David Niels Bohr
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
En estos modelos se plantean como puntos fundamentales que los átomos tienen una parte central llamada núcleo en la que reside la casi totalidad de la masa del átomo. El núcleo está cargado positivamente es decir, los protones están en el núcleo del átomo. Los electrones giran alrededor del núcleo.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
En el modelo de Bohr los electrones se acomodan en capas alrededor del núcleo. Cada capa tiene una energía distinta, los electrones sólo pueden tener la energía correspondiente a la capa en que se encuentran y ninguna otra. Por esta razón, a las capas de Bohr se les llama también niveles de energía.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Al hecho de que los electrones no puedan tomar cualquier valor de energía se le conoce comocuantización de la energía; a la vez se dice que la energía de los electrones en los átomos está cuantizada.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El modelo atómico de Bohr es por tanto un modelo cuántico.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Conviene en este punto hacer la observación de que las energías de los electrones en los átomos son siempre negativas, o sea se encuentran por debajo del cero de energías. Esto es así debido a una convención en Electrostática que establece que las energías de atracción (unión) son negativas. Las cargas de diferente signo se atraen (como es el caso de los electrones cargados negativamente y el núcleo atómico cargado positivamente) por lo tanto las energías son negativas. Si las partículas tuvieran cargas del mismo signo se repelerían y el signo de la energía (siguiendo la misma convención) sería positivo.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Por lo tanto, el estado de menor energía de un átomo sería aquel en el que el valor de las energías de los electrones sumadas nos diera el valor más negativo.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Las capas de Bohr se denominan alfabéticamente a partir de la letra K empezando por la más interna (energía más negativa) y, de acuerdo con la teoría, no pueden contener cualquier número de electrones. Ver tabla 7.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tabla 7. Número máximo de electrones para algunas capas de Bohr.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Como se dijo anteriormente, los átomos son eléctricamente neutros; por lo que el número de protones debe ser igual al número de electrones; de esto se deduce que el Hidrógeno que tiene número atómico uno, tendría un solo electrón en la capa K y que el Oxígeno (Z=8) tendría 2 electrones en la capa K y 6 electrones en la capa L. En la tabla 8 se presenta la distribución electrónica para algunos átomos de acuerdo con el modelo de Bohr. Y en la figura 6, una representación esquemática de las capas de Bohr para algunos elementos.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tabla 8. Estructura de capas para algunos elementos de acuerdo con el modelo de Bohr.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Figura 6. Representación esquemática de las capas de Bohr.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Nótese que aunque se postula un número máximo de electrones para cada capa, no hay una regla clara para la distribución de los electrones en las mismas. Trataremos de subsanar este problema posteriormente. (Ver regla de las diagonales).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Arnold Sommerfeld (1868-1951)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Con la ley periódica en términos del número atómico y estas consideraciones se desarrolló la forma más usada y más conocida de la tabla periódica, la llamada Tabla Periódica Larga o Tabla de Bohr oTabla de Bohr y Sommerfeld (Figura 7).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Figura 7. Tabla periódica larga.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
En la figura 8 se puede observar que existe una clara relación entre la periodicidad y la estructura electrónica propuesta por Bohr: los elementos en la misma columna de la tabla periódica tienen el mismo número de electrones en la última capa.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Figura 8. Relación entre la estructura de capas y la periodicidad.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Una teoría cuántica de los átomos más moderna fue desarrollada, entre otros, por el físico vienésErwin Schrödinger (1887- 1961)[1]. Esta teoría sugiere que cada electrón en un átomo queda completamente descrito por un orbital es decir, se pueden saber todas las propiedades asociadas al electrón si se conoce el orbital que lo describe.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Erwin Schrödinger
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El orbital es una función matemática que depende de cuatro cantidades llamadas números cuánticos. De esta manera, resulta equivalente escribir la función matemática (orbital) o dar los valores de los cuatro números que la definen. Desde luego, resulta más sencillo dar cuatro números que escribir una función explícitamente.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Los números cuánticos no pueden tomar valores arbitrarios; se deben seguir reglas muy precisas para asignar estos valores y poder así describir al orbital.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El primer número cuántico se llama número cuántico principal, se acostumbra simbolizarlo con la letra n. Sólo puede tomar valores enteros positivos; es decir, 1, 2, 3, 4,...; etc.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El valor del segundo número cuántico (llamado número cuántico azimutal, que se representa con la letra l) depende de los valores que tome el número cuántico principal n. Así, si n toma el valor 1, el número cuántico azimutal l vale cero; si n=2, l puede valer 0 o 1; si n=3, l puede tomar los valores 0, 1 o 2. La regla general es que para un valor dado del número cuántico principal n, el número cuántico azimutal l puede tomar cualquier valor entero desde 0 hasta n-1.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Con lo anterior podemos deducir que si n toma el valor de 4, l podrá tomar los valores 0, 1, 2 y 3; dado que n-1 en este caso es 3 (4-1).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Así como el valor del número cuántico azimutal l depende del valor que haya tomado el número cuántico principal n (es decir, para poder dar un valor posible de l tenemos que saber de antemano que valor tomó n), el tercer número cuántico toma valores que dependen de los valores del número cuántico azimutal l.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El tercer número cuántico se conoce como número cuántico magnético y se representa como ml. Como hemos dicho, sus valores dependen del valor que haya tomado l. Así, si l=0, ml sólo puede tomar el valor de cero; pero si l=1, ml puede valer -1, 0 o +1. En general, ml toma valores enteros que van desde -l hasta +l pasando por el valor 0.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Entonces deducimos que si l toma el valor de 3, ml puede tomar cualquiera de los siguientes valores: -3, -2, -1, 0, +1, +2 y +3.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Los valores del cuarto número cuántico no dependen de los valores que hayan tomado los otros tres, este número solamente puede tomar alguno de los valores + 1/2 o - 1/2.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El cuarto número cuántico se conoce como número cuántico de espín y se acostumbra simbolizarlo como ms.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Las reglas anteriores para determinar los posibles valores de los números cuánticos se resumen en la tabla 9.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tabla 9. Valores que pueden tomar los números cuánticos.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Con las reglas de la tabla 9 en mente, podemos ver que el conjunto de valores [1,0,0,+ 1/2] representa a un orbital pues no viola ninguna de las reglas: el primer número correspondería al número cuántico principal n y es un entero positivo, el segundo correspondería al número cuántico azimutal l y es un entero que depende del valor de n y equivale a n-1, el tercer número corresponde al número cuántico magnético ml y es un número entero que depende de l; si recordamos que ml puede tomar valores de -l a +l, nos damos cuenta que si l=0 a ml no le queda mas remedio que valer también cero, como se establece en nuestro conjunto. Por último, el número cuántico de espín ms toma el valor + 1/2, que es uno de sus dos valores permitidos.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Otros conjuntos de valores permitidos podrían ser: [4,2,1,- 1/2] o [4,2,1,+ 1/2].
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sin embargo, el conjunto [2,2,2,+ 1/2] no puede representar a un orbital, dado que el segundo valor, que es el correspondiente a l, viola las reglas debido a que l puede valer desde 0 hasta n-1; pero nvale 2 en nuestro conjunto (ver el primer valor), por lo tanto, n-1 es igual a 2-1 = 1, o sea l podría valer 0 o 1; pero no 2.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
A los orbitales se les han puesto nombres que dependen de los valores que tomen n y l, que son quizá los números cuánticos más importantes pues se relacionan de manera mas directa que ml y ms con la energía de los electrones. Las reglas para nombrar a los orbitales son dos, una relacionada con el valor que tome l y la otra con el valor que toma n.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1. Si l=0, el orbital se llama s; si l=1 se llama p; si l=2 se llama d y si l=3 se llama f.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
2. El valor del número cuántico principal n se antepone al nombre del orbital.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Con lo anterior, si n=1 y l=0, el orbital se llama 1s. Debe notarse que si n=1, por fuerza l=0; pues ltoma valores desde 0 hasta n-1 y n-1 para este caso es cero. Por otra parte, si n=4 y l=2, el orbital se llama 4d.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Los átomos en general tienen varios electrones (salvo el Hidrógeno que tiene un solo electrón) y cada electrón debe quedar descrito por un orbital, es decir, a cada electrón le corresponde un conjunto de valores de los cuatro números cuánticos. Este conjunto de valores debe ser diferente para cada uno de los electrones en un átomo, o sea, no hay en un átomo dos electrones descritos por el mismo conjunto de números cuánticos (es decir, por el mismo orbital); los conjuntos de valores deben diferir por lo menos en el valor de ms.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
A la restricción descrita en el párrafo anterior se le conoce como Principio de Exclusión postulado en 1925 por el científico austriaco Wolfgang Pauli (1900-1958). El Principio de Exclusión reafirma la relación entre la mecánica cuántica y las propiedades observadas experimentalmente para los átomos, pues de cierta forma establece que en un átomo no hay dos electrones que tengan exactamente la misma energía lo que está de acuerdo con las observaciones.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Wolfgang Pauli
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Todas las consideraciones anteriores se resumen en la Tabla 10 para valores de n hasta n=3.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tabla 10. Valores posibles de los números cuánticos y número de electrones que pueden describir para cada valor de n. (Hasta n=3)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Con ayuda de la tabla anterior se puede deducir que el número de electrones que pueden describirse para un valor dado del número cuántico principal (n) es 2n2, esto coincide con el número de electrones en las capas de Bohr. Ya que para n=1 podríamos describir 2 electrones, que es el número máximo de electrones en la capa K para el modelo de Bohr. Para n=2, podríamos describir 8 electrones, que ahora es el número máximo de electrones para la capa L de Bohr; etc.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Dentro del esquema de Schrödinger se acostumbra describir un átomo por medio de la configuración electrónica de su estado fundamental o estado base. El estado fundamental o base es aquel en que el átomo toma el mínimo valor posible para su energía electrónica es decir, donde la suma de las energías individuales de cada uno de los electrones es un mínimo (como ya se ha mencionado, los valores de la energía para los electrones dependen de los números cuánticos n y l del orbital que los representa).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Para escribir la configuración electrónica del estado fundamental de un átomo, se debe respetar el llamado Principio de Construcción que establece que si se desea conocer la configuración electrónica del estado fundamental del elemento con número atómico Z, es necesario conocer la configuración electrónica del estado fundamental del elemento con número atómico Z-1 y asignar, al nuevo electrón, los valores de los números cuánticos correspondientes al estado de menor energía disponible.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Jaime Keller Torres
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
¿Cómo saber cuál es el estado de menor energía disponible? Como ya se ha mencionado, la energía de los orbitales en el modelo de Schrödinger depende de los valores de los números cuánticos n y l, en realidad, de n+l; y existe una regla nemotécnica para recordar la secuencia de energías llamada laRegla de las Diagonales, debida al científico mexicano Jaime Keller Torres (1936 - ), quien la propuso en 1955. Dicha regla consiste en lo siguiente, se ordenan los orbitales en columna en orden creciente de número cuántico principal n y en renglón en orden creciente de número cuántico azimutal l. Enseguida se trazan líneas diagonales de arriba hacia abajo y de derecha a izquierda que determinan el orden de energía de los orbitales como se aprecia en la figura 9.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Figura 9. La regla de las diagonales.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Con lo anterior, el orbital de menor energía de todos los átomos es el 1s, por lo que el elemento de número atómico 1 (Hidrógeno) debe tener su electrón descrito por dicho orbital. Por lo tanto, la configuración electrónica del estado fundamental para el Hidrógeno es 1s1, donde el superíndice indica que hay un electrón con espín +1/2. Para el Helio, cuyo número atómico es 2, debemos conocer la configuración electrónica del Hidrógeno (Z=1) y agregar el electrón en el orbital que nos dé la mínima energía, que en este caso es el mismo 1s (recordemos que el espín de este electrón debe ser -1/2) se acostumbra escribir la configuración electrónica en este caso como 1s2 (donde el superíndice indica que hay dos electrones, uno con espín +1/2 y otro con espín -1/2.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El Litio (Z=3), tendría una configuración 1s22s1, pues como se ve en la tabla 10, n=1 sólo puede describir dos electrones, por lo que el orbital de mínima energía disponible es ahora 2s, cuyo superíndice indica un electrón con espín +1/2. Si continuamos este procedimiento para los demás elementos obtendremos los resultados de la tabla 11.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tabla 11. Configuración Electrónica de algunos Elementos.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Naturalmente, también existe una relación entre las configuraciones electrónicas del estado fundamental de los elementos y la tabla periódica: los elementos que tienen la misma configuración electrónica para sus orbitales de más alta energía, están en la misma columna de la tabla periódica (Figura 10).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Figura 10. Configuración electrónica y tabla periódica.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Todo lo descrito líneas arriba nos hace ver que se tiene una teoría para explicar las propiedades de los elementos, pues recordemos que los elementos que tienen propiedades similares están en la misma columna de la tabla periódica. Dichos elementos tienen la misma configuración electrónica externa; por lo tanto, debe haber una correlación entre propiedades periódicas y configuraciones electrónicas, lo que será objeto de análisis en los siguientes capítulos.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
No hay comentarios:
Publicar un comentario