Configuración electrónica
Estructura electrónica de átomos confinados trata sobre el comportamiento de los electrones de un átomo que se encuentra restringido dentro de una región del espacio. Las configuraciones electrónicas que aprendemos desde nuestra educación básica se ven modificadas cuando los átomos se encuentran sometidos a confinamientos espaciales, los cuales no permiten el libre movimiento de los electrones y consecuentemente su arreglo dentro del átomo se ve afectado. Mientras el confinamiento espacial de átomos es bien reconocido, su estudio no es nada sencillo ya que el interés se centra en estudiar los electrones del átomo y por lo tanto una mezcla con electrones del medio, que impone el confinamiento, no es deseado. Por lo tanto, existen modelos para simular el medio de confinamiento y estudiar exclusivamente los electrones asociados al átomo de interés.
Ecuación de Schrödinger de átomos confinados
Naturalmente, como se está interesado en la estructura electrónica de un átomo entonces es necesario recurrir a la ecuación de Schrödinger
donde el operador hamiltoniano, en unidades atómicas, tiene la forma
En esta ecuación, N representa el número de electrones, Z el número atómico del átomo. Se está suponiendo que el núcleo del átomo está centrado en el origen de coordenadas. La distancia entre cada par de electrones está representada por rij. El confinamiento está representado por el potencial 

El átomo de hidrógeno como sistema de referencia
El átomo de hidrógeno confinado espacialmente fue el primer sistema donde la ecuación de Schrödinger fue aplicada. La idea del confinamiento fue simular altas presiones sobre este átomo ya que se piensa que es un sistema que puede exhibir metalización en condiciones extremas. Así la ecuación de Schrödinger toma la forma
Los primeros intentos para simular al átomo de hidrógeno bajo altas presiones consideró al potencial  como una esfera, donde está centrado el átomo, y cuyas paredes tienen un potencial infinito.1 ,2 ,3 ,4 Naturalmente, lo que encontraron estos estudios fue una estructura electrónica totalmente diferente a lo encontrado para el átomo libre. En particular, se encontraron cruces entre las energías orbitales a medida que el radio de confinamiento se ve reducido, en otras palabras, a medida de que el átomo de hidrógeno es confinado sus niveles de energía se ven modificados. Jorge Garza, Rubicelia Vargas y Kalidas D. Sen diseñaron una aplicación didáctica para observar los cambios en las energías orbitales cuando el radio de la esfera del confinamiento se ve modificada.5
como una esfera, donde está centrado el átomo, y cuyas paredes tienen un potencial infinito.1 ,2 ,3 ,4 Naturalmente, lo que encontraron estos estudios fue una estructura electrónica totalmente diferente a lo encontrado para el átomo libre. En particular, se encontraron cruces entre las energías orbitales a medida que el radio de confinamiento se ve reducido, en otras palabras, a medida de que el átomo de hidrógeno es confinado sus niveles de energía se ven modificados. Jorge Garza, Rubicelia Vargas y Kalidas D. Sen diseñaron una aplicación didáctica para observar los cambios en las energías orbitales cuando el radio de la esfera del confinamiento se ve modificada.5
 como una esfera, donde está centrado el átomo, y cuyas paredes tienen un potencial infinito.1 ,2 ,3 ,4 Naturalmente, lo que encontraron estos estudios fue una estructura electrónica totalmente diferente a lo encontrado para el átomo libre. En particular, se encontraron cruces entre las energías orbitales a medida que el radio de confinamiento se ve reducido, en otras palabras, a medida de que el átomo de hidrógeno es confinado sus niveles de energía se ven modificados. Jorge Garza, Rubicelia Vargas y Kalidas D. Sen diseñaron una aplicación didáctica para observar los cambios en las energías orbitales cuando el radio de la esfera del confinamiento se ve modificada.5
como una esfera, donde está centrado el átomo, y cuyas paredes tienen un potencial infinito.1 ,2 ,3 ,4 Naturalmente, lo que encontraron estos estudios fue una estructura electrónica totalmente diferente a lo encontrado para el átomo libre. En particular, se encontraron cruces entre las energías orbitales a medida que el radio de confinamiento se ve reducido, en otras palabras, a medida de que el átomo de hidrógeno es confinado sus niveles de energía se ven modificados. Jorge Garza, Rubicelia Vargas y Kalidas D. Sen diseñaron una aplicación didáctica para observar los cambios en las energías orbitales cuando el radio de la esfera del confinamiento se ve modificada.5Átomos multielectrónicos
El caso de átomos con más de un electrón es realmente complicado por que aparece lo que se conoce como problema de muchos cuerpos, el cual no ha sido resuelto de manera analítica en la mecánica cuántica, incluso en la mecánica clásica. Por este motivo se han dado muchas aproximaciones para estudiar la estructura electrónica de átomos confinados.
El átomo de helio confinado como caballo de batalla
El hamiltoniano del átomo de helio tiene la forma
Aún cuando es un sistema que consta de dos electrones, es un sistema atractivo para generar varias aproximaciones a la función de onda por que ya tiene explícitamente la interacción electrón-electrón.
El confinamiento por paredes impenetrables es uno de los confinamientos más comúnes impuestos sobre el átomo de helio. Este confinamiento impone una restricción sobre la función de onda ya que se debe de cancelar sobre la superficie de la esfera. Para encontrar la densidad electrónica de este sistema, se han utilizado técnicas basadas en la función de onda 6 ,7 y en la teoría de funcionales de la densidad 8 . El átomo de helio confinado ha servido como referencia para nuevas propuestas en la solución de la ecuación de la ecuación de Schrödinger.
nivel energético es un estado (o conjunto de estados) cuya energía es uno de los valores posibles del operador hamiltoniano, y por lo tanto su valor de energía es un valor propio de dicho operador. Matemáticamente los estados de un cierto nivel energético son funciones propias del mismo hamiltoniano.
Niveles energéticos atómicos
En química y teoría atómica se parte del hecho de que los electrones que forman parte del átomo están distribuidos en "capas" o niveles energéticos. En función de la capa que ocupe un electrón tiene una u otra energía de ahí que se diga que ocupa una capa de cierto nivel energético. La existencia de capas se debe a dos hechos: el principio de exclusión de Pauli que limita el número de electrones por capa, y el hecho de que sólo ciertos valores de la energía están permitidos (técnicamente estos valores coinciden con los autovalores del operador hamiltoniano cuántico que describe la dinámica de los electrones que interaccionan electromagnéticamente con el núcleo atómico).
Si bien un electrón no puede adoptar cualquier tipo de energía sino sólo unas determinadas asociadas a los niveles energéticos de cada átomo, sí es posible, si se aporta energía a los electrones, que estos "salten" a otros niveles de energía superiores, pasando el átomo a estar en un estado excitado. La electrodinámica cuántica implica que estos estados excitados del átomo, donde un electrón ocupa un nivel energético alto existiendo huecos en los niveles inferiores son inestables, por lo que al cabo de unos instantes el electrón "decae" a niveles más bajos y emite la energía sobrante en forma de fotones. Cuando un electrón pasa de un nivel energético de con energíaE1 a uno con energía menor E2 la frecuencia del fotón emitido viene dada por:
donde h es la llamada constante de Planck.
Más técnicamente en mecánica cuántica las capas se modelizan como orbitales atómicos que son distribuciones de carga eléctrica en el espacio, cuya forma exacta depende de los detalles del modelo atómico de Schrödinger que está formado por soluciones exactas de la llamada ecuación de Schrödinger. En el modelo de Schrödinger y otros anteriores la estructura de capas electrónicas u orbitales es lo que explica la reactividad del átomo y los tipos de combinaciones (compuestos) que éste átomo puede formar. En ciertas situaciones físicas el modelo atómico de Schrödinger es inexacto, por ejemplo no puede explicar la estructura final del espectro, en esos casos frecuentemente se requiere la consideración del espín electrónico y el uso de la ecuación relativista de Dirac, aunque la mayor parte de las aplicaciones a la química pueden ser descritas mediante el modelo de Schrödinger, que es algo más simple.
Un orbital atómico viene representado por una función matemática que describe la distribución de probabilidad de uno o dos electrones en un átomo, dicha función es una función propia del hamiltoniano del átomo hidrogenoide. Un orbital molecular es análogo, pero para moléculas.
Niveles energéticos moleculares
Las mismas ideas usadas para explicar el espectro de emisión y absorción de los átomos pueden ser aplicadas a moléculas. Muy informalmente puede decirse que una molécula es una configuración estable de átomos que comparten orbitales atómicos. Los niveles energéticos de una molécula también pueden describirse mediante un hamiltoniano cuántico, aunque aquí el cálculo de los niveles energéticos resulta mucho más complicado matemáticamente y con frecuencia se recurre a aproximaciones numéricas, para predecir los niveles energéticos. De especial importancia son los niveles energéticos del HOMO (orbital molecular más alto ocupado) y del LUMO(orbital molecular más bajo vacío).
Las diferentes espectroscopias estudian transiciones entre niveles de distintas energías. La espectroscopia infrarroja, por ejemplo, estudia transiciones entre niveles energéticos de vibración molecular, mientras que la espectroscopia ultravioleta-visible estudia transiciones electrónicas y la espectroscopia Mössbauer se ocupa de transiciones nucleares. Orbitales
Para una descripción y comprensión detalladas de las reacciones químicas y de las propiedades físicas de las diferentes sustancias, es muy útil su descripción a través de orbitales, con ayuda de la mecánica cuántica.
Esquema de los niveles energéticos de un átomo hidrogenoide.
NIVELES DE ENERGIA.
En un átomo, los electrones están girando alrededor del núcleo formando capas. En cada una de ellas, la energía que posee el electrón es distinta. En efecto; en las capas muy próximas al núcleo, la fuerza de atracción entre éste y los electrones es muy fuerte, por lo que estarán fuertemente ligados.Ocurre lo contrario en las capas alejadas, en las que los electrones se encuentran débilmente ligados, por lo que resultará más fácil realizar intercambios electrónicos en las últimas capas.El hecho pues, de que los electrones de un átomo tengan diferentes niveles de energía, nos lleva a clasificarlos por el nivel energético (o banda energética) en el que se encuentra cada uno de ellos. Las bandas que nos interesa a nosotros para entender mejor el comportamiento del átomo son:La Banda de Valencia y la Banda de Conducción.La Banda de Valencia es un nivel de energía en el que se realizan las combinaciones químicas. Los electrones situados en ella, pueden transferirse de un átomo a otro, formando iones que se atraerán debido a su diferente carga, o serán compartidos por varios átomos, formando moléculas.El átomo de Sodio (Na) tiene 11 electrones, 2 en la primera capa, 8 en la segunda y 1 en la tercera, y el Cloro (Cl) tiene 17 electrones, 2 en la primera, 8 en la segunda y 7 en la tercera. Debido a que todos los átomos tienden a tener 8 electrones en la última capa (regla del octete): el Sodio cederá 1 electrón al Cloro con lo que el primero se quedará con 8 electrones en su ahora última capa, en cambio el Cloro aceptará ese electrón pasando su última capa de tener 7 electrones a 8Así pues. el átomo de Sodio que ha perdido un electrón se ha transformado en un ión positivo:
Na -> Na+
Atomo de Sodio (Na) | Ión Sodio (Na+) |
y el Cloro que lo ha ganado se transforma en un ión negativo:
Cl -> Cl-
Atomo de Cloro (Cl) | Ión Cloruro (Cl-) |
Ambos se atraerán y formarán la molécula de Cloruro Sódico o Sal común (Cl Na)
La Banda de conducción es un nivel de energía en el cual los electrones están aún más desligados del núcleo, de tal forma que, en cierto modo, todos los electrones (pertenecientes a esa banda) están compartidos por todos los átomos del sólido, y pueden desplazarse por este formando una nube electrónica.Cuando un electrón situado en la banda de valencia se le comunica exteriormente energía, bien sea eléctricamente, por temperatura, luz, étc. puede (al ganar energía) saltar a la banda de conducción, quedando en situación de poder desplazarse por el sólido.

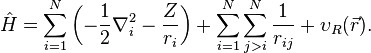




No hay comentarios:
Publicar un comentario