El aerografito es una espuma sintética que consiste en una red porosa interconectada de carbono tubular. Con una densidad de 0,18 mg/cm3 es uno de los materiales estructurales más ligeros, después del Aerogel de grafeno, de 0,16 mg/cm3.1 Fue desarrollado conjuntamente por un equipo de investigadores en la Universidad de Kiely la Universidad Técnica Hamburg-Harburg en Alemania, y fue reportado por primera vez en una revista científica en junio de 2012.
Estructura y propiedades
El aerografito es un material negro sin soporte que puede ser producido en varias formas ocupando un volumen de hasta varios centímetros cúbicos. Consiste en una red sin costuras de tubos de carbono interconectados que tienen diámetros a microescala y un espesor de pared de alrededor de 15 nm. Debido a la relativamente baja curvatura y grande espesor de pared, estas paredes difieren del los esqueletos tipo grafeno de los nanotubos de carbono y recuerda al carbono vítreo en sus propiedades. Estas paredes son a veces discontinuas y contienen áreas arrugadas que mejoran las propiedades elásticas del aerografito. El enlace de los carbonos en el material tiene un cierto carácter de hibridación sp2, como es confirmado por espectroscopia de pérdida de energía de electrones y medidas de la conductividad eléctrica. Tras una compresión externa, la conductividad se incrementa, junto con la densidad del material, desde ~0.2 S/m a 0.18 mg/cm3 hasta 0.8 S/m a 0.2 mg/cm3. La conductividad es más alta para un material más denso, 37 S/m a 50 mg/cm3.2
Debido a su estructura de red tubular interconectada, el aerografito resiste fuerzas de tensión mucho mejor que otras espumas de carbono así aerogeles de sílice. Sufre extensas deformaciones elásticas y tiene un muy bajo coeficiente de Poisson. Es posible una completa recuperación de la forma de una muestra de 3 mm de altura después de comprimirse hasta 0.1 mm. Su tensión de rotura (UTS) depende de la densidad del material y es alrededor de 160 kPa a 8.5 mg/cm3 y 1 kPa a 0.18 mg/cm3; en comparación, los más fuertes aerogeles de sílice tienen una UTS de 16 kPa a 100 mg/cm3. Su módulo de Young es aproximadamente 15 kPa a 0.2 mg/cm3 en tensión, pero es mucho menor en compresión, incrementándose desde 1 kPa a 0.2 mg/cm3 hasta 7 kPa a 15 mg/cm3.2
El aerografito es superhidrofóbico, así que sus muestras de un tamaño de centímetros repelen el agua; son también bastante sensibles a efectos electrostáticos y espontáneamente saltan a objetos cargados.2
Síntesis
Es producido por deposición química de vapor, usando una plantilla de ZnO. La plantilla consiste en barras de espesor micrométrico, que puede ser sintetizado mezclando cantidades comparables de polvos de Zn y butiral de polivinilo y calentando la mezcla a 900 °C. La síntesis de aerografito es realizada a ~760 °C, bajo un flujo de gas argón, al cual se le inyectan vapores detolueno como fuente de carbono. Una capa delgada (~15 nm) y discontinua de carbono es depositada en el ZnO el cual es entonces grabado mediante la adición de gas hidrógeno a la cámara de reacción. Así, la red de carbono remanente sigue de manera cercana la morfología de la plantilla original de ZnO. En particular, los nodos de la red de aerografito se originan de las uniones de las plantillas de ZnO.2
Potenciales aplicaciones
Han sido probados electrodos de aerografito en un capacitor eléctrico de doble capa (EDLC, también conocidos comocondensadores de alta capacidad) y soportaron los golpes mecánicos relacionados con los ciclos de carga-descarga y cristalización del electrolito (que ocurre en la evaporación del disolvente). Su capacidad de energía de 1.25 Wh/kg es comparable a la de los electrodos de nanotubos de carbono (~2.3 Wh/kg).2
Ortesis
También puede ser empleado en la suela porosa de las ortesis de tobillo, a fin de reducir el excesivo peso que actualmente tienen las mismas.
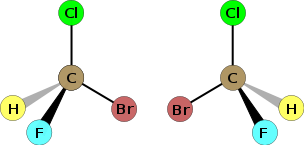
Un carbono asimétrico o carbono quiral es un átomo de carbono que está enlazado con cuatro sustituyentes o elementos diferentes. Puede presentarse en algunos compuestos orgánicos, es decir, en aquellos que están presentes en los seres vivos, como los glúcidos.
La presencia de uno o varios átomos de carbono asimétrico en un compuesto químico es responsable de la existencia de isomería óptica. Cada una de las dos estructuras diferentes que pueden formarse tienen los mismos átomos y los mismos enlaces pero no pueden superponerse una sobre otra, como ocurre con las dos manos de una persona. Se llaman enantiómeros y se diferencian en la dirección en la que desvían la luz polarizada por lo que se llaman formas ópticamente activas.
Isomería espacial
Cuando el grupo hidroxilo está ubicado a la izquierda del carbono quiral indica que se trata de una molécula L, mientras que si está a la derecha es D. En el caso de los carbohidratos podemos encontrar la D-Glucosa y la L-Glucosa.El carbono asimetrico diferencia 2 formas del mismo monosacárido.
La fibra de carbono es una fibra sintética constituida por finos filamentos de 5–10 μm de diámetro y compuesto principalmente por carbono.1 Cada fibra de carbono es la unión de miles de filamentos de carbono. Se trata de una fibra sintética porque se fabrica a partir del poliacrilonitrilo. Tiene propiedades mecánicas similares al acero y es tan ligera como la madera o el plástico. Por su dureza tiene mayor resistencia al impacto que el acero.
La principal aplicación es la fabricación de materiales compuestos, en la mayoría de los casos —aproximadamente un 75%— con polímeros termoestables. El polímero es habitualmente resina epoxi, de tipo termoestable aunque también puede asociarse a otros polímeros, como el poliéster o el viniléster.
Estructura
La estructura atómica de la fibra de carbono es similar a la del grafito, consistente en láminas de átomos de carbono ordenados en un patrón regular hexagonal. La diferencia está en la manera en que esas hojas se entrecruzan. El grafito es un material cristalino en donde las hojas se sitúan paralelamente unas a otras de manera regular. Las uniones químicas entre las hojas es relativamente débil, lo que proporciona al grafito su blandura y brillo característicos. La fibra de carbono es un material amorfo: las láminas de átomos de carbono se colocan al azar, apretadas o juntas. Esta integración de las láminas de carbono es responsable de su alta resistencia.
La densidad de la fibra de carbono es de 1.750 kg/m3. Es conductor eléctrico y de alta conductividad térmica. Al calentarse, un filamento de carbono se hace más grueso y corto.
Su densidad lineal (masa por unidad de longitud, con la unidad * 1 tex = 1 g/1000 m) o por el número de filamentos por yarda, en miles.
Propiedades
Las propiedades principales de este material compuesto son:
- Muy elevada resistencia mecánica, con un módulo de elasticidad elevado.
- Baja densidad, en comparación con otros materiales como por ejemplo el acero.
- Elevado precio de producción.
- Resistencia a agentes externos.
- Gran capacidad de aislamiento térmico.
- Resistencia a las variaciones de temperatura, conservando su forma, sólo si se utiliza matriz termoestable.
Las razones del elevado precio de los materiales realizados con fibra de carbono se deben a varios factores:
- El refuerzo, fibra, es un polímero sintético que requiere un caro y largo proceso de producción. Este proceso se realiza a alta temperatura -entre 1100 y 2500 °C- en atmósfera de hidrógeno durante semanas o incluso meses dependiendo de la calidad que se desee obtener, ya que pueden realizarse procesos para mejorar algunas de sus características una vez se ha obtenido la fibra.
- El uso de materiales termoestables dificulta el proceso de creación de la pieza final, ya que se requiere de un complejo utillaje especializado, como el horno autoclave.
Tiene muchas aplicaciones en la industria aeronáutica y automovilística, al igual que en barcos y en bicicletas, donde sus propiedades mecánicas y ligereza son muy importantes. También se está haciendo cada vez más común en otros artículos de consumo como patines en línea, raquetas de tenis, edificios, ordenadores portátiles, trípodes y cañas de pesca e incluso en joyería .
Elementos que se pueden elaborar con la fibra de carbono
- Medios de transporte
- Construcciones
- Material deportivo
- Instrumentos musicales
- Cañas de pescar de competición y o muy alta resistencia.
- Prótesis
- La fibra de carbono (FC) se desarrolló inicialmente para la industria espacial, pero ahora, al bajar de precio, se ha extendido a otros campos: la industria del transporte, aeronáutica, al deporte de alta competición y, últimamente encontramos la FC hasta en carteras de bolsillo relojes, escudos, autos de carrera, tractores, palas, etc fibra de carbono.
El grafito es una de las formas alotrópicas en las que se puede presentar el carbono junto al diamante, losfulerenos, los nanotubos y el grafeno. A presión atmosférica y temperatura ambiente es más estable el grafito que el diamante, sin embargo la descomposición del diamante es tan extremadamente lenta que sólo es apreciable aescala geológica.
Fue nombrado por Abraham Gottlob Werner en el año 1789. El término grafito deriva del griego γραφειν (graphein) que significa "escribir", ya que se usa principalmente para crear la punta de los lápices. También se denomina plumbagina y plomo negro.
Puede extraerse de yacimientos naturales , pero también se produce artificialmente. El principal productor mundial de grafito es China, seguido de India y Brasil.
Estructura
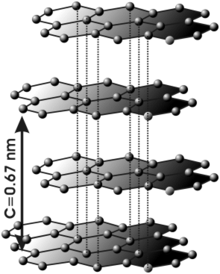
En el grafito los átomos de carbono presentan hibridación sp2, esto significa que forma tres enlaces covalentes en el mismo plano a un ángulode 120º (estructura hexagonal) y que un orbital Π perpendicular a ese plano quede libre (estos orbitales deslocalizados son fundamentales para definir el comportamiento eléctrico del grafito). El enlace covalente entre los átomos de una capa es extremadamente fuerte, sin embargo las uniones entre las diferentes capas se realizan por fuerzas de Van der Waals e interacciones entre los orbitales Π, y son mucho más débiles.
Se podría decir que el grafito está constituido por capas de grafenosuperpuestas.
Esta estructura laminar hace que el grafito sea un material marcadamenteanisótropo.
Al igual que el diamante, el grafito está constituido exclusivamente por átomos de carbono, pero con una estructura cristalina particular. Tanto el grafito como el diamante son formas alotrópicas del carbono, de entre las múltiples que son posibles. El grafito, como el diamante, es un mineral semimetálico. Se conocen procesos mediante los cuales el grafito puede convertirse en diamante mediante el uso de muy elevadas presiones y temperaturas, pero esos métodos son de un coste superior al valor de mercado de los diamantes que se obtendrían, por lo que el hecho apenas se ha aprovechado comercialmente excepto para fabricar microdiamantes empleados en herramientas especiales.
Propiedades
El grafito es de color negro con brillo metálico, refractario y se exfolia con facilidad. En la dirección perpendicular a las capas presenta una conductividad de la electricidad baja y que aumenta con la temperatura, comportándose pues como un semiconductor. A lo largo de las capas la conductividad es mayor y aumenta proporcionalmente a la temperatura, comportándose como un conductor semimetálico. Aunque tanto el grafito como el diamante están formados exclusivamente por átomos de carbono, el grafito es muy blando y opaco, mientras que el diamante es el mineral más duro según la escala de Mohs y además deja pasar la luz a través de si, estas marcadas diferencias físicas se deben exclusivamente a las diferentes redes cristalinas o retículos sobre las que se disponen los átomos de carbono en el grafito (átomos de carbono en los vértices de prismas hexagonales) y en el diamante (la red cristalina está hecha de tetraedros regulares cuyos vértices son átomos de carbono).
Aplicaciones
- El grafito mezclado con una pasta se utiliza para fabricar la mina de los lápices.
- Se usa como componente de ladrillos, crisoles, etc.
- Al deslizarse las capas fácilmente en el grafito, resulta ser un buen lubricante sólido.
- Se utiliza en la fabricación de diversas piezas en ingeniería, como pistones, juntas, arandelas, rodamientos, etc.
- Debido a su conductividad eléctrica se usa para fabricar electrodos. También tiene otras aplicaciones eléctricas, como los carbones de un motor (escobillas), que entran en contacto con el colector.
- Se emplea en reactores nucleares, como moderadores y reflectores.
- Es usado para crear discos de grafito parecidos a los de discos vinilo salvo por su mayor resistencia a movimientos bruscos de las agujas lectoras.
- Se puede crear Grafeno, material de alta conductividad eléctrica y térmica, futuro sustituto del silicio en la fabricación de chips.
- Se emplea en la fabricación de carretes y cañas de pesca.
Compuestos de intercalación de grafito
Distintas moléculas o iones pueden penetrar en las capas del grafito. Por ejemplo el potasio puede ceder un electrón al grafito, quedando el ion de potasio, K, entre las capas. Este electrón contribuye a aumentar la conductividad que presentaba el carbono.
Se pueden preparar diferentes compuestos de intercalación con distintas estequiometrías y distintas especies. En algunos casos la conductividad resultante es mayor, como en el caso del potasio, y es lo que ocurre generalmente, pero en otros, como por ejemplo con flúor, es menor.
Otras formas relacionadas
Existen otras formas llamadas de carbón amorfo que tienen una estructura relacionada con la del grafito:
carbono –o grafito- pirolítico se conoce desde hace mucho tiempo, sólo en los últimos años se ha pensado en desarrollar sus aplicaciones potenciales. El carbono pirolítico se produce en forma de depósito, sobre una superficie caliente, por descomposición térmica de los hidrocarburos gaseosos, por ejemplo, metano, propano, benceno, etc. La temperatura de descomposición está comprendida en el intervalo de 1500 a 2500 ºC (2730-4530 ºF). La estructura y densidad del producto dependen de la temperatura de descomposición y de otros factores, pudiendo modificarse en cierto grado por calentamiento posterior a temperaturas más altas. Lo característico del carbono pirolítico es que posee una estructura cristalina fuertemente orientada. Como consecuencia de ello, las propiedades de este material en el plano paralelo a la superficie sobre la que fue depositado son las de un metal, por ejemplo,conductividad térmica elevada y gran resistencia a la tracción. En cambio en dirección perpendicular al plano de deposición, es un refractario típico, de baja conductividad térmica y poca resistencia a la tracción. El carbono pirolítico es prácticamente impermeable a los gases, incluso en capas delgadas, teniendo por ello las mismas aplicaciones potenciales que el grafito impermeable antes citado. Está siendo considerado, además como recubrimiento del carburo de uranio y combustibles similares, para evitar el escape de los productos de fisión gaseosa.




No hay comentarios:
Publicar un comentario