Berilio
El berilio es un elemento químico de símbolo Be y número atómico 4. Es un elemento Alcalinotérreobivalente, tóxico, de color gris, duro, ligero y quebradizo. Se emplea principalmente como endurecedor enaleaciones, especialmente de cobre.
Aplicaciones
- Elemento de aleación, en aleaciones cobre-berilio con una gran variedad de aplicaciones.
- En el diagnóstico con rayos X se usan delgadas láminas de berilio para filtrar la radiación visible, así como en la litografía de rayos X para la reproducción de circuitos integrados.
- Moderador de neutrones en reactores nucleares.
- Por su rigidez, ligereza y estabilidad dimensional, se emplea en la construcción de diversos dispositivos como giróscopios, equipo informático, muelles de relojería e instrumental diverso.
- El óxido de berilio se emplea cuando son necesarias elevada conductividad térmica y propiedades mecánicas, punto de fusión elevado y aislamiento eléctrico.
- Antaño se emplearon compuestos de berilio en tubos fluorescentes, uso abandonado por la beriliosis.
- Fabricación de Tweeters en altavoces de la clase High-End, debido a su gran rigidez.
El principal uso del berilio metálico se encuentra en la manufactura de aleaciones berilio-cobre y en el desarrollo de materiales moderadores y reflejantes para reactores nucleares. La adición de un 2% de berilio al cobre forma una aleación no magnética seis veces más fuerte que el cobre. Estas aleaciones berilio-cobre tienen numerosas aplicaciones en la industria de herramientas ya que no producen chispas, en las partes móviles críticas de aviones, así como en componentes clave de instrumentos de precisión, computadoras mecánicas, reveladores eléctricos y obturadores de cámaras fotográficas. Martillos, llaves y otras herramientas de berilio-cobre se emplean en refinerías petroleras y otras plantas en las cuales una chispa producida por piezas de acero puede ocasionar una explosión o un incendio.
El berilio tiene muchos usos en la energía nuclear porque es uno de los materiales más eficientes para disminuir la velocidad de los neutrones, así como para reflejarlos. En consecuencia, se utiliza en la construcción de reactores nucleares como moderador y soporte, o en aleaciones con elementos combustibles.
Denominaciones
- N° CAS: 7440-41-7
- Nombre registrado: Berilio
- Nombre químico: Berilio
- Sinónimos, nombres comerciales: Glicinio
- Nombre químico (alemán): Berryllium
- Nombre químico (francés): Béryllium
- Nombre químico (inglés): Beryllium
- Aspecto general: Metal duro, brillante de color blanco plateado.
Historia
El berilio (del griego βηρυλλος berilo) o glucinio (del inglés glucinium y éste del griego γλυκυς, dulce) por el sabor de sus sales, fue descubierto por Louis Nicolas Vauquelin en 1798 en Francia en forma de óxido en elberilo y la esmeralda. Friedrich Wöhler y Antoine Bussy de forma independiente aislaron el metal en 1828mediante reacción de potasio con cloruro de berilio.
Abundancia y obtención
El berilio se encuentra en 30 minerales diferentes, siendo los más importantes berilo y bertrandita, principales fuentes del berilio comercial, crisoberilo y fenaquita. Actualmente la mayoría del metal se obtiene mediantereducción de fluoruro de berilio con magnesio. Las formas preciosas del berilo son el aguamarina y laesmeralda.
Geográficamente, las mayores reservas se encuentran en los Estados Unidos que lidera también la producción mundial de berilio (65%), seguido de Rusia (40%) y China (15%). Las reservas mundiales se estima que superan las 80.000 toneladas.
Isótopos
El Be-9 es el único isótopo estable. El Be-10 se produce en la atmósfera terrestre mediante el proceso despallation (fragmentación) inducido por el bombardeo de radiación cósmica de alta energía sobre los núcleos del oxígeno y nitrógeno. Dado que el berilio tiende a existir en disolución acuosa con niveles de pH menores de 5.5, este berilio atmosférico formado es arrastrado por el agua de lluvia (cuyo pH suele ser inferior a 5.5); una vez en la tierra, la solución se torna alcalina precipitando el berilio que queda almacenado en el suelodurante largo tiempo (periodo de semidesintegración de 1,387(12) millones de años1 ) hasta su transmutación en B-10. El Be-10 y sus productos hijo se han empleado para el estudio de los procesos de erosión, formación a partir de regolito y desarrollo de suelos lateríticos, reciclado de sedimento submarino durante la subducción de placas tectónicas, así como las variaciones en la actividad solar y la edad de masas heladas.
El hecho de que el Be-7 y el Be-8 sean inestables tiene profundas consecuencias cosmológicas, ya que ello significa que elementos más pesados que el berilio no pudieron producirse por fusión nuclear en el big bang. Más aún, los niveles energéticos nucleares del Be-8 son tales que posibilitan la formación de carbono y con ello la vida (véase proceso triple alfa).
Toxicología
Los daños en la salud resultantes de la exposición son considerados como enfermedades profesionales, y como tal fueron descritos por primera vez en trabajadores de una fábrica de lámparas fluorescentes en Massachusetts en 1946. Aunque la utilización de berilio en la fabricación de dichas lámparas se interrumpió en 1949, aún existe un riesgo de exposición continuada para trabajadores de las industrias nuclear, aeroespacial, telecomunicaciones, electrónica, biomédica o metalúrgica.2
Toxicocinética
La principal vía de exposición a los compuestos de berilio es la vía inhalatoria. La absorción es lenta, con un pico de concentraciones máximo a los 10 días. Otras vías como la oral o la transdérmica son bastante menos importantes ya que, en condiciones normales, sólo se absorbería aproximadamente el 1% del berilio metálico, pero la presencia de sales solubles o daños en la piel, pueden aumentar la fracción absorbida.
Una vez en la circulación sistémica, se uniría en gran medida a proteínas plasmáticas, en concreto prealbúminas y globulinas.
El berilio se acumula principalmente en hueso y pulmón, siendo este segundo especialmente importante en casos de exposición inhalatoria.3 No obstante, también se ha visto la posibilidad de que se acumule en otros órganos como hígado, nodos linfáticos, bazo, corazón, músculo esquelético, piel y riñón en proporciones menores.
Se elimina por orina en pequeñas cantidades, directamente proporcionales a las dosis de exposición. Los datos sobre su semivida de eliminación en ratas son poco concluyentes, dictando que ésta puede estar entre 1-60 días y 0.6-2.3 años, dependiendo de la vía de administración, el compuesto químico exacto y el proceso de obtención del mismo. Por ejemplo, se ha visto que los sulfatos se eliminan más rápidamente que los óxidos, habiendo diferencias también entre el óxido de berilio si ha sido calcinado a 500 °C o a 1000 °C. En humanos se cree que podría ser mayor, ya que se han encontrado depósitos de berilio en los pulmones de trabajadores expuestos años después de cesar dicha exposición.4
Efectos tóxicos
Toxicidad dérmica
Son los efectos tóxicos más comunes de la exposición a berilio y se da principalmente por el contacto local con compuestos solubles.
El contacto superficial puede provocar conjuntivitis y dermatitis papulovesicular, que a veces puede confundirse con una respuesta inflamatoria de tipo alérgico. Si en vez de un contacto superficial lo que se produce es un cúmulo de berilio insoluble en la dermis, se originan lesiones de granulomatosas alrededor del infiltrado que puede llevar a la aparición de lesiones ulcerantes o necrotizantes.5 6 En ciertos casos también pueden darse reacciones de hipersensibilidad tipo IV por el contacto del berilio con la piel.7
Neumonitis química aguda
Se trata de una reacción inflamatoria generalizada del tracto respiratorio (incluyendo cavidad nasal, faringe, vías aéreas traqueobronquiales y alveolos) en respuesta a la presencia de berilio o algunos de sus compuestos derivados y que se produce de manera inmediata tras la inhalación. Esta situación era bastante común durante la extracción del mineral.
La enfermedad suele remitir en semanas o meses, aunque en casos de exposición alta puede ser fulminante en el acto. También es de destacar que alrededor del 15-20% de los casos acaba derivando en enfermedad granulomatosa crónica.8
Enfermedad granulomatosa crónica
También conocida como beriliosis o CBD por sus siglas en inglés (Chronic Beryllium Disease), fue la primera enfermedad descrita relacionada con la exposición sistemática a sales de berilio (principalmente óxido de berilio). Se estima que entre el 1 y el 15% de la población que se encuentre expuesta de manera continuada desarrolla una sensibilización.
Se trata de una enfermedad causada por una respuesta de hipersensibilidad pulmonar debida a la exposición continuada a partículas de berilio por vía inhalatoria, aunque en ocasiones se puede desarrollar tras una sola exposición. Esta respuesta inmune está mediada por linfocitos T y citokinas, como TNF-α e Interleucina-2.9
La enfermedad suele cursar con inflamación granulomatosa pulmonar, disnea de esfuerzo, tos, dolor torácico, pérdida de peso, fatiga y debilidad generalizada. El signo más característico de esta enfermedad es el aumento de la fibrosis intersticial, que se traduciría en una pérdida de la funcionalidad alveolar, una disminución de la efectividad del intercambio gaseoso a nivel pulmonar y, en consecuencia, un aumento de la disfunción respiratoria. A largo plazo se ha observado que también puede aparecer hipertrofia ventricular derecha. En casos graves se ha llegado a observar cianosis y osteoartropatía hipertrófica.
Por rayos X se puede apreciar pequeños granulomas intersticiales en los alveolos similares a los de sarcoidosis,10 lo que hace que en ocasiones se confunda con esta enfermedad cuando la sintomatología aún no está demasiado definida.
Carcinogenicidad
El berilio ha sido clasificado como un compuesto carcinogénico dentro de la categoría 1 de la IARC, o lo que es lo mismo, existen pruebas concluyentes de su capacidad carcinogénica tanto en animales como en humanos.11
Límites de exposición
La regulación española establece como valor límite de exposición diaria (VLA-ED) la cantidad de 0.0002 miligramos por metro cúbico de aire.
Descubierto en el año 1798 por el químico, farmacéutico y naturalista francésLouis Nicolas Vauquelin, el berilio es un elemento químico de tipo alcalinotérreo bivalente y considerablemente tóxico, razón por la cual se debe tener enorme cuidado con su manipulación.
En 1798, Vauquelin lo encontró en forma de óxido, en cristales de berilo y esmeraldas, pero no fue hasta el año 1828 que fue aislado, cuando de forma independiente, el químico alemán Friedrich Wöhler (quien también aisló el aluminio) y el francés Alexandre Brutus Bussy, así lo consiguieron gracias a la acción del potasio en cloruro de berilio.
Etimológicamente, el nombre de este elemento proviene del griego beryllos (berilo) y también tiene que ver con la palabra glykys, a menudo referido como glucinio y que en nuestro idioma, significa algo así como “dulce”.
Entre algunas de sus características generales, podemos mencionar que el berilo tiene un color gris, una consistencia dura pero quebradiza y un peso muy ligero.
HEMERA/THINKSTOCK
Es posible encontrarlo en unos 30 tipos de minerales diferentes, siendo el bertrandite, berilo, crisoberilo y phenakite, los más comunes. Las piedras de aguamarina y esmeralda son en sí, formas preciosas del berilo. Indisponible en la industria hasta el año 1957, en nuestros días, es ampliamente producido tras la reducción de fluoruro de berilio con magnesio metálico. Los cristales y minerales de berilo y bertrandita son las forma comercial más frecuente y común de este elemento.
Otros datos:
- Número atómico: 4
- Peso atómico: 9.012182
- Símbolo atómico: Be
- Punto de fusión: 1287° C
- Punto de ebullición: 2471° C
¿Para qué se usa el berilio?
IMAGE SOURCE/THINKSTOCK
Su mayor utilidad está en su aplicación como elemento de aleación, siendo especial como endurecedor en aleaciones de cobre. Así es ampliamente utilizado en la elaboración de resortes y resistencias, contactos eléctricos, electrodos de soldadura y herramientas que no producen chispas.
Otro de sus usos más interesantes es el que le incluye como material estructural en satélites, aviones de alta velocidad, naves espaciales, misiles y elementos para dispositivos de comunicación.
Al ser relativamente transparente a los rayos X, ultra-delgadas láminas fabricadas con berilio resultan útiles en la litografía de rayos X, siendo también un material que suele utilizarse en la construcción de giroscopios, piezas de equipo e instrumentos que requieren ligereza, rigidez y estabilidad dimensional.
Por último, entre otras cosas, el alto punto de fusión del óxido de berilio le convierte en un material muy adecuado para el trabajo nuclear.
Uno de los grandes problemas del berilio refiere a su manejo, ya que sus sales son tóxicas y altamente cancerígenas. En la mayoría de los casos la exposición prolongada al polvo de berilio provoca cáncer de pulmón, teniendo consecuencias fatales.

El berilio (Be) posee doce isótopos conocidos, de los cuales solamente el 9Be es estable siendo, además, un isótopo primordial. El berilio es un elemento mononuclídico, es decir, que sólo puede encontrarse uno de sus isótopos en la naturaleza. El berilio es el único de los veintiséis elementos monoisotópicos cuyo núcleo está formado por un número par de protones y un número impar de neutrones.
De los once radioisótopos del berilio, los más estables son el 10Be y el 7Be, con unos períodos de semidesintegración de 1,39 millones de años y de 53,22 días, respectivamente. El resto de radioisótopos del berilio tienen períodos de semidesintegración menores de 13,85 s, muchos de ellos inferiores a los 20 ms. El isótopo menos estable es el 6Be, con un período de semidesitengración de tan solo 5,03 zs.
Los isótopos estables de los elementos ligeros suelen presentar valores de Z/N iguales a la unidad, es decir, sus núcleos poseen igual número de protones y de neutrones. Esta tendencia sufre una desviación a medida que aumenta la masa de los elementos. El berilio es una excepción a dicha tendencia pues el isótopo para el que Z=N, el 8Be, es muy inestable y se descompone por desintegración alfa. Este proceso está favorecido porque los isótopos de 4Hegenerados por esta desintegración son altamente estables. El período de semidesintegración del 8Be es de 6,7(17)×10-17 s.
El berilio es un elemento muy ligero como para poseer isótopos estables con un valor de Z/N alejado de 1. Este tipo de desproporción entre el número de neutrones y protones sólo se observa en los isótopos estables de elementos más pesados. Sin embargo, el 10Be posee seis neutrones y cuatro protones (Z/N=2/3) y, aún siendo un isótopo inestable, su período de semidesintegración es inusualmente elevado (1,39 millones de años). Isótopos de berilio con desequilibrios más acentuados entre Z y N muestran, como es esperable, una inestabilidad mayor.
Se cree que la mayor parte del 9Be presente en el universo se formó mediante un proceso de espalación de rayos cósmicos en el período comprendido entre el Big Bang y la formación del Sistema Solar. Los isótopos de 7Be, con un período de semidesintegración de 53 días, y de 10Be son núclidos cosmogénicos, pues son de reciente aparición en la escala de tiempo del Sistema Solar y se han generado por espalación, como es el caso del 14C. La presencia de estos dos radioisótopos del berilio en la atmósfera terrestre permite la monitorización de los ciclos de manchas solares y de la actividad solar, fenómenos que afectan al campo magnético que protege la Tierra de los rayos cósmicos. La velocidad con la que el 7Be se transfiere desde el aire hasta el suelo depende en gran medida de las condiciones meteorológicas. La desintegración del 7Be en el Sol es uno de las fuentes de los neutrinos solares, y fue la primera fuente identificada empleando el experimento Homestake. La presencia de 7Be en los sedimentos se utiliza para medir la antigüedad de los mismos.
Tabla de isótopos
| Símbolo del isótopo | Z(p) | N(n) | Masa del isótopo (u) | Período de semidesintegración | Desintegración1 n 1 | Isótopo generadon 2 | Espín nuclear | Composición isotópica representativa (fracción molar) | Rango de variación natural (fracción molar) |
|---|---|---|---|---|---|---|---|---|---|
| Energía de excitación | |||||||||
| 5Be | 4 | 1 | 5.04079(429)# | p | 4Li | (+1/2)# | |||
| 6Be | 4 | 2 | 6.019726(6) | 5.0(3)×10-21 s [0.092(6) MeV] | 2p | 4He | 0 | ||
| 7Ben 3 | 4 | 3 | 7.01692983(11) | 53.22(6) d | CE | 7Li | -3/2 | Trazasn 4 | |
| 8Ben 5 | 4 | 4 | 8.00530510(4) | 6.7(17)×10-17 s [6.8(17) eV] | a | 4He | 0 | ||
| 9Be | 4 | 5 | Estable | -3/2 | 1.0000 | ||||
| 10Be | 4 | 6 | 10.0135338(4) | 1.39×106 años | ß- | 10B | 0 | Trazasn 4 | |
| 11Ben 6 | 4 | 7 | 11.021658(7) | 13.81(8) s | ß- (97.1%) | 11B | +1/2 | ||
| ß-, a (2.9%) | 7Li | ||||||||
| 12Be | 4 | 8 | 12.026921(16) | 21.49(3) ms | ß- (99.48%) | 12B | 0 | ||
| ß-, n (0.52%) | 11B | ||||||||
| 13Be | 4 | 9 | 13.03569(8) | 2.7x10-21 s | n | 12Be | +1/2 | ||
| 12Be | 4 | 8 | 12.026921(16) | 21.49(3) ms | ß- (99.48%) | 12B | 0 | ||
| ß-, n (0.52%) | 11B | ||||||||
| 13Be | 4 | 9 | 13.03569(8) | 2.7×10-21 s | n | 12Be | +1/2 | ||
| 14Ben 7 | 4 | 10 | 14.04289(14) | 4.84(10) ms | ß-, n (81.0%) | 13B | 0 | ||
| ß- (14.0%) | 14B | ||||||||
| ß-, 2n (5.0%) | 12B | ||||||||
| 15Be | 4 | 11 | 15.05346(54)# | <200 ns="" td=""> | |||||
| 16Be | 4 | 12 | 16.06192(54)# | <200 ns="" td=""> | 2n | 14Be | 0 | ||
| 17Be | 4 | 1 | |||||||
- Abreviaturas:
CE: Captura electrónica
TI: Transición isomérica
p: Emisión de protones
n: Emisión de neutrones - En negrita los isótopos estables.
- Generado en la nucleosíntesis del Big Bang, pero no primordial ya que rápidamente se desintegró para originar 7Li.
- Núclido cosmogénico.
- Producto intermedio del proceso triple-alfa en la nucleosíntesis estelar como parte de la ruta de síntesis de 12C.
- Posee un neutrón halo.
- Posee cuatro neutrones halo.
Notas
- Los valores marcados con # no se han obtenido a partir de datos puramente experimentales, sino que en parte se han deducido de las tendencias sistemáticas observadas. Los valores de espín que han sido asignados con una certeza baja se indican entre paréntesis.
- Las incertidumbres se han indicado de forma concisa entre paréntesis detrás de los últimos dígitos correspondientes. Los valores de incertidumbre indicados se corresponden a una vez la desviación estándar, excepto para la composición isotópica y la masa atómica estándar que se han obtenido de la IUPAC, que expresa las incertidumbres en forma expandida.
Cadena de desintegración
La mayoría de los isótopos del berilio que se encuentran dentro de las líneas que marcan la estabilidad ('proton-neutron drip lines', en inglés) se desintegran por medio de procesos de desintegración beta y/o una combinación de desintegración beta y desintegración alfa o emisión neutrónica. Sin embargo, el 7Be se desintegra únicamente por un proceso de captura electrónica, un fenómeno al que puede atribuirse su largo período de semidesintegración. El 8Be también presenta un comportamiento anómalo, que se desintegra mediante desintegración alfa para originar 4He. Esta desintegración alfa se considera a menudo como una fisión, lo que explicaría su período de semidesintegración extremadamente corto.







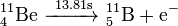

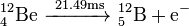


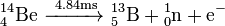



No hay comentarios:
Publicar un comentario