alquilación a la transferencia de un grupo alquilo de una molécula a otra. El grupo alquilo puede ser transferido como uncarbotion de alquilo, un radical libre, un carbanión o un carbeno (o sus equivalentes).1 Los agentes alquilantes son ampliamente utilizados en la química ya que el grupo alquílo es probablemente el grupo más común entre las moléculas orgánicas. Numerosas moléculas orgánicas objetivo o sus precursores sintéticos están formadas por una cadena alquilo que contiene grupos funcionales específicos en un determinado orden. Se utiliza la alquilación selectiva, o el agregado de partes a la cadena con los grupos funcionales deseados, especialmente cuando no existe un precursor biológico común. La alquilación con solo un átomo de carbono se denomina metilación.
En el contexto de la refinación del petróleo, se utiliza el término alquilación para referirse a un procedimiento en donde se combinan olefinas con parafinas para formarisoparafinas de alto peso molecular . Es usual, la alquilación del isobutileno (olefina) con isobutano para producir una mezcla del isobutano con isooctano. Es un proceso muy importante en la refinación del petróleo porque produce un número de octanos superior a 87.2 3
En el ámbito de la medicina, la alquilación del ADN se utiliza en quimioterapia para afectar el ADN de las células cancerígenas. La alquilación se realiza mediante un tipo de substancias denominadas agentes alquilantes.

En el campo de la química orgánica, se conoce con el nombre de alquilación, al paso de un alquilo, desde una molécula a otra distinta. El alquilo suele transferirse a modo de carbocatión alquilo, o también como un radical de tipo libre, carbanión, etc. Las agentes de tipo alquilantes se usan ampliamente en el campo de la química, pues el grupo alquilo quizás sea el grupo más presente y común que poseen las moléculas en la química orgánica. Un gran número de moléculas de tipo orgánica se encuentran constituidas por una cadena de tipo alquilo que contiene en su composición diferentes grupos funcionales. La alquilación de tipo selectiva, o el añadir partes de una cadena según necesitemos, viene utilizado sobretodo cuando la molécula no cuenta con un precursor de tipo biológico. Cuando procedemos a realizar alquilaciones con tan sólo un carbono, ésta recibirá el nombre de metilación.
En el campo de la refinería de petróleo, se usa a menudo el concepto de alquilación para hacer referencia a un procedimiento donde se unen las olefinas, junto con parafinas para dar lugar a isoparafinas con un gran peso molecular. Es muy común la alquilación de la olefina o isobutileno junto con isobutano para conseguir una buena mezcla de isobutano e isooctano. Es un procedimiento bastante importante en lo referente al tratamientoo y refinación del petróleo, pues provoca un gran número de octanos.
En el campo de la medicina, las alquilaciones de ADN son ampliamente utilizadas por la quimioterapia, con el fin de influir en el ADN de las células de tipo cancerígenas. Las alquilaciones tienen lugar a través de sustancias conocidas como agentes de tipo alquilante, como puede ser el caso por ejemplo del sulfato de dimetilo.
El sulfato de dimetilo cuenta con una fórmula química de forma (CH3O)2SO2, aunque a veces se suele representar como (CH3)2SO4, pues procede del metanol y el ácido sulfúrico. En algunas ocasiones incluso podemos encontrarlo representado como Me2SO4, donde por supuesto, Me hace referencia al metilo. Su uso principal es el de agente mutilante en síntesis de tipo orgánicas.
Este compuesto, por lo general se presenta en estado líquido, con un cierto toque aceitoso y sin coloración alguna. Su olor característico recuerda al aroma de la cebolla, aunque no es nada recomendable olerlo pues presenta inconvenientes, pues es muy tóxico, como la mayoría de los agentes alquilantes fuertes.
Este compuesto puede ser sintetizado en laboratorio a partir de diferentes tipos de síntesis, aunque la más común es la esterificación del H2SO4 con el metanol, a través de la reacción:
2CH3OH + H2SO4 → (CH3)2SO4 + 2H2O
El sulfato de dimetilo viene utilizado sobretodo como reactivo en procedimientos de mutilación para compuestos como los fenoles o aminas entre otros. Por lo general, un metilo se traspasa de manera más rápida que otro que viene en segundo lugar. El paso de metilos suele suceder en reacciones del tipo SN2. Este compuesto es uno de los más representativos como agente alquilante, pues es uno de los más utilizados a nivel industrial gracias a su bajo coste económico y su gran reactividad.
reacción de Buchwald-Hartwig, también llamada aminación de Buchwald-Hartwig o acoplamiento de Buchwald-Hartwig, es una reacción química usada enquímica orgánica para la síntesis de enlaces carbono-nitrógeno a través del acoplamiento cruzado de aminas con haluros de arilo, catalizado por paladio. A pesar de algunas publicaciones con un enfoque similar se publicaron ya en 1983, el crédito para su desarrollo se suele asignar a Stephen L. Buchwald y John F. Hartwig, cuyas publicaciones entre 1994 y finales de la década de 2000 establecieron el alcance de la transformación.
La utilidad de esta reacción para las síntesis se deriva principalmente de las deficiencias de los métodos típicos (sustitución nucleófila, aminación reductiva, etc) para la síntesis de enlaces C-N en compuestos aromáticos. El desarrollo de la reacción de Buchwald-Hartwig ha permitido la síntesis fácil de arilaminas, reemplazando a otros métodos (reacción de Goldberg, sustitución nucleófila aromática, etc), mientras que ha aumentado significativamente el repertorio de la posible formación del enlace C-N.
En el transcurso de su desarrollo, se han desarrollado varias 'generaciones' de sistemas catalíticos, con sucesivas mejoras que han permitido un mayor margen en términos de especies químicas a las que acoplarse y de condiciones más suaves, lo que permite prácticamente que cualquier amina pueda acoplarse con una amplia variedad de compuestos de arilo. Debido a la ubicuidad de los enlaces C-N arilo en productos farmacéuticos y productos naturales, la reacción ha conseguido un amplio uso en la química orgánica sintética, la aplicación en muchas síntesis totales y la preparación industrial de numerosos productos farmacéuticos. Se han publicado varias revisiones sobre esta reacción.
Historia
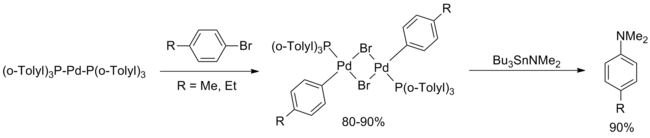
El primer ejemplo de una reacción de acoplamiento cruzado C-N catalizada por paladio fue publicado en 1983 por Migita y colaboradores y se describe una reacción entre varios bromuros de arilo y N,N-dietilamino-tributilestaño utilizando PdCl2[P(o-tolil)3]2> 1% moles . Aunque se pusieron a prueba varios bromuros de arilo, sólo los sustratos electrónicamente neutros, con impedimento estérico, dieron buenos rendimientos.10
Luego, en 1984, Dale L. Boger y James S. Panek publicaron un ejemplo de formación de enlaces C-N mediado por Pd (0) en el contexto de su trabajo en la síntesis de lavendamicina que utilizaba Pd(PPh3)4 estequiométrico. Los intentos de conseguir una reacción catalítica no tuvieron éxito.11
En febrero de 1994, el grupo de Hartwig publicó un estudio sistemático de los compuestos de paladio que participan en el artículo original de Migita, sus resultados indican que el complejo d10 de Pd[P(o-tolil)3]2 era el catalizador activo (con el correspondiente cloruro entrando en el ciclo catalítico a través de una reducción in situ), y apoyaba la participación de un ciclo catalítico en la adición oxidativa del bromuro de arilo.12
En mayo del mismo año, el grupo de Stephen Buchwald publicó una extensión del artículo de Migita con dos mejoras importantes sobre la reacción original. En primer lugar, la transaminación de Bu3SnNEt2 seguido de purga con argón para eliminar la dietilamina volátil permitió la extensión de la metodología a diversas aminas secundarias (cíclicas y acíclicas) y anilinas primarias. En segundo lugar, el rendimiento para arenos ricos y pobres en electrones se ha mejorado a través de pequeñas modificaciones en el procedimiento de reacción (mayor carga de catalizador, mayor temperatura, mayor tiempo de reacción), aunque no se incluyeron en esta publicación los grupos arilo orto substituidos.13
El año siguiente, estudios comparativos de cada laboratorio mostraron que estos acoplamientos podrían llevarse a cabo con aminas libres en presencia de una basevoluminosa (KOtBu en la publicación de Buchwald, LiHMDS en la publicación de Hartwig), lo que permite el acoplamiento sin organoestaño. Aunque estas condiciones mejoradas daban una reacción más rápida, los sustratos se limitaban casi exclusivamente a las aminas secundarias debido a la competencia de ladeshidrohalogenación de los bromoarenos.14 15
Estos resultados establecieron la llamada "primera generación" de sistemas catalíticos de Buchwald-Hartwig. Los años siguientes vieron el desarrollo de los más sofisticados ligandos fosfina que permiten la extensión a una mayor variedad de aminas y grupos arilo. Los yoduros, cloruros, y triflatos de arilo se convirtieron con el tiempo en sustratos adecuados, y se desarrollaron reacciones con bases más débiles a temperatura ambiente.
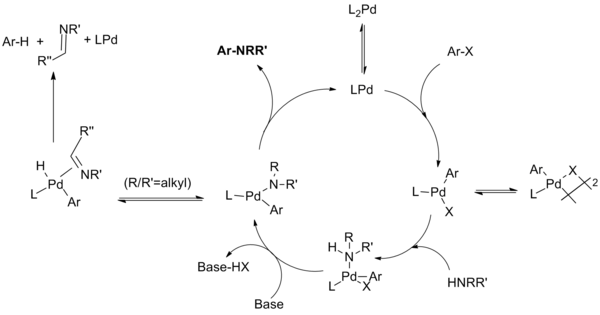
Mecanismo
El mecanismo de reacción se ha demostrado que procede a través de pasos similares a los conocidos para las reacciones de acoplamiento C-C catalizadas por paladio, a saber, adición oxidante, la formación de amida de paladio (en lugar de transmetalación), y finalmente eliminación reductora. Además de esto, una reacción secundaria improductiva puede competir con la eliminación reductiva en la que se somete a la amida a una beta eliminación para dar el areno deshidrohalogenado y un productoimina.3
En el curso del desarrollo de esta reacción, fue complejo determinar qué especie concreta de paladio es responsable de cada uno de estos pasos. Estos estudios han revelado vías de reacción divergentes dependiendo de si se emplean en la reacción ligandos fosfina monodentados o con efecto quelante, y se han revelado diversas influencias (especialmente en relación con los ligandos dialquilbiarilfosfina desarrollados por Buchwald).





No hay comentarios:
Publicar un comentario