Ciclos biogeoquímicos
hipótesis del fusil de clatratos es una teoría científica que sostiene que el aumento de la temperatura del mar puede dar lugar a una liberación repentina de metanodesde los depósitos de clatrato de metano situados en los fondos oceánicos. Esto provocaría una alteración del medio ambiente de los océanos y la atmósfera de la Tierra, similar a la que pudo acontecer según la teoría de extinción Permiano-Triásico,1 y en el máximo térmico del Paleoceno-Eoceno.
Clatrato de metano
El clatrato de metano, también conocido como hidrato de metano, es un sólido formado a partir de agua que contiene una gran cantidad de metano dentro de su estructura cristalina. Estos se habrían formado por el arrastre de material vegetal particulado, como aporte a ríos y luego a los océanos. Se han encontrado depósitos extremadamente grandes de clatrato de metano bajo los sedimentos de los fondos oceánicos de la Tierra. La liberación repentina de grandes cantidades de gas natural desde estos depósitos, en un hipotético efecto invernadero descontrolado, podría ser una causa de los cambios climáticos pasados y futuros. La liberación de este metano atrapado es una de las consecuencias potenciales del calentamiento global: se investiga formulando la hipótesis que esto podría aumentar la temperatura global unos 5° C adicionales ya que el metano, pese a que su vida en la atmósfera se encuentra alrededor de los 10 años, es cerca de 8 veces más fuerte como gas invernadero que el dióxido de carbono, al tener un potencial de calentamiento global (GWP) de 63 en un plazo de 20 años y de 23 en uno de 100 años. La teoría también pronostica que esto afectaría en gran medida al contenido de oxígeno disponible en la atmósfera terrestre.
Divulgación de la teoría
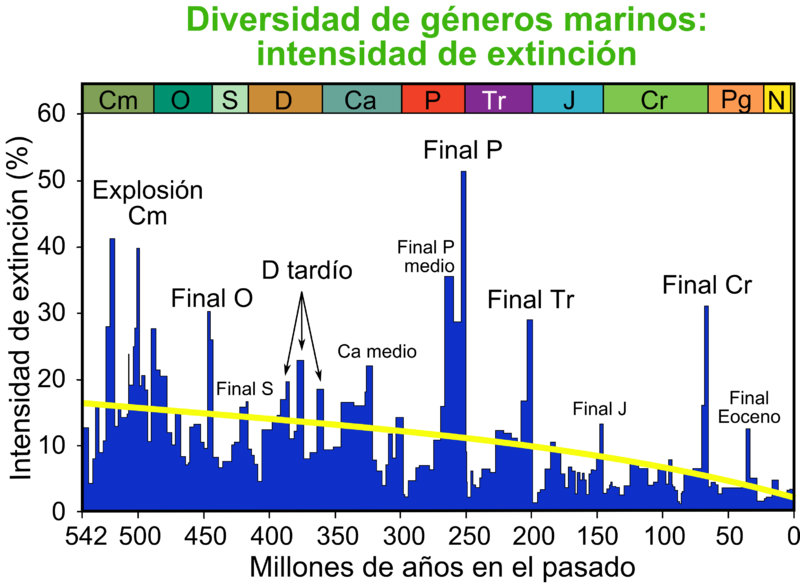
En el año 2002, un documental de la BBC, The Day the Earth Nearly Died ("El día que la Tierra estuvo a punto de morir"), resumía algunos descubrimientos recientes y especulaciones con respecto al acontecimiento de extinción Permiano-Triásica. Paul Wignall examinó diversos estratos del Pérmico en Groenlandia, donde las capas de roca desprovistas de vida marina tienen un grueso de decenas de metros; con esta escala expandida pudo juzgar la cronología de la deposición sedimentaria más detalladamente, constatando que la extinción entera duró unos 80.000 años y que mostraba tres fases distintivas en el contenido de fósiles de plantas y animales. La extinción parecía haber aniquilado selectivamente la vida marina y terrestre en tiempos diferentes. Dos periodos de extinciones de vida terrestre estaban separados por una extinción breve, aguda y casi total de la vida marina. Además el proceso parecía demasiado lento en su conjunto para poder ser explicado por la teoría del impacto de un asteroide. La relación de isótopos de carbono de la roca que mostraba un aumento gradual de carbono-12 (C12) fue la base para su investigación y la formulación de sus conclusiones.
Basándose en ello, el geólogo Gerry Dickens y el profesor de la Universidad de Santa Bárbara (Estados Unidos), James Kennet quien dio nombre a la hipótesis, han sugerido como base a pistas de trabajo e investigación que la causa del aumento de C12 podría encontrarse en la sublimación del hidrato de metano congelado del fondo marino, liberándose así metano rico en C12 rápidamente. Los experimentos y estudios para evaluar qué subida de temperatura de las profundidades marinas sería necesaria para producir este fenómeno han sugerido que con una subida de 5° C sería suficiente.
Emisiones de metano en el Ártico
En septiembre de 2008 científicos que viajaban a bordo de un barco ruso afirmaron tener pruebas de que millones de toneladas de metano están escapando a la atmósfera desde los fondos marinos del Ártico, al descubrir intensas concentraciones de metano en varias zonas que cubren miles de kilómetros cuadrados de la plataforma continental siberiana. Esta sería la primera vez que se observa un campo en el que la liberación de metano era tan intensa que el gas no tiene tiempo de disolverse en el agua del mar, sino que sale a la superficie en forma de burbujas.
"La liberación de metano en esas regiones inaccesibles, parece indicar que la capa de permafrost está comenzando a perforarse, lo que permite escapar al gas. Hemos encontrado niveles elevados de metano en la superficie del mar y aún más a ciertas profundidades."Örjan Gustafsson, Jefe del equipo de científicos del barco 'Jacob Smirnitskyi'2
La desnitrificación es un proceso metabólico que usa el nitrato como aceptor terminal de electrones en condiciones anóxicas (ausencia de oxígeno) principalmente. El proceso de reducción de nitratos hasta nitrógeno gas ocurre en etapas sucesivas, catalizadas por sistemas enzimáticos diferentes, apareciendo como productos intermedios nitritos, óxido nítrico y óxido nitroso. La realizan exclusivamente ciertos microorganismos, entre los que destacan Alcaligenes, Paracoccus, Pseudomonas,Thiobacillus, Rhizobium, Thiosphaera, entre otros.
Principio básico de la desnitrificación
Existen más de 50 géneros de bacterias que pueden llevar a cabo la desnitrificación.1 La capacidad desnitrificante también se ha encontrado en arqueas y hongos.2 3 Los géneros de bacterias desnitrificantes más citados incluyen: Alcaligenes, Paracoccus, Pseudomonas, Thiobacillus, Rhizobium, Thiosphaera, entre otros. La mayoría de las bacterias desnitrificantes son heterótrofas, pero algunas pueden crecer autotróficamente con hidrógeno (H2) y dióxido de carbono, con compuestos sulfurados reducidos, o con compuestos de arsénico reducidos, entre otro4 s. Además, se tienen reportes de que la desnitrificación se puede llevar a cabo aeróbicamente. Es por ejemplo el caso de Magnetospirillum magnetotacticum que consume O2 mientras desnitrifica.5 La desnitrificación es un proceso que usa el nitrato como aceptor terminal de electrones en condiciones anóxicas (ausencia de oxígeno) principalmente. El proceso de reducción de nitratos hasta nitrógeno gas ocurre en etapas seriales,catalizadas por sistemas enzimáticos diferentes, apareciendo como productos intermedios nitritos, óxido nítrico y óxido nitroso:
La desnitrificación requiere un sustrato oxidable ya sea orgánico o inorgánico que actúe como fuente de energía, por lo que la desnitrificación puede llevarse a cabo tanto por bacterias heterótrofas como autótrofas. En la desnitrificación heterótrofa, un sustrato orgánico, como metanol, etanol, ácido acético, glucosa, etc., actúa como fuente de energía (donador de electrones) y fuente de carbono. En la desnitrificación autótrofa, la fuente de energía es inorgánica, como hidrógeno o compuestos reducidos de azufre: sulfhídrico (H2S) o tiosulfato (S2O32-), la fuente de carbono, también inorgánica, es el CO2.
El mayor problema de la desnitrificación biológica es la contaminación potencial del agua tratada con: bacterias, fuente de carbono residual (desnitrificación heterótrofa) y la posibilidad de formación de nitritos, lo cual hace necesario un post-tratamiento. A día de hoy, los procesos desarrollados para la desnitrificación biológica son diversos usando distintos sustratos y diferentes configuraciones de reactores. Pero hay que destacar que prácticamente la totalidad de los sistemas de desnitrificación desarrollados se basan en la desnitrificación heterótrofa habiendo un gran vacío en el conocimiento y desarrollo de la desnitrificación autótrofa.
Desnitrificación heterótrofa
La desnitrificación heterótrofa es un proceso biológico de reducción del nitrato presente en las aguas residuales a nitrógeno molecular en condiciones anóxicas por la acción de bacterias heterótrofas (Pseudomonas, Paraccocus, Alcaligenes, Thiobacillus, Bacillus), que usan un sustrato orgánico como fuente de carbono y energía.
En el proceso de desnitrificación existe además la posibilidad de acumulación de intermediarios (NO2–, N2O, NO) debido al tipo y concentración del sustrato empleado o a las condiciones de operación (temperatura, pH, tiempo de residencia hidráulico, tiempo de retención celular). Sobre la base de esto, para que la transformación culmine en N2, deberán controlarse las condiciones ambientales como el nivel de O2 disuelto, la fuente de carbono orgánico, la concentración de nitratos, la relación C/N, la disponibilidad de fósforo, pH, temperatura y posible presencia de tóxicos.6
Una de las reacciones tipo que implica una desnitrificación heterótrofa podría ser la de la oxidación del ácido acético:
1.25 CH3COOH + 2NO3- 2.5CO2 + N2 + 2OH- + 1.5 H2O.
∆Gº´=-1054.8 kJ/ reacción. Ecuación (1)
La desnitrificación heterótrofa es ampliamente aplicada por su alta eficiencia y bajo costo. La tasa de desnitrificación heterotrófica es alta, permitiendo el uso de reactores de poco volumen y bajos costes. Sin embargo el carbón residual de este proceso causa diversos problemas para el tratamiento de aguas potables, lo que convierte a la desnitrificación autótrofa en una buena alternativa.
Desnitrificación autótrofa
Algunas bacterias desnitrificantes son quimiolitoautótrofas y pueden oxidar compuestos inorgánicos de azufre como sulfhídrico (H2S), azufre elemental (S0), tiosulfato(S2O32-) o sulfito(SO32-) anaeróbicamente a expensas de la reducción del nitrato.7 Entre ellas, autótrofos obligados que crezcan a pHs neutros tan solo se conocen dos: Thiobacillus denitrificans y Thiomicrospira denitrificans8 y pueden llevar a cabo la sulfoxidación en condiciones aeróbicas o anóxicas. Recientemente se ha aislado Thioalkalivibrio denitrificans, un autótrofo, oxidador de azufre, capaz de crecer anaeróbicamente usando nitrito como aceptor de electrones a pH básico9
Las ventajas de este proceso respecto a la heterotrofía son varias. Para el tratamiento de aguas residuales, evita tener que añadir materia orgánica, reduciéndose así los costes, y para tratamiento de aguas potables, evita carbono residual en el efluente, ya que reduce el riesgo de sobrecrecimiento en los sistemas a tratar y de desinfección de la zona por los productos producidos debido a que los organismos autotrófos crecen más despacio y producen menos biomasa, con la consiguiente formación de menos productos celulares.10 Además los organismos autótrofos están mejor adaptados para el tratamiento de aguas subterráneas porque crecen a bajas concentraciones de compuestos orgánicos biodegradables. También posee un gran interés comercial y desde el punto de vista de la biotecnología ambiental puesto que es uno de los pocos ejemplos en los que puede oxidarse biológicamente compuestos reducidos del azufre (sulfoxidación) en ausencia de oxígeno elemental. Pero la principal ventaja de este proceso es la aparición de la desnitrificación acoplada a la oxidación de compuestos reducidos del azufre, combinando la eliminación simultánea de dos tipos de contaminantes, los nitratos y los compuestos reducidos del azufre (ecuación 2), teniendo así gran interés por sus aplicaciones biotecnológicas.
Principales parámetros que afectan la desnitrificación
Temperatura
De acuerdo con la literatura, los microorganismos desnitrificantes presentan actividad entre 5 y 75 °C.11 Se ha visto que no existe un cambio significativo en la actividad desnitrificante entre 20 y 30 °C con consorcios provenientes de plantas de tratamiento de aguas residuales.12
PH
El pH óptimo para la desnitrificación se encuentra entre 7 y 8.13 14 A valores de pH debajo de 6, se inhibe la enzima óxido nitroso reductasa y se acumula óxido nitroso.15 16 En la revisión de Cervantes-Carrillo et al. (2000)17 se reporta que en cultivos continuos no se observa ninguna acumulación de intermediarios a pH de 6 a 9, pero el proceso es inhibido en su totalidad a pH de 5.
Oxígeno
Se asume en general que la enzima óxido nitroso reductasa (Nos) es la enzima con una mayor sensibilidad a la presencia de oxígeno. En general las enzimas reductasas son inmediatamente o gradualmente inactivadas por la presencia de oxígeno. La principal razón de la sensibilidad de la desnitrificación a la presencia de oxígeno es la competición por electrones, el oxígeno siendo un aceptor de electrones termodinámicamente más favorable que el nitrato.18
Fuente donadora de electrones
La capacidad que tienen los compuestos orgánicos de donar electrones es uno de los factores más importantes que controlan la actividad heterotrófica y por lo tanto la actividad desnitrificante heterotrófica. Existe una gran variedad de compuestos que pueden ser usados para llevar a cabo la desnitrificación en aguas residuales. Los principales donadores de electrones utilizados son el metanol, el etanol, la glucosa, el acetato, el ácido aspártico y el ácido fórmico, entre otros.19 Esto no implica que solamente sustratos fácilmente degradables sean usados por microorganismos que llevan a cabo la desnitrificación. Existen reportes de desnitrificación con compuestos como hidrocarburos, materia orgánica compleja, glicol, compuestos aromáticos y celulosa.20 21 22 23 Sin embargo, para compuestos poco asimilables como los hidrocarburos y en particular compuestos aromáticos, las velocidades de consumo de estos compuestos representan el paso limitante en la desnitrificación.24 Otro grupo de microorganismos desnitrificantes, los autótrofos, utilizan compuestos inorgánicos como sulfuro, hidrógeno, amonio para reducir nitratos.25 La ganancia energética es menor que con los compuestos orgánicos, pero los microorganismos presentan una gran adaptabilidad dependiendo de las condiciones ambientales de los ecosistemas.26
Relación C/N
La desnitrificación heterotrófica en consorcios está en gran medida determinada por la relación entre el compuesto orgánico donador de electrones y el nitrato (relación C/N). De acuerdo a la literatura, se obtiene un proceso desnitrificante óptimo a relación estequiométrica.27 28 29 Aunque depende del donador de electrones, se puede considerar que con una relación C/N menor a 5, pero superior a la relación estequiométrica, el proceso desnitrificante se lleva a cabo sin limitación; con una relación entre 5 y 21.3 se lleva a cabo la desnitrificación y producción de metano. A relación C/N mayores, se produce metano sin llevarse a cabo la desnitrificación. Lo anterior se debe a que el proceso desnitrificante disminuye y aparece la amonificación, siendo el proceso dominante a relaciones C/N mayores a 51.30
Aplicaciones
En respuesta al problema de la contaminación por nitratos, han surgido diversas tecnologías para eliminarlo del medio tales como intercambio iónico, ósmosis inversa,electrodiálisis y desnitrificación biológica. Entre las diversas alternativas, se prefieren los tratamientos biológicos por su sencillez, selectividad y bajo coste ante los físico-químicos, más caros y con mayor generación de residuos tóxicos.
Algunas de las aplicaciones, reales o potenciales de la desnitrificación autótrofa son:
- Control de problemas de corrosión y olores por sulfídrico en sistemas de alcantarillado mediante la adición de nitrato.31
- Estimulación, mediante adición de nitratos, de la degradación biológica del sulfhídrico en salmueras de campos petrolíferos, reduciendo los problemas asociados a su toxicidad, corrosividad y tendencia a formar metales insolubles de azufre.32
- Tratamiento del biogás o gas natural para eliminar el H2S presente.33
- Eliminación simultánea de N y S en el tratamiento de aguas residuales mediante recirculación de los nitratos resultantes de la fase de nitrificación, a una fase anaerobia, reduciendo los nitratos y oxidando los sulfuros, alcanzando un doble beneficio en una sola etapa.34 Esta aproximación no es solo teórica y ya ha sido ensayada para tratar los efluentes de producción de levaduras.35
- Eliminación de nitratos del agua potable (Darbi et al, 2003) y agua residual (Gommers et al, 1988, Nugroho et al, 2002, Am et al, 2005) usando S˚.
- Eliminación de nitrato de aguas subterráneas mediante la inserción de membranas con hidrógeno y dióxido de carbono (KSHaugen. 2002). o usando un lecho mixto con sulfuro y gránulos de calcita en proporción de volumen 1:1 con Thiobacillus denitrificans.36
En estudios realizados sobre la cinética de la desnitrificación quimiolitótrofa se ha visto que la tasa de desnitrificación y sulfoxidación depende fuertemente de la fuente de S inorgánica usada como dador de electrones resultando ser mejor el tiosulfato, después el sulfhídrico y por último el azufre elemental.(Beristan-Cardoso, 2006).
Un ejemplo es la oxidación del tiosulfato que se ajusta a la siguiente ecuación:
S2O32- + 1.6 NO3- + 0.2 H2O 2 SO42- + 0.8N2 + 0.4 H+
∆Gº´=-765.7 kJ/ reacción. Ecuación (2)
DESNITRIFICACIÓN BIOLÓGICA
| ||
| |
|
No hay comentarios:
Publicar un comentario