Oceanografía química
bomba de solubilidad es un proceso físico-químico que transporta carbono (como carbono inorgánico disuelto) desde la superficie del océano hacia su interior.
Introducción
La bomba de solubilidad funciona por la acción de dos efectos que se dan en el océano:
- La solubilidad del dióxido de carbono es una acusada función inversa de la temperatura superficial marina (la solubilidad es mayor cuanto más fría es el agua)
- La circulación termohalina debida a la formación de agua profunda en altas latitudes, donde el agua de mar normalmente es más fría y densa
Como las aguas profundas se forman desde la superficie en unas condiciones favorables a la solubilidad del dióxido de carbono, contienen una mayor concentración de carbono inorgánico disuelto de lo que podría esperarse sin tener en cuenta tales efectos. Por tanto estos efectos consiguen bombear carbono desde la atmósfera al interior de los océanos.
Las aguas profundas circulan hasta latitudes ecuatoriales, más cálidas, emergen a la superficie, y al disminuir la solubilidad emiten grandes cantidades de dióxido de carbono a la atmósfera.
La bomba de solubilidad tiene una contrapartida biológica, la bomba biológica. Para una introducción a ambas ver Raven & Falkowski (1999).1
Solubilidad del dióxido de carbono
El dióxido de carbono, como otros gases, es soluble en agua. Sin embargo, a diferencia de otros gases como por ejemplo el oxígeno, reacciona con el agua y forma un balance de varias especies iónicas y no iónicas, conocidas colectivamente como carbono inorgánico disuelto. Estas especies son: dióxido de carbono libre disuelto (CO2(aq)), ácido carbónico (H2CO3), bicarbonato (HCO3-) y carbonato (CO32-). Interaccionan con el agua así:
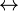 H2CO3
H2CO3 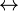 HCO3- + H+
HCO3- + H+ 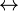 CO32- + 2 H+
CO32- + 2 H+
El balance de estas especies, que afecta en definitiva a la solubilidad del dióxido de carbon, depende de factores tales como el pH. En el agua de mar éste se regula por el balance de carga entre iones positivos (p.e. Na+, K+, Mg2+, Ca2+) y negativos (p.e. el mismo CO32-, Cl-, SO42-, Br-). Normalmente el balance de tales iones deja una carga neta positiva. Esto afecta al balance del sistema de carbonatos, que para compensar se desplaza hacia el lado de los iones negativos. El resultado es una menor concentración de dióxido de carbono libre y de especies carbónicas ácidas, que a su vez conduce a una mayor toma de dióxido de carbono desde la atmósfera para compensar el balance. Por tanto cuanto mayor es el desequilibrio de carga positiva, mayor es la solubilidad del dióxido de carbono. En términos de la química de los carbonatos, a este desequilibrio se le denomina alcalinidad.
Desde el punto de vista de las medidas, hay cuatro parámetros de importancia clave: carbono inorgánico total (CIT, TCO2 o CT), alcalinidad Total (TALK o AT), pH, y pCO2. Midiendo dos cualesquiera de esos parámetros pueden determinarse un amplio rango de especies dependientes del pH (incluyendo las especies mencionadas antes). Este balance puede cambiar por varios procesos. Por ejemplo, el flujo de aire marino del CO2, la disolución/precipitación de CaCO3, o una actividad biológica como la fotosíntesis/respiración. Cada uno de estos procesos tiene diferentes efectos en cada uno de los cuatro parámetros básicos, y juntos ejercen una gran influencia en los ciclos globales. Es importante notar que la carga local neta de los océanos es nula durante cualquier proceso químico.
Cambios Antropogénicos
Los cambios en el uso de la tierra, la combustión de combustibles fósiles y la producción de cemento han generado un flujo de CO2 a la atmósfera. Se estima que, hoy en día, el océano acoge en torno a un tercio (aproximadamente 2 gigatoneladas de carbono al año)2 3 de las emisiones antropogénicas de CO2. La bomba de solubilidad es el mecanismo principal que gobierna este flujo, con la consecuencia de que el CO2 antropogénico llega al interior del océno a través la formación de aguas profundas en altas latitudes, particularmente en el Atlántico Norte. En última instancia la mayoría del CO2 emitido por las actividades humanas se disolverá en el océano,4 pero no está claro el ritmo al que el océano lo asimilará en el futuro.
En un estudio del ciclo del carbono hasta el siglo 21, Cox et al. (2000)5 predicen que el ritmo de asimilación del CO2 empezará a saturarse (alcanzar su máximo) a 5gigatoneladas de carbono por año en el 2100. Esto se debería parcialmente a las no linealidades en el sistema de carbonatos marino, pero también debido al cambio climático. El calentamiento oceánico disminuye la solubilidad del CO2 en el agua de mar, ralentizando la respuesta del océano a las emisiones. El calentamiento también incrementa la estratificación del océano, aislando la superficie de las agus más profundas. Además los cambios en la circulación termohalina de los océanos (específicamentes ralentización)6 puede actuar para disminuir el transporte de CO2 disuelto hacia las profuncidades del océano. Sin embargo la magnitud de estos procesos aún es incierta, impidiendo buenas estimaciuones a largo plazo del destino de la bomba de solubilidad.
Aunque la absorción de CO2 antropogénico desde la atmósfera actúa para disminuir el cambio climático, causa acidificación del océano que se cree tendrá consecuencias negativas para los ecosistemas marinos.
demanda bioquímica de oxígeno (DBO) es un parámetro que mide la cantidad de oxígeno consumido al degradar la materia susceptible de ser consumida uoxidada por medios biológicos que contiene una muestra líquida, disuelta o en suspensión. Se utiliza para medir el grado de contaminación; normalmente se mide transcurridos cinco días de reacción (DBO5) y se expresa en miligramos de oxígeno diatómico por litro (mgO2/l). El método de ensayo se basa en medir el oxígeno consumido por una población microbiana en condiciones en las que se ha inhibido los procesos fotosintéticos de producción de oxígeno en condiciones que favorecen el desarrollo de los microorganismos. La curva de consumo de oxígeno suele ser al principio débil y después se eleva rápidamente hasta un máximo sostenido, bajo la acción de la fase logarítmica de crecimiento de los microorganismos.
Es un método aplicable en aguas continentales (ríos, lagos o acuíferos), aguas negras, aguas pluviales o agua de cualquier otra procedencia que pueda contener una cantidad apreciable de materia orgánica. Este ensayo es muy útil para la apreciación del funcionamiento de las estaciones depuradoras. No es aplicable, sin embargo, a las aguas potables, ya que al tener un contenido tan bajo de materia oxidable la precisión del método no sería adecuada. En este caso se utiliza el método deoxidabilidad con permanganato potásico.
Según McKinney (1962), «El test de la DBO fue propuesto por el hecho de que en Inglaterra ningún curso de agua demora más de cinco días en desaguar (desde nacimiento a desembocadura). Así la DBO es la demanda máxima de oxígeno que podrá ser necesario para un curso de agua inglés».
El método pretende medir, en principio, exclusivamente la concentración de contaminantes orgánicos. Sin embargo, la oxidación de la materia orgánica no es la única causa del fenómeno, sino que también intervienen la oxidación de nitritos y de las sales amoniacales, susceptibles de ser también oxidadas por las bacterias en disolución. Para evitar este hecho se añade N-aliltiourea como inhibidor. Además, influyen las necesidades de oxígeno originadas por los fenómenos de asimilación y de formación de nuevas células.
También se producen variaciones significativas según las especies de gérmenes, concentración de estos y su edad, presencia de bacterias nitrificantes y de protozoosconsumidores propios de oxígeno que se nutren de las bacterias, entre otras causas. Es por todo esto que este test ha sido constantemente objeto de discusión: sus dificultades de aplicación, interpretación de los resultados y reproductibilidad se deben al carácter biológico del método.
Procedimiento de ensayo (método por dilución)
El objeto del ensayo consiste en medir la cantidad de oxígeno diatómico disuelto en un medio de incubación al comienzo y al final de un período de cinco días, durante el cual la muestra se mantiene al abrigo del aire, a 20 °C y en la oscuridad, para inhibir la eventual formación de oxígeno por las algas mediante fotosíntesis. Las condiciones de la medida, en las que el agua a estudiar está en equilibrio con una atmósfera cuya presión y concentración en oxígeno permanecen constantes, se acercan así a las condiciones reales de la autodepuración de un agua residual.
Para su determinación se dispone de métodos de dilución (el que se explica a continuación) y métodos instrumentales que se derivan de métodos respirométricos que permiten seguir automáticamente la evolución de la DBO en el curso de oxidación de las materias orgánicas contenidas en el agua.
Reactivos
- Agua destilada
- Agua residual urbana reciente
- Solución fosfatos:
- Monohidrógenofosfato de sodio: 8,493 g
- Dihidrogenofosfato de potasio: 2,785 g
- Agua destilada hasta enrase a 1000 ml
Homogeneizar perfectamente la solución:
- Solución de sulfato de magnesio de 20 g/l
- Solución de cloruro de calcio de 25 g/l
- Solución de cloruro de hierro de 1,5 g/l
- Solución de cloruro de amonio de 2 g/l
Preparación del agua de dilución. Se prepara a partir de agua destilada introduciendo en un recipiente:
- Solución de fosfato…………………………5 ml
- Solución de sulfato magnésico…………1 ml
- Solución de cloruro cálcico………………1 ml
- Solución de cloruro de hierro…………1 ml
- Solución de cloruro amónico……………1 ml
- Agua destilada hasta enrase a 1000 ml
Esta solución se mantiene a 20 °C y debe de airearse procurando evitar toda contaminación por metales, materias orgánicas, oxidantes o reductores. Se detendrá la aireación cuando la solución contenga 8 mg/l de oxígeno disuelto. Dejar en reposo durante 12 horas manteniendo el recipiente destapado. Añadir 5 ml de agua residual urbana por litro de esta solución. (Esta agua de dilución, deberá utilizarse dentro de las 24 horas siguientes a su preparación).
Procedimiento
La técnica utilizada de medición es la siguiente: Se introduce un volumen definido de la muestra líquida en un recipiente opaco que evite que la luz pueda introducirse en su interior (se eliminarán de esta forma las posibles reacciones fotosintéticas generadoras de gases), se introduce un agitador magnético en su interior, y se tapa la boca de la botella con un capuchón de goma en el que se introducen algunas lentejas de sosa. Se cierra la botella con un sensor piezoeléctrico, y se introduce en una estufa refrigerada a 20 °C.
Las bacterias irán oxidando la materia orgánica del interior de la disolución, con el consecuente gasto de oxígeno del interior de la botella. Estas bacterias, debido al proceso de respiración, emitirán dióxido de carbono que será absorbido por las lentejas de sosa. Este proceso provoca una disminución interior de la presión atmosférica, que será medida con el sensor piezoelétrico.
En detalle:
- Introducir un volumen conocido de agua a analizar en un matraz aforado y completar con el agua de dilución.
- Verificar que el pH se encuentra entre 6-8. ( En caso contrario, preparar una nueva dilución llevando el pH a un valor próximo a 7 y después ajustar el volumen)
- Llenar completamente un frasco con esta solución y taparlo sin que entren burbujas de aire.
- Preparar una serie de diluciones sucesivas.
- Conservar los frascos a 20 °C ± 1 °C y en la oscuridad.
- Medir el oxígeno disuelto subsistente al cabo de 5 días.
- Practicar un ensayo testigo determinando el oxígeno disuelto en el agua de dilución y tratar dos matraces llenos de esta agua como se indicó anteriormente.
- Determinar el oxígeno disuelto.
En el curso del ensayo testigo, el consumo de oxígeno debe situarse entre 0,5 y 1,5 g/l. En el caso contrario, la inoulación con el agua destilada no es conveniente y se necesitará modificar la preparación. Para la determinación de oxígeno disuelto (OD) se puede emplear cualquiera de los dos métodos establecidos en la norma mexicana NMX-AA-012-SCFI.
Expresión de los resultados
-
-
- DBO= F (To-T5)-(F-1)(D0-D5)
-
Donde:
-
- D0 = Contenido de oxígeno (mg/l) del agua de dilución al principio del ensayo.
- D5 = Contenido medio de oxígeno (mg/l) del agua de dilución al cabo de 5 días de incubación.
- T0 = Contenido de oxígeno (mg/l) de una de las diluciones de la muestra al principio del ensayo.
- T5 = Contenido de oxígeno (mg/l) de una de las diluciones de la muestra al cabo de 5 días de incubación.
- F = Factor de dilución.
Valores por encima de 30 mgO2/litro pueden ser indicativos de contaminación en aguas continentales, aunque las aguas residuales pueden alcanzar una DBO de miles de mgO2/litro.
No hay comentarios:
Publicar un comentario