La 2'-O-metilación es una modificación de los nucleósidos en el ARN, en la cual se añade un grupo metilo al grupo 2'-hidroxilo de la ribosa del nucleósido. Los nucleósidos con 2'-O-metilación se encuentran fundamentalmente en regiones funcionalmente esenciales tanto de los ribosomas como del espliceosoma.1 Además, la 2'-O-metilación de la adenosina en el ARN evita su edición a inosina por parte de la adenosina desaminasa.
acetilación (o etanoilación, según la nomenclatura de la IUPAC) consiste en una reacción que introduce un grupo acetilo en un compuesto químico. La deacetilación consiste en lo contrario, es decir, en la eliminación de un grupo acetilo. Este proceso de transferencia del grupo acetilo (que resulta en un grupo acetoxi) a un compuesto, para ser específico, debe implicar la sustitución del grupo acetilo por un átomo de hidrógeno. Una reacción que implique la sustitución de dicho átomo de hidrógeno de un grupo hidroxilo con un grupo acetilo (CH3CO) genera un éster específico, elacetato. El anhídrido acético es comúnmente usado como agente de acetilación con grupos hidroxilo libres. Por ejemplo, es utilizado en la síntesis de aspirina y de heroína.
Acetilación de proteínas
En las células vivas la acetilación se produce como una modificación co-traduccional o postraduccional de las proteínas, como ocurre por ejemplo con las histonas, la proteína p53 o las tubulinas.
Acetilación N-alfa-terminal
La acetilación del alfa-amino N-terminal de las proteínas es una modificación postraduccional muy común en eucariotas.1 El 40-50% de las proteínas de levadura y el 80-90% de las proteínas humanas pueden sufrir modificaciones de este tipo, manteniéndose conservado el patrón de modificación a lo largo de la evolución. Este tipo de modificación es llevado a cabo por enzimas N-alfa-acetiltransferasas (NATs), una subfamilia de la superfamilia GNAT de acetiltransferasas donde se incluyen lashistona acetiltransferasas. Las GNATs transfieren el grupo acetilo desde una molécula de acetil-CoA a un grupo amino. Las NATs han sido extensamente estudiadas en levaduras, habiéndose encontrado tres complejos NAT, NatA/B/C, implicados en acetilaciones del tipo N-alfa-terminal. Se caracterizan por poseer especificidad de secuencia para sus sustratos y por ser capaces de asociarse posiblemente con el ribosoma, donde podrían acetilar a las cadenas polipeptídicas en formación durante el proceso de traducción.2 En humanos se han identificado y caracterizado los complejos NatA y NatB. Ciertas subunidades del complejo NatA humano han sido asociadas a procesos relacionados con el cáncer, tales como la respuesta a hipoxia y la ruta de beta-catenina. También se han encontrado altos niveles de NatA encáncer papilar tiroideo y en neuroblastoma. El complejo NatB humano se ha asociado al ciclo celular. La subunidad hNat3 del complejo hNatB se ha encontrado a elevados niveles en algunos tipos de cáncer. A pesar de ser una modificación muy común y muy conservada, no se conoce mucho acerca del papel biológico de la acetilación N-alfa-terminal. No obstante, con el fin de tener una idea de la importancia potencial de este tipo de modificaciones, cabe destacar el caso de proteínas tales como la actina y la tropomiosina, las cuales han resultado ser dependientes de acetilación por NatB para formar los filamentos de actina.
Acetilación y deacetilación de lisinas
Los residuos de lisina de las histonas son acetilados y deacetilados en el extremo N-terminal como parte del proceso de regulación génica. Estas reacciones suelen ser catalizadas por enzimas con actividad histona acetiltransferasa (HAT) o histona deacetilasa (HDAC), aunque hay que señalar que tanto las HATs como las HDACs pueden modificar también el grado de acetilación de proteínas no histonas.3
La regulación de factores de transcripción, proteínas efectoras, chaperonas y proteínas del citoesqueleto por medio de reacciones de acetilación/deacetilación está emergiendo como un importante mecanismo de regulación postraduccional análogo al proceso de fosforilación por la acción de proteína quinasas o de defosforilación mediado por fosfatasas.4 De hecho, estudios recientes sugieren que, además de la modificación de la actividad de una proteína sobre la base de su estado de acetilación, esta modificación postraduccional presenta regulación cruzada con otras reacciones como la fosforilación, la metilación, la ubiquitinación, la sumoilación y otras, con el fin de permitir un control más dinámico de la señalización celular.5
El sistema de acetilación/deacetilación de tubulina es bien conocido en Chlamydomonas. Una tubulina acetiltransferasa situada en el axonema acetila específicamente residuos de lisina de la subunidad de α-tubulina en el ensamblaje del microtúbulo. Una vez desensamblado, esta acetilación puede ser eliminada por otra deacetilasa específica citosólica. Por ello, los microtúbulos del axonema, que tienen una vida media larga, presentan la acetilación, a diferencia de los microtúbulos citosólicos, que no la presentan, al poseer una vida media corta.
La Acetilación es una reacción química que se llama ethanoylation en la nomenclatura de IUPAC. Describe una reacción que introduzca un grupo funcional del acetilo en una pasta química. La reacción química opuesta se llama deacetylation - es el retiro del grupo del acetilo.
El proceso de introducir un grupo del acetilo da lugar a un grupo del acetoxy. Implica la substitución de un grupo del acetilo para un átomo de hidrógeno activo. Una reacción que implica el repuesto del átomo de hidrógeno de un grupo de oxhidrilo con un grupo del acetilo (CH3 CO) entonces rendiría un éster específico, el acetato.
¿Qué proteínas experimentan la acetilación?
La mayor parte de las proteínas en el cuerpo humano experimentan la acetilación. El proceso de la acetilación es importante para varias reacciones químicas importantes en el cuerpo. Esto incluye: -
- Formación De Proteínas.
- Biotransformación de la Droga - muchas drogas son tramitadas en el cuerpo con la reacción de la acetilación, por la biotransformación en un compuesto efectivo o ser metabolizado en las substancias que el cuerpo puede excretar de una manera más simple.
- Regla del ácido desoxirribonucléico (DNA) y de otros elementos genéticos usando la acetilación de la histona. Las Proteínas que la DNA replegada y la reparación dañaron el material genético son creadas directamente por la acetilación. La Acetilación también ayuda en la transcripción de la DNA. La Acetilación determina la energía que las proteínas utilizan durante la duplicación y ésta determina la exactitud de copiar los genes. Las zonas erróneas mientras que copian la DNA son quitadas por las proteínas y los segmentos se asocian más adelante. Los pedazos Menos defectuosos se pueden permitir permanecer mientras que se quitan los más dañados. Hay una manera que la acetilación es accionada por las proteínas celulares. Cuando la reacción comienza, las substancias químicas se agregan a las proteínas DNA-que controlan.
- Reacciones accionadas por las acetiltransferasas que pueden llevar al cáncer y a otras enfermedades.
N-alfa-Acetiltransferasas
ayuda de las N-alfa-Acetiltransferasas en reacciones de la acetilación de la mediación. Hay tres variedades comunes de estas enzimas. Éstos etiqueta A, B, y C y acto dentro de las células para transferir las moléculas. También controlan las proteínas que aumentan las estructuras celulares.
La acilación de Kostanecki es un método utilizado en síntesis orgánica para formar cromonas o cumarinas por acilación de o-hidroxifenonas con anhídridos de ácidos alifáticos.:1
Mecanismo
1) El fenol es acilado en el oxígeno con formación de un intermediario tetraédrico para formar el éster correspondiente.
2) El grupo acilo tautomeriza a la forma enólica, la cual se condensa con la cetona orto para formar el aducto correspondiente, la 4-hidroxidihidrocumarina. La otra alternativa es que la condensación se lleve a cabo desde el carbono 1 del radical alquilo de la fenona hacia el carbonilo del éster formado. Esta opción produce la 2-hidroxidihidro-4-cromona.
3) El grupo hidroxilo formado se elimina para formar la cromona o la cumarina.

acilación (raramente, pero más formalmente: alcanoilación) es el proceso de agregar un grupo acilo a un compuesto. El compuesto que provee el grupo acilo es denominado el grupo acilante.
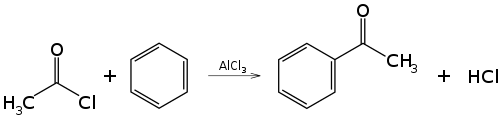
Debido a que forman electrófilos fuertes cuando son tratados con algún metal, los halogenuros de acilo son usados comúnmente como agentes acilantes. Por ejemplo, laacilación de Friedel-Crafts utiliza cloruro de acetilo, CH3COCl, como el agente acilante, y cloruro de aluminio (AlCl3) como catalizador para agregar un grupo etanoílo (acetilo) al benceno:
El mecanismo de esta reacción es la sustitución electrofílica aromática.
Los halogenuros de acilo y anhídridos de ácido son también usados comúnmente como agentes acilantes para acilar aminas para formar amidas o acilar alcoholes para formar ésteres. Las aminas y los alcoholes son nucleófilos. El ácido succínico también es usado comúnmente para un tipo específico de acilación denominadosuccinación.
Un uso industrial de la acilación es en la síntesis de aspirina, en la que el ácido salicílico es acilado por el anhídrido acético.


No hay comentarios:
Publicar un comentario