desalquilación o dealquilación es el proceso químico por el cual se suprime el radical alquilo de una molécula. Si el grupo alquilo va unido a un átomo de oxígeno, se llama O-desalquilación, N-desalquilación si va unido a un átomo de nitrógeno y S-desalquilación si es de azufre. La alquilación tiene importacia en farmacología, por constituir una de las vías habituales debiotransformación de fármacos. El proceso inverso a la desalquilación es la alquilación que consiste en añadir un grupo alquilo a una molécula.1
Desalquilación oxidativa
- N-desalquilación. R-CH2-CH2-NH-CH3 + O → R-CH2-CH2-NH2 + HCHO
- O-desalquilación. R-CH2-CH2-O-CH3 + O → R-CH2-CH2-OH + HCHO
Descarboxilación de Barton es una reacción orgánica en la que previamente un ácido carboxílico se convierte en una 1-aciloxipiridina (Funcionalmente es un éster hidroxámico comúnmente conocido como éster de Barton). El producto se calienta en presencia de un iniciador de radicales y un donante de hidrógeno apropiado para completar la descarboxilación reductiva del ácidos carboxílico inicial.1 2Esta reacción permite extraer el grupo carboxilo de un ácido de tal manera que el grupo alquilo sea sustituido con otros grupos funcionales.3 4 (ver esquema 1) Esta reacción debe su nombre al químico británico y Premio Nobel Derek Barton (1918-1998).
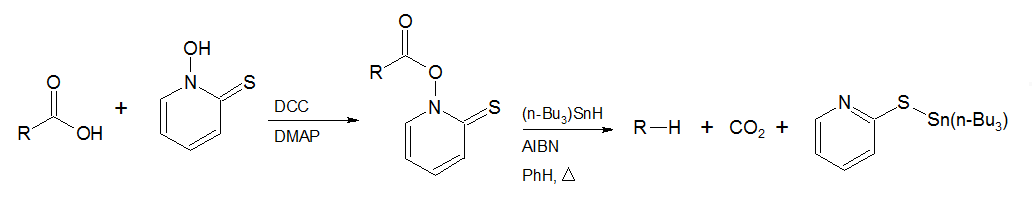
Mecanismo
La reacción es iniciada por la ruptura homolítica del iniciador de radicales, en este caso el 2,2'-azobisisobutironitrilo (AIBN), aplicando calor. A continuación, el hidrógeno es abstraído de hidruro de tri-n-butilestaño para obtener un radical libre de tri-n-butilestaño que ataca al átomo de azufre del éster de Barton. El enlace nitrógeno-oxígeno del éster hidroxámico es escindido para formar dióxido de carbono, el 2-piridinilsulfuro de tributilestaño y un radical libre de alquilo. El radical alquilo (R·), abstrae un átomo de hidrógeno a partir del hidruro de tri-n-butilestaño para formar el alcano reducido (HR). (Véase el esquema 2) El radical tributilestaño entra en otro ciclo de la reacción hasta que todos los ésteres de Barton se consumen. La ruptura del enlace nitrógeno-oxígeno del éster de Barton también puede ocurrir espontáneamente por calentamiento o por irradiación con luz para iniciar la reacción. También es posible enlazar funciones orgánicas al radical alquilo por el uso de otras especies formadas de la ruptura (XY + R· → RX + Y·)5 La reacción se produce debido a la formación del enlace estable de estaño-azufre (S-Sn) y por la aromatización del anillo de quinolina. También hay un aumento general de entropía debido a la formación de los 3 productos a partir de dos sustratos que dirige la reacción hacia la derecha.

descarboxilación de Krapcho es una reacción orgánica en donde un éster se decarboxila en presencia de halogenuros metálicos, de solventes dipolares apróticos y calor.
Para que la reacción proceda, el éster debe contener un grupo electroatractor en la posición beta, tales como β-cetoésteres, ésteres malónicos, α-cianoésteres, o α-sulfonilésteres. Los ésteres óptimos son los metílicos y etílicos, debido a que la reacción procede por un mecanismo SN2. La reacción es termodinámicamente favorable, debido al aumento de entropía de los productos, los cuales son gases. (MeCl y CO2). Esta reacción es un procedimiento sintético útil para descarboxilar ésteres malónicos.
desmetilación es una reacción química caracterizada por la eliminación de un grupo metilo (-CH3) de una molécula. En los sistemas bioquímicos, el proceso de desmetilación a menudo es catalizado por una enzima, como es el caso de la familia de enzimas del hígado citocromo P450.1
Las proteínas son también desmetiladas, por lo general en sus residuos lisina. A menudo ocurre por la oxidación de un sustituyente metilo convirtiéndolo en un grupometileno (=CH2), el cual puede luego ser hidrolizado para formar una formaldehído (H2C=O).
La diazotización ( del prefijo di-, separar, y azote, nitrógeno en francés) es el proceso químico mediante el cual una amina aromática primaria rompe su cadena ciclica para convertirse en un compuesto de diazonio. La preparación y reacciones de las sales de diazonio se identificaron por primera vez en 1858 y fueron la base de los tintes sintéticos y varias mas industrias químicas en Europa. En la diazotización, se añade nitrito de sodio a una disolución de amina en una solución acuosa ácida a 5°C. El amino reacciona con el nitrito de sodio dando lugar a una nitrosamina.
La reacción en general es simple y muy general. Sustitutos de todos tipos, como alquilos, halógenos, hidroxilos, ácidos sulfónicos, pueden presentarse en cualquier posición del compuesto. Aminas heterocíclicas, como las aminopiridinas pueden ser también diazotizadas.
dihidroxilación asimétrica de Sharpless, también conocida como bishidroxilación, llamada así en honor del químico estadounidense K. Barry Sharpless, es unareacción química enantioselectiva de alquenos con tetróxido de osmio en presencia de un ligando de quinina quiral para formar un diol vecinal.1 2 3
Normalmente se produce esta reacción usando cantidades catalíticas de tetróxido de osmio, que después de la reacción es regenerado bien con ferricianina de potasio4 5o N-metilmorfolina N-óxido.6 7 Estas condiciones reducen drásticamente las cantidades necesarias de tetróxido, un compuesto altamente tóxico y oneroso. Los cuatro reactivos son comerciales y se pueden obtener bajo el nombre «AD-mix». La mezcla que contiene (DHQ)2-PHAL se denomina AD-mix-α, mientras que la mezcla que contiene (DHQD)2-PHAL se denomina AD-mix-β.
Mecanismo de la reacción
El mecanismo de la dihidroxilación asimétrica de Sharpless comienza con la formación del complejo tetróxido de osmio-ligando (2). Una cicloadición [3+2] con el alqueno (3) conduce al intermediario cíclico 4.9 10 La posterior hidrólisis básica libera el diol (5) y el osmiato reducido (6). Finalmente, el oxidante añadido en cantidades estequiométricas regenera el complejo tetróxido de osmio-ligando (2).
Aplicaciones
La dihidroxilación clásica, en presencia de un catalizador quiral, necesita osmio.1 2 3 La dihidroxilación asimétrica de Sharpless reduce drásticamente el coste de este procedimiento, abriendo el campo de reacciones orgánicas que incluyen osmiatos simpatéticos y biomiméticos.
Ejemplos
El primer paso en la síntesis del aza-azúcar 6 es una reacción de dihidroxilación11 del dieno proquiral 1. Los aza-azúcares son compuestos de gran importancia farmacológica. Toda la reacción se realiza en medio acuoso y no es necesario añadir grupos protectores. El paso 2 consiste, además, en una sustitución nucleófila del derivado bromado quimioselectiva por parte del hidroxilo.
La dihidroxilación asimétrica de Sharpless es también un paso clave en la síntesis total del taxol de Kuwajima.



No hay comentarios:
Publicar un comentario