anelación (o anulación) de Robinson es una reacción orgánica usada para la síntesis de ciclohexenonas (un anillo de seis miembros con una cetona α,β-insaturada) partiendo de una cetona y metil vinil cetona. Debe su nombre al químico británico que la descubrió, Sir Robert Robinson (Universidad de Oxford).1
Ha encontrado una importante aplicación en la síntesis de productos naturales, en particular en la síntesis de compuestos policíclicos.
Mecanismo de reacción
La participación de la metil vinil cetona (o derivados) es esencial ya que simultáneamente es un aceptor de Michael y capaz a continuación de tomar parte en unacondensación aldólica. La primera etapa en la anelación de Robinson es una adición de Michael seguida de una condensación aldólica para formar la ciclohexenona deseada.
Reacción de Wichterle
La reacción de Wichterle es una variante de la anulación de Robinson que reemplaza la metil vinil cetona con 1,3-dicloro-cis-2-buteno.2 3 4
anillación o ciclización de Danheiser es una reacción orgánica en donde se obtiene un trialquilsililciclopenteno en una ciclización regiocontrolada por la acción de una cetona α, β-insaturada y un trialquilsililaleno (por ejemplo, trimetilsilil o triisopropilsililoxifurano) en presencia de un ácido de Lewis.1 2 3 4 5 6
reacción de Appel es una reacción orgánica que transforma un alcohol en un cloruro de alquilo, utilizando trifenilfosfina y tetracloruro de carbono.1
La reacción de Appel es un método de halogenación en condiciones suaves, y puede llevarse a cabo con alcoholes primarios, secundarios y terciarios. El uso detetrabromuro de carbono o bromo elemental produce bromuros de alquilo, obteniendo resultados homólogos para yoduros.
Mecanismo de reacción
El método consta de cuatro pasos:
- 1. La formación de la sal triclorometiluro de clorotrifenilfosfonio (2).
- 2. Deprotonación de el alcohol, donde se forma un anión alcóxido, que funciona como contraión del catión clorotrifenilfosfonio (3,4)
- 3. La sustitución nucleofílica del cloro por el alcóxido, dando como producto el cloruro de alcoxitrifenilfosfonio (5).
- 4. Los alcoholes primarios y secundarios reaccionan con el cloruro vía SN2 (6) y el óxido de trifenilfosfina (7). Los alcoholes terciarios reacciónan por un mecanismo SN1.
La formación del óxido de trifenilfosfina provee la fuerza motriz de la reacción, en donde el óxido de trifenilfosfina presenta una fase sólida independiente de la mezcla de reacción, de acuerdo al Principio de Le Châtelier.
Un ejemplo de la aplicación de esta reacción es la cloración del geraniol a cloruro de geranilo.,
Oxidación de Baeyer-Villiger (BMVO) es una reacción orgánica en la que se oxida una cetona para obtener un éster por tratamiento con peroxoácidos o peróxido de hidrógeno.1 2 Las principales características de la oxidación de Baeyer-Villiger son su estereoespecificidad y su regioquímica.3 Esta reacción toma el nombre de dos químicos, el alemán Johann Friedrich Wilhelm Adolf von Baeyer (1835-1917) y el químico suizo Victor Villiger (1868-1934).4
Los reactivos normalmente empleados para llevar a cabo esta reacción son el ácido m-cloroperoxibenzoico (MCPBA), el ácido peracético, o el ácido peroxitrifluoroacético.5 El reactivo original en la publicación de 1899 es el ácido de Caro descubierto un año antes.6 Para evitar transesterificación o hidrólisis se añade con frecuencia un agente tampón (Buffer) para evitar transesterificación o hidrólisis. Los más comunes son los de fosfato sódico y bicarbonato de sodio.
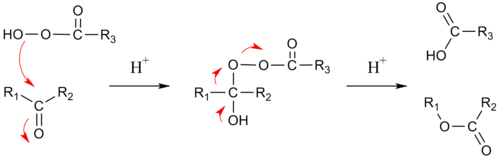
Mecanismo
El mecanismo de reacción de esta ruptura oxidativa consta de dos pasos:
- 1) La adición del grupo peróxido al carbonilo, con formación de un intermediario tetraédrico.7
- 2) La migración concertada de uno de los carbonos adyacentes al oxígeno con la pérdida de un ácido carboxílico (en el caso de utilizar un peroxoácido), o un alcohol (si se utiliza hidroperóxido). Si la migración de carbono es quiral, la estereoquímica se conserva.
- Aptitudes migratorias: H > Alquilo terciario > ciclohexilo > alquilo secundario, arilo > alquilo primario > metilo
En el estado de transición para el segundo paso, el ángulo diedro R-C-O-O debe ser de 180 ° con el fin de maximizar la interacción entre el enlace sigma R-C y elenlace sigma antienlazante del O-O. Este paso también es asistido por dos o tres unidades de peroxiácido que promueven que el protón del hidroxilo de transporte a su nueva posición.7
Para cetonas asimétricas, el grupo que migra es generalmente el que puede estabilizar más la carga positiva. Las cetonas endocíclicas, aun las tensionadas (Por ejemplo,ciclobutanonas, norbornanonas) reaccionan con el peróxido de hidrógeno u otros hidroperóxidos para formar lactonas. Los aldehídos suelen producir ácidos carboxílicos, aunque los formiatos también se puede formar si el grupo que migra es un alquilo terciario, un grupo vinilo rico en electrones o un anillo aromático (reacción de Dakin). A veces el alcohol se forma cuando el formiato es inestable al disolverse en agua.
Oxidación de Baeyer-Villiger biológica
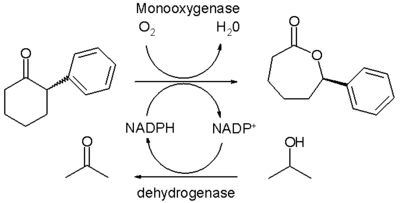
La oxidación de Baeyer-Villiger también puede ser realizada por biocatálisis por la acción de la enzima Baeyer-Villiger monooxigenasa o BVMO. Se han investigado técnicas experimentales para utilizar esta enzima de modo que se siga conservando la enantioselectividad y el rendimiento en en estas reacciones con menor producción de desechos tóxicos (Véase química verde). Las principales dificultades son el confinamiento en el agua como medio de reacción, la especificidad de sustrato, la dependencia de la estequiométrica, además de los costes de los cofactores como el NADPH y los costos asociadas a BVMO debido a los largos pasos de purificación que se requieren. Oxidaciones in vivo con células microbianas metabólicamente activas presentan complicaciones por su cuenta.
En un estudio,8 la purificación de las enzimas es dirigida y la monooxigenasa especial es termoestable y aislada de una cepa específica de E. coli. Esta enzima convierte la 2-fenilciclohexanona racémica en presencia de oxígeno para dar su correspondiente (R)-lactona con un rendimiento químico del 50% y 94% de exceso enantiomérico en un sistema bifásico de agua y hexano. El cofactor NADPH se regenera en cada ciclo catalítico por la acción de una segunda enzima deshidrogenasa como catalizador de sacrificio que consume el isopropanol. La solubilidad del reactivo orgánico y el producto es baja en la fase acuosa evitando así la inhibición.








No hay comentarios:
Publicar un comentario