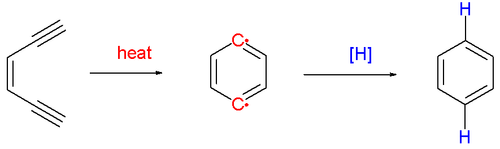
ciclación de Bergman o cicloaromatización de Bergman es una reacción orgánica que da lugar cuando un enodiino se calienta en presencia de un donante de hidrógeno adecuado (esquema 1).1 Fue descrita por primera vez por el químico estadounidense Robert George Bergman (n. 1942). El producto de la reacción es un derivado del benceno.
La reacción procede por una pirólisis (por encima de 200 ° C) formando un 1,4-dideshidrobenceno de corta duración y muy reactivo. Este intermediario reacciona con un donante de hidrógeno, por ejemplo 1,4-ciclohexadieno, que se convierte en benceno. Si a la reacción se le añade tetracloruro de carbono, el producto de la reacción es 1,4-diclorobenceno, y si se detiene con metanol, el producto es alcohol bencílico.
Cuando el enodiino es endocíclico en un ciclo grande, por ejemplo en el caso del ciclodeca-3-eno-1,5-diino en el esquema 2 (10 miembros), debido a la baja tensión de los enlaces en el reactivo, la reacción es posible a una temperatura mucho más baja (37 ° C).
Existen compuestos de origen natural, tales como la caliqueamicina, que contienen el mismo anillo de 10 miembros y se ha encontrado que son citotóxicos. Estos compuestos generan el birradical intermedio descrito anteriormente que puede causar cortes en cadenas simples o dobles de ADN. Hay medicamentos novedosos que tratan de hacer uso de esta propiedad, incluyendo anticuerpos monoclonales, por ejemplo el Mylotarg.2
Un mecanismo de formación de birradicales es propuesto para la formación de ciertas biomoléculas que se encuentran en los esporólidos (Presentes en la bacteria marina Salinispora tropica), los cuales presentan un sustituyente de clorofenilo como parte de su estructura. En este mecanismo, un cloruro inorgánico (como cloruro de sodio o cloruro de magnesio) proporciona el halógeno.
Una reacción homóloga a la anterior se lleva a cabo con el ciclodeca-3-eno-1,5-diino, bromuro de litio como fuente de halógeno y ácido acético como fuente de hidrógeno, empleándose DMSO como solvente a 37 °C. Esta reacción apoya la teoría de la biosíntesis del anillo clorobencénico.3 4
Se ha encontrado que la reacción es de primer orden para el enodiino, con la formación de A (1,4-dideshidrobenceno) como el paso determinante de la reacción. Los iones halogenuro donan sus dos electrones en la formación de un nuevo enlace Br-C y se cree que los electrones de los radicales implicados se convierten en un enlacetransitorio C1-C4 formando el anión B. Dicho anión es una base huy fuerte, desprotonando incluso al DMSO, hasta llegar al producto final. El dibromuro o la dihidrotetralona nunca se forman.
La reacción de ciclación Bergman o Bergman, llamado así por el químico estadounidense Robert Bergman, es una reacción de transposición de la química orgánica de enediyne un radical derivado de benceno.
La reacción procede por pirólisis para formar un compuesto benzenediyl 1,4-di-radical, las especies altamente reactivas. Este último reacciona con el dador de radicales de hidrógeno, tales como ciclohexa-1,4-dieno, para dar el correspondiente arena. Mediante el tratamiento con tetracloruro de carbono se obtiene el 1,4-diclorobenceno, y con metanol, alcohol bencílico.
Cuando el enino es parte de un anillo de 10-carbono, la reacción puede llevarse a cabo a temperaturas mucho más bajas con el ciclo de la tensión.
Los compuestos naturales tales como caliqueamicina contienen el mismo patrón cíclico a 10 carbonos y son citotóxicos. Generan a través de dirradical descrito anteriormente, que puede cortar el ADN de una sola hebra y de doble hebra. Hay nuevos fármacos basados en esta propiedad, incluyendo los anticuerpos monoclonales como Mylotarg.
Se propone un mecanismo dirradical para la formación de ciertas biomoléculas marinos, los sporolides que contienen un cholorobenzène en su estructura.
En este mecanismo, una sal de haluro es la fuente de halógeno. Una reacción modelo con ciclodeca-1,5-diyn-3-eno, de litio como la fuente de bromuro de halógeno, ácido acético como fuente de hidrógeno en DMSO a 37 ° C hace que esta teoría viable:
La reacción es de primer orden en el enediyne con la formación de p-Bencino A como etapa limitante. El ion haluro a continuación, da dos electrones durante la formación del nuevo enlace C-Br y los tránsitos de electrones radicales través de un enlace fugitivo C1-C4 para formar el anión intermedio B. Este anión es una base fuerte capaz de extraer incluso protones DMSO para dar el producto final. No se observa la formación de compuestos dibromados o dihidrógeno.
ciclación de Volhard-Erdmann es una síntesis orgánica de tiofenos de alquilo y de arilo, por ciclación de succinato disódico u otros compuestos 1,4-difuncionales (ácidos γ-oxo, 1,4-dicetonas, ésteres de cloroacetilo sustituidos) con heptasulfuro de fósforo. Es llamada así en honor de Jacob Volhard y Hugo Erdmann.1
Ejemplos
Un ejemplo de ciclación de Volhard-Erdmann es la síntesis de 3-metiltiofeno a partir del ácido itacónico:2




No hay comentarios:
Publicar un comentario