halogenación de cetonas es un tipo especial de halogenación, o sea, la reacción de adición de un halógeno a una cetona.
Productos formados
En disolución básica
La posición alfa (siguiente) respecto del grupo carbonilo en una cetona se halogena fácilmente, debido a la capacidad de formar un enolato en disolución básica, o unenol en disolución ácida. Un ejemplo es la bromación de la acetona en disolución básica:1 Esta reacción fue estudiada en 1904 por Arthur Lapworth, en la Universidad de Mánchester.


La velocidad de reacción depende de la concentración de acetona y de base, pero no de la concentración de bromo.2
La reacción catalizada por bases transcurre tan rápidamente que sólo es posible aislar el compuesto trisustituido, la 1,1,1-tribromoacetona.
En disolución ácida
En disolución ácida, por lo general sólo un hidrógeno en posición alfa es sustituido por un halógeno, ya que cada halogenación sucesiva es más lenta que la primera. El átomo de halógeno disminuye la basicidad del oxígeno del carbonilo, haciendo menos probable la protonación. Sin embargo, en disolución básica, las halogenaciones sucesivas son cada vez más rápidas, ya que el halógeno atrae electrones por inducción y los restantes hidrógenos se hacen más ácidos. En el caso de las metilcetonas , el resultado es lo que se llama la reacción del haloformo.3
Las cetonas monosustituidas se emplean como gases lacrimógenos y en síntesis de heterociclos.
halogenación de Hell-Volhard-Zelinsky, es una reacción de sustitución en la que átomos de hidrógeno unidos al carbono α de un ácido carboxílico son sustituidos por átomos de halógeno. La reacción es llamada así por los químicos alemanes Carl Magnus Von Hell, Jacob Volhard y el ruso Nikolay Zelinsky.1 2 3 4
El PBr3 sustituye el hidroxilo (OH) del grupo carboxílico con un bromuro, resultando en un bromuro de ácido carboxílico.
El enol reacciona rápidamente con el Br2 halogenando por segunda vez en la posición del carbono alfa.
En solución neutra acuosa o levemente ácida, la hidrólisis del bromuro de α-bromo acilo ocurre espontáneamente, dando como producto el α-bromo ácido carboxílico en un tipo de reacción de sustitución nucleófila acílica.
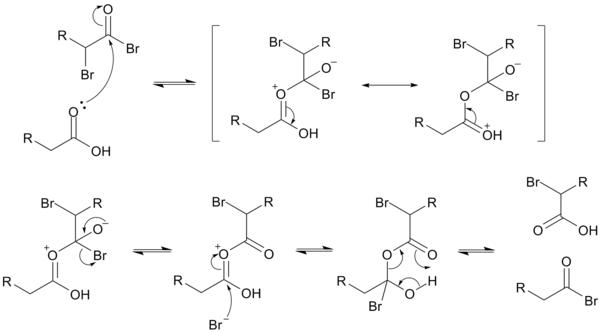
Mecanismo
Además de las cuatro fases ya vistas (formación del haluro de acilo, enolización, halogenación e hidrólisis), el mecanismo es algo más complejo, con más estados intermedios, como se muestra en los siguientes diagramas que explican el ataque de losdifrentes reactivos y la reorganización atómica que transcurre posteriormente..
A diferencia de otras reacciones de halogenación, ésta tiene lugar en ausencia de un transportador de halógenos. La reacción es iniciada por la adición de una cantidadcatalítica de PBr3, sobre la cual se agrega un equivalente molar de Br2
En el caso de que se use una solución acuosa durante la reacción, necesitaremos de un equivalente molar de PBr3 para interrumpir el proceso catalítico. Si existe una pequeña cantidad de solvente nucleofílico, la reacción del bromuro de α-bromo acilo con el ácido carboxílico nos da el ácido α-bromo carboxílico y regenera el bromuro de acilo intermedio. En la práctica, se usa un equivalente molar de PBr3 para poder aumentar la cinética de la reacción que es lenta.
El mecanismo descrito para el intercambio entre el bromuro de alcanoílo o acilo y el ácido carboxílico se encuentra debajo. El bromuro de α-bromoalcanoílo posee un grupo carbonilo fuertemente electrofílico debido al efecto electroatrayente de los dos bromuros. El ácido carboxílico actúa como un nucleófilo donde el oxígeno carbonílico del ácido carboxílico posee una carga parcial negativa.









No hay comentarios:
Publicar un comentario